Способы определения типа ингибирования фермента
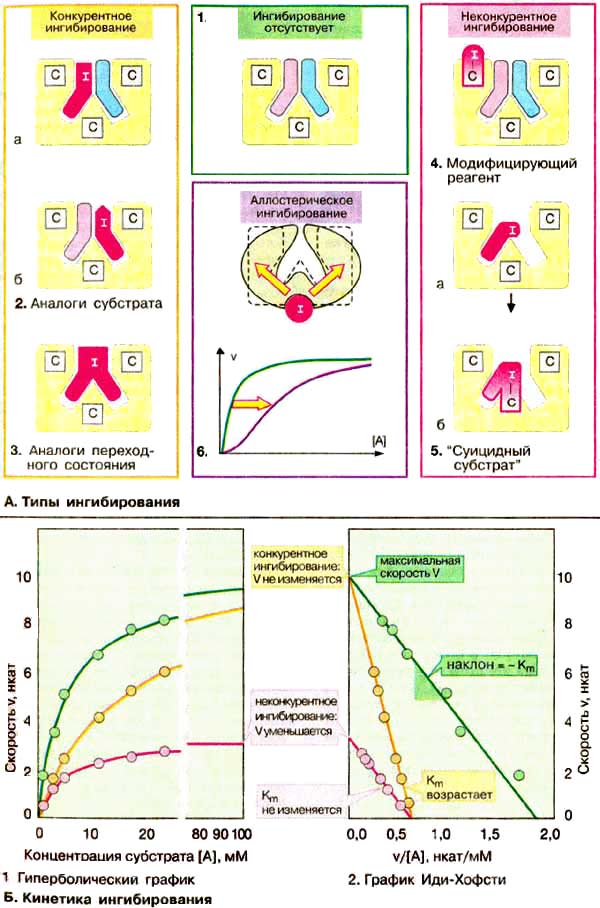
А. Типы ингибирования
Большинство ингибиторов ферментов действуют обратимо , т. е. не вносят в молекулу фермента каких-либо изменений после своей диссоциации. Однако существуют также необратимые ингибиторы ферментов, которые необратимо модифицируют целевой фермент. Принцип действия ингибитора, тип его ингибирования определяют путем сравнения кинетики реакции (см. с. 98) в присутствии ингибиторам без него (см. схему Б ). Различают конкурентное ( А , слева) и неконкурентное ( А , справа) ингибирование . В регуляции обмена веществ важную роль играет аллостерическое ингибирование ( А , 6).
Так называемые аналоги субстрата ( 2 ) имеют свойства, подобные свойствам субстрата целевого фермента. Они обратимо блокируют часть молекул имеющегося в наличии фермента, но не могут далее превращаться в продукт. Поэтому для достижения половины максимальной скорости реакции необходимы более высокие концентрации субстрата: в присутствии такого ингибитора константа Михаэлиса K m растет ( Б ). Субстрат в высоких концентрациях вытесняет ингибитор с фермента. Поэтому максимальная скорость V (см. с. 98) при этом типе торможения не претерпевает изменений. Так как субстрат и ингибитор конкурируют за место связывания на ферменте, данный тип торможения называют конкурентным. Аналоги переходного состояния ( 3 ) также действуют как конкурентные ингибиторы.
Если ингибитор реагирует с функционально важной группой фермента, не препятствуя связыванию субстрата, такое ингибирование называется неконкурентным (на схеме справа). В этом случае K m остается неизменной, напротив уменьшается концентрация функционально активного фермента [Е] t и, следовательно, максимальная скорость реакции V. Неконкурентные ингибиторы действуют как правило необратимо , поскольку они модифицируют функциональные группы целевого фермента ( 4 ).
В случае так называемых » суицидных субстратов » ( 5 ) речь идет о субстратных аналогах, содержащих дополнительно реакционную группу. Вначале они связываются обратимо, а затем образуют ковалентное соединение с активным центром фермента. Поэтому ингибирование такими соединениями проявляется как неконкурентное. Известным примером такого ингибитора является антибиотик пенициллин (см. с. 250).
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра ( 6 ). Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности (см. с. 118). Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Б. Кинетика ингибирования
Конкурентное ингибирование легко можно отличить от неконкурентного при использовании графика Иди-Хофсти (см. с. 98). Как уже упоминалось, конкурентные ингибиторы влияют только на K m , но не на V. Полученные в отсутствие и в присутствии ингибитора прямые на графике пересекаются на оси ординат. Прямые для неконкурентного ингибирования имеют одинаковый наклон (К m не изменяется), однако по мере увеличения концентрации ингибитора отрезки, отсекаемые этими прямыми на оси ординат, становятся все короче. Для аллостерических ферментов нельзя применять график Иди-Хофсти, имеющий в этом случае нелинейный характер (здесь не приведен).
Источник
9..Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное, определение вида ингибирования с использованием Км.
Под термином «ингибирование ферментативной активности» понимают снижение каталитической активности в присутствии определённых веществ — ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибитррам не относят.
Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные.
А. Обратимое ингибирование
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
1. Конкурентное ингибирование
К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор — структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется.
Кинетические зависимости
Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax.
Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом.
Лекарственные препараты как конкурентные ингибиторы
Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования.
Антиметаболиты как лекарственные препараты
В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой — могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью; в результате наблюдают снижение скорости определённых метаболических путей.
В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний, аналоги нуклеотидов для лечения онкологических заболеваний.
2. Неконкурентное ингибирование
Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата.
Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Кинетические зависимости
Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm.
Б. Необратимое ингибирование
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg 2+ ), серебра (Ag + ) и мышьяка (As 3+ ), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению . При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
1. Специфические и неспецифические ингибиторы
Использование необратимых ингибиторов представляет большой интерес для выяснения механизма действия ферментов. С этой целью применяют вещества, блокирующие определённые группы активного центра ферментов. Такие ингибиторы называют специфическими. Ряд соединений легко вступает в реакции с определенными химическими группами. Если эти группы участвуют в катализе, то происходит полная инактивация фермента.
Роль гидроксильных групп серина в механизме катализа исследуют с помощью фторфосфатов, например диизопропилфторфосфата. Дии-зопропилфторфосфат (ДФФ) специфически реагирует лишь с одним из многих остатков серина в активном центре фермента. Остаток Сер, способный реагировать с ДФФ, имеет идентичное или очень сходное аминокислотное окружение.
2. Необратимые ингибиторы ферментов как лекарственные препараты
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, — широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты.
Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
Источник
Способы определения типа ингибирования фермента
Как известно, ингибиторы различают по типу их взаимодействия с ферментом. Необратимые ингибиторы ковалентно связываются с активным центром фермента, связь обратимых ингибиторов менее прочная. Обычно для установления того, каким именно ингибитором является исследуемое вещество, реакционную смесь, содержащую все компоненты ферментативной реакции, подвергают диализу или проводят гельхроматографирование с целью отделить фермент от других компонентов. В результате этого сравнительно непрочная связь обратимого ингибитора с ферментом разрывается и активность фермента полностью восстанавливаетсяю Если взаимодействие фермента шло с необратимым ингибитором, то фермент-ингибиторный комплекс обычно не распадается и активность фермента не восстанавливается. Проявление ингибирующего действия на иммобилизованные ферменты существенно отличается от их действия в гомогенных системах. Для определения типа ингибирования в иммобилизованных ферментах нет необходимости проводить диализ или гельхроматографию: достаточно отмыть иммобилизованный фермент от избытка ингибитора и определить активность фермента до и после действия ингибитора. Для обратимого ингибитора активность фермента до и после действия ингибитора должна быть одинакова, для необратимого — активность фермента не восстанавливается, частичное восстановление активности иммобилизованного фермента говорит о том, что взаимодействие шло с комбинированным ингибитором [34], т.е. имело место обратимое и необраптимое ингибирование одновременно.
Действие необратимого ингибитора обычно возрастает с увеличением времени реагирования, поэтому оно может характеризоваться константой скорости взаимодействия фермента с ингибитором [35]:


— необратимый ингибитор





Обычно взаимодействие фермента с необратимым ингибитором характеризуют сложной бимолекулярной константой скорости кII, которая при времени протекания реакции
t  | равна |  |
При [IН] >> [E] бимолекулярная константа рассматривается как псевдомономолекулярная. Если
t  | и [IН] >> [E], значение кII может быть вычислено по уравнению: |

где  | и | — н ачальные скорости ферментативной реакции в отсутствие ингибитора и после |
взаимодействия с ним фермента в течение t минут соответственно.
Отсюда концентрация необратимого ингибитора для данного времени взаимодействия t и постоянных условий проведения ферментативной реакции (рН, ионная сила и т.д.) может быть вычислена после измерения активности фермента до и после взаимодействия с необратимым ингибитором по уравнению:

Практически эта зависимость справедлива только для высокоэффективных ингибиторов:

где b — коэффициент пропорциональности.
Поскольку при [IН] >> [E] взаимодействие фермента с необратимым ингибитором нарастает при увеличении времени взаимодействия, то предел обнаружения ингибитора в известных рамках может быть снижен увеличением времени t . Для случая [IН ] и может быть снижен при уменьшении [E0].
Обратимые ингибиторы по особенностям их влияния на скорость ферментативной реакции подразделяют на конкурентные, бесконкурентные, смешанные и неконкурентные. Взаимодействие обратимых ингибиторов можно представить схемой:

где EI — фермент-ингибиторный комплекс, ESI — фермент-субстратный ингибиторный комлекс, Кi , a Кi — константы конкурентного и бесконкурентного ингибирования соответственно, к1, к-1, к2, a к-1, b к2 — константы скоростей соответствующих стадий реакции.
Этой схеме соответствует уравнение скорости ферментативной реакции в присутствии обратимого ингибитора:

Oбычно для ингибиторов a >1 и b b® 0, a может быть меньше 1. Для активаторов, действие которых описывается тем же уравнением, a b >1. Если a® ¥ , ингибитор конкурирует за активный центр с субстратом E + I = EI, имеет место полное конкурентное торможение. Если a® 0, конкурентное торможение практически отсутствует, ингибитор взаимодействует с фермент-субстратным комплексом, имеет место бесконкурентное торможение. Смешанный тип ингибирования характеризуется сочетанием конкурентного и бесконкурентного торможения, т.е. идет связывание ингибитора и с активным центром фермента, и с фермент-субстратным комплексом. Неконкурентное ингибирование является частным случаем смешанного торможения: a = 1 , b = 0 . Каждый из этих процессов описывается уравнением, являющимся частным случаем вышеприведенного общего уравнения (13). Во всех случаях относительное изменение активности фермента в присутствии обратимого ингибитора при прочих равных условиях прямо пропорционально концентрации ингибитора. Для конкурентного ингибирования

Предел обнаружения конкурентного ингибитора зависит от [S]. При [S]
В этом случае достигается минимальный для данной фермент-субстратной системы предел обнаружения (при прочих равных условиях).
Для бесконкурентного ингибитора

Предел обнаружения в этом случае не зависит от [S], если [S] >>Km.. При [S] > Km предел обнаружения [I] возрастает с уменьшением [S]. Таким образом, для определения коецентрации ингибитора бесконкурентного типа желательно использовать высокие [S].
Для смешанного ингибирования

Если a>1 (конкурентно-смешанный тип ингибирования), с уменьшением [S] предел обнаружения ингибитора снижается. При [S] достигается минимальный предел обнаружения, соответствующий

Если a (неконкурентно-смешанный тип ингибирования), предел обнаружения ингибитора снижается с увеличением [S] аналогично бесконкурентному ингибитору.
Для неконкурентного ингибирования ( a=1)

Предел обнаружения ингибитора в этом случае не зависит от [S], что обычно уменьшает погрешность определения ингибитора.
Вышеприведенные зависимости лежат в основе определения обратимых ингибиторов с помощью ферментов.
В ферментных электродах с иммобилизованным ферментом ингибирование происходит в гетерогенной среде и характеризуется особенностями превращения субстратов и диффузионными ограничениями [33]. Изменение концентрации субстрата и насыщение субстратом иммобилизованного фермента отличаются от ферментного раствора в сторону больших концентраций субстрата. При иммобидизации также изменяются значения кинетических параметров ферментативной реакции и даже в некоторых случаях тип ингибирования [38].
Применение ферментных электродов в анализе естественно предполагает многократность их действия. Поэтому определение обратимых ингибиторов с помощью ферментных электродов имеет явные преимущества перед определением необратимых. Для обратимых ингибиторов многократность действия иммобилизованного фермента обусловливается легкостью восстановления ферментативной активности обычным промыванием электрода. Для необратимых ингибиторов в большинстве случаев для восстановления активности фермента необходимо использовать специальные реактиваторы.
Особенностью обратимых ингибиторов является то, что тип ингибирования ими зависит не только от природы фермента и ингибитора, но и от природы субстрата, используемого в реакции [39], а также состава реакционной среды [40]. Как следует из вышеизложенного, тип ингибирования играет существенную роль при подборе оптимальных условий проведения анализа. Поэтому перед началом определения ингибитора необходимо установить, какой тип ингибирования имеет место для выбранной фермент-субстратной системы и составе реакционной среды.
В работе [33] подробно рассматриваются особенности определения ингибиторов с помощью ферментных электродов. В том числе уделено внимание определению типа обратимого ингибитора для фермента, иммобилизованного на поверхности электрода. При конкурентном ингибировании максимальная скорость ферментативной реакции не изменяется, увеличивается только константа Михаэлиса. При бесконкурентном торможении величина Km и V меняется в одинаковое число раз. Неконкурентное торможение вызывает уменьшение V, но не изменяет значение Кm. В смешанном торможении происходит изменение величин V и Кm в разное число раз.
Градуировочными характеристиками ферментного электрода для определения ингибиторов служит зависимость отклика электрода ( % ингибирования) от логарифма концентрации ингибитора при фиксированной концентрации субстрата. Крутизна электродной характеристики электрода для определения ингибиторов обычно ниже, чем для субстратов.
Область концентраций ингибитора, вызывающая отклик ферментного электрода, зависит от концентрации фермента (его активности): чем меньше активность иммобилизованного фермента, тем ниже область концентраций ингибиторов, определяемых с его помощью. Таким образом, требования к ферментным электродам для определения ингибиторов существенно отличаются от требований, предъявляемых к ферментным электродам для определения субстратов. Концентрация связывающего агента и время контакта с ним иммобилизуемого фермента также существенны для выбора оптимальных условий приготовления ферментного электрода для определения ингибиторов. Увеличение концентрации связывающего агента и времени его контакта с ферментом ведет к денатурации последнего и соответственно к уменьшению его активности.
Зависимость диапазона измеряемых концентраций ингибитора от концентрации субстрата в ферментных электродах подчиняется тем же закономерностям, что и для неиммобилизованного фермента (см. выше). Но при этом надо учесть, что тип ингибирования иммобилизованного фермента и неиммобилизованного одним и тем же ингибитором может быть разным. Так, в работе [38] показано, что многие конкурентные ингибиторы холинэстеразы при иммобилизации последней в желатине становятся неконкурентными.
Для определения ингибиторов также, как и субстратов необходимо установить оптимум рН и температуры реакционной смеси, которые обычно отличаются от таковых для неиммобилизованного фермента [например,20].
Время инкубации обратимого ингибитора с ферментом при достижении предварительно стационарного значения потенциала электрода не существенно. Время достижения стационарного значения потенциала электродом для ингибиторов выше, чем в электродах для субстратов. Его величина обычно составляет не менее 2-3 минут, но часто оно бывает и больше .
Действие необратимых ингибиторов с иммобилизованным ферментом, так же, как и с неиммобилизованным, зависит от времени контакта фермента с инибитором в отсутствие субстрата. Субстрат, если он присутствует в реакционной среде в достаточной концентрации, может полностью прекратить взаимодействие необратимого ингибитора с ферментом. Даже при низких концентрациях субстрат значительно ослабляет действие ингибитора. Поэтому ферментный электрод предварительно выдерживают в растворе исследуемого необратимого ингибитора определенное время, затем в реакционную смесь добавляют субстрат в заданной концентрации и фиксируют значение стационарного потенциала. Отклик ферментного электрода увеличивается при увеличении времени инкубации фермента с необратимым ингибитором для данной его концентрации. Градуировочной характеристикой ферментных электродов для определения необратимых ингибиторов является зависимость потенциала электрода от логарифма концентрации ингибитора при фиксированном (одном и том же) времени выдерживания электрода в растворе с ингибитором. Оптимальные уловия проведения определения необратимых ингибиторов нгесколько отличается от условий определения обратимых ингибиторов. При работе с ферментным электродом приходится выбирать рН и температуру, благоприятствующие взаимодействию ингибитора и фермента, и таковые, благоприпятствующие работе электрода с субстратом. Увеличение температуры ускоряет реакцию фермента с ингибитором, но может ввызвать инактивацию самого фермента за счет температурной денатурации. Что касается концентрации субстрата, то обычно ее выбирают достаточно большой.
Некоторые необратимые ингибиторы определяют также, как обратимые. Это возможно, если константа скорости распада фермент-ингибиторного ковалентно связанного комплекса (к3) достаточно высока. Примером таких необратимых ингибиторов могут быть карбамиаты, характеризующиеся высокой скоростью декарбамилирования активного центра холлинэстераз. Поэтому их определение в работах [33, 41] описывается как определение обратимых ингибиторов. В этом случае восстановление активности холинэстеразы происходит сравнительно легко при тщательном промывании электрода буферным раствором.
В отдельных случаях определение необратимых ингибиторов приходится вести в присутствии субстрата, например, если электрод работает в непрерывном режиме, в потоке [42]. В таких определениях концентрацию субстрата выбирают минимальной.
Для восстановления активности фермента и, соответственно, обеспечения многократности действия ферментного электрода после инактивации необратимыми ингибиторами, обычно применяют реактиваторы, разрушающие фермент-ингибиторный ковалентный комплекс. Процесс реактивации характеризуется определенной скоростью, зависящей от природы фермента, ингибитора и реактиватора, а также от концентрации реактиватора и и температуры реакционной среды. Зависимость от природы реактиватора и фермент-ингибиторного комплекса выражается константой скорости реактивациию. Для иммибилизованных ферментов величина константы скорости реактивации для ряда исследованных ингибиторов холинэстеразы не отличается от таковой для неиммобилизованного фермента [43]. Тем неменее необходимость использовать реактиватор при определении ферментными электродами необратимых ингибиторов в достаточной степени усложняет и удлиняет процесс.
Источник






