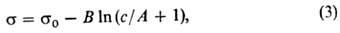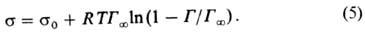ПОВЕРХНОСТНАЯ АКТИВНОСТЬ
ПОВЕРХНОСТНАЯ АКТИВНОСТЬ, способность в-ва при адсорбции на границе раздела фаз понижать поверхностное натяжение (межфазное натяжение). Адсорбция Г в-ва и вызванное ею понижение поверхностного натяжения s связаны с концентрацией с в-ва в фазе, из к-рой в-во адсорбируется на межфазную пов-сть, ур-нием Гиббса (1876):

где R-газовая постоянная, Т-абс. т-ра (см. Адсорбция). Производная 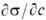
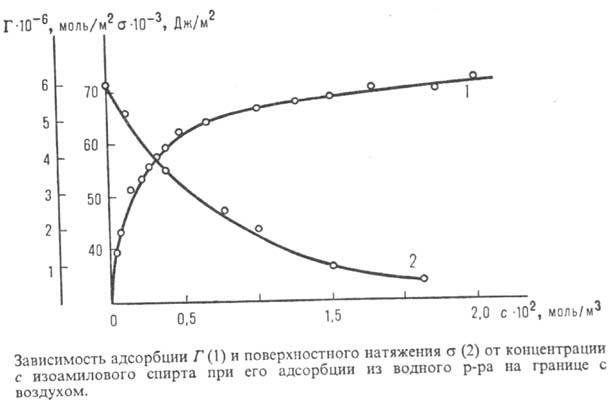
П оверхностную активность определяют с помощью изотерм адсорбции, на к-рых можно выделить линейный участок роста Г с увеличением с и предельное значение 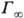
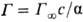
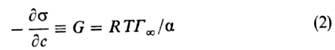
( 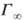
В случае адсорбции в-ва из р-ра поверхностная активность определяется на основании эмпирич. ур-ния Шишковского (1908):
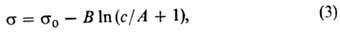
где s 0 — поверхностное натяжение чистого р-рителя, В -эмпирич. постоянная, практически не зависящая от природы в-ва и равная примерно 0,2 при 293 К, 1/А-уд. капиллярная постоянная, характеризующая природу в-ва (см. Капиллярные явления). После дифференцирования ур-ние (3) принимает вид:

Ур-ние Шишковского позволяет определять поверхностную активность данного в-ва более строго, чем ур-ние Ленгмюра, из-за отсутствия концентрац. ограничений. Третьим ур-нием, используемым для определения поверхностной активности, является ур-ние изотермы адсорбции Фрумкина (1949):
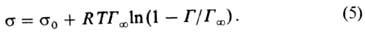
Все три ур-ния — Ленгмюра, Шишковского и Фрумкина — являются частными случаями ур-ния Гиббса (1).
При прочих равных условиях (т-ра, состав р-ра) поверхностная активность в-ва зависит в первую очередь от состава и строения молекул.
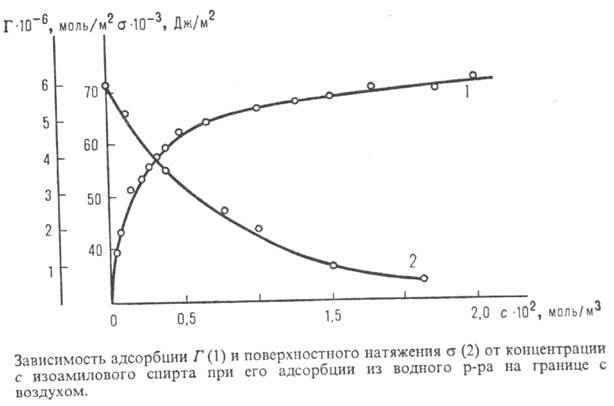
Наибольшей поверхностной активностью обладают, как показали в 1916-17 И. Ленг-мюр и У. Харкинс, в-ва, молекулы к-рых дифильны, т. е. состоят из полярных и неполярных частей. Такие в-ва наз. поверхностно-активными веществами (ПАВ). Полярная (гидрофильная) часть молекулы при адсорбции ориентируется в сторону полярной фазы (обычно воды), неполярная часть — углеводородный радикал — выталкивается из полярной фазы, ориентируясь в направлении менее полярной фазы, напр. воздуха, углеводородных или др. орг. жидкостей. Молекулы ПАВ образуют при адсорбц. насыщении как бы двухмерную (мономолекулярной толщины) кристал-лич. решетку. Это дает возможность определять размеры и структуру адсорбирующихся молекул и устанавливать их связь с поверхностной активностью (см. Мономолекулярный слои).
Осн. параметры адсорбц. слоя ПАВ, помимо уже упоминавшейся поверхностной активности 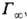
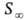
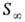

где N А — постоянная Авогадро. Значение d связано с массой M 1 моля в-ва в адсорбц. слое при насыщении:

где d- плотность в-ва в адсорбц. слое, равная его плотности в чистом состоянии. Из (6) и (7) следует:
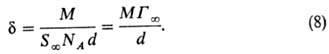
При адсорбции в-в, относящихся к одному гомологич, ряду, переход от одного члена ряда к следующему изменяет d на постоянную величину, равную длине звена CH 2 . Чем длиннее неполярная часть молекулы, тем сильнее ее склонность к ориентации. По этой причине поверхностная активность ПАВ возрастает с увеличением длины углеводородного радикала. Согласно эмпирич. правилу Дюкло-Траубе, при одинаковой концентрации в р-ре ПАВ его поверхностная активность возрастает в 3-3,5 раза при увеличении углеводородной цепи на одну группу CH 2 . Это значение подтверждается расчетом изменения работы переноса молекулы ПАВ из объема р-ра на межфазную границу для двух соседних гомологов.
Для р-ров ПАВ в неполярных р-рителях на границе с воздухом, в отличие от водных р-ров, с увеличением длины углеводородного радикала р-римость ПАВ возрастает. При адсорбции из углеводородного р-рителя на границе с водой размер углеводородного радикала практически не влияет на поверхностную активность. Напр., для жирных к-т работа адсорбции определяется переносом гл. обр. группы COOH из объема неполярной среды на границу раздела фаз. Аналогично протекает адсорбция жирных к-т из неполярных р-рителей на твердых полярных адсорбентах, напр. силикагеле. С увеличением мол. массы к-ты адсорбция даже уменьшается, т. к. высшие жирные к-ты лучше растворимы в неполярной среде, чем в воде. Адсорбция ПАВ из воды на неполярных адсорбентах подчиняется правилу Дюкло-Траубе. Отсюда следует, что чем меньше р-римость в-ва в к.-л. среде, тем больше его поверхностная активность на границе с этой средой. Так, поверхностная активность анилина на границе вода-толуол, вычисленная с водной стороны: G H2O = = 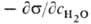
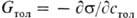
С повышением т-ры поверхностная активность любых в-в уменьшается вследствие десорбции.
Лит.: Абрамзон А. А., Поверхностно-активные вещества. Свойства и применение, 2 изд., Л., 1981; Успехи коллоидной химии, под ред. П. А. Ребиндера и Г. И. Фукса, M., 1973; то же, под ред. Ф. Д. Овчаренко, К., 1983; то же, под ред. И. В. Петрянова-Соколова и К. С. Ахмедова, Ташкент, 1987. В. П. Тихонов.
Источник
Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Поверхностная активность. Поверхностно-активные и инактивные вещества
В адсорбционном уравнении Гиббса (11.70) влияние природы веществ на адсорбцию отражает производная да/да. Эта производная определяет и знак гиббсовской адсорбции. Таким образом, величина да/да может служить характеристикой поведения веществ при адсорбции. Чтобы исключить влияние концентрации на производную и придать этой величине вид характеристической постоянной, берут ее предельное значение при с-*-0; эту величину П. А. Ребиндер (1924 г.) назвал поверхностной активностью. Ее общее определение дается соотношением (Ю. Г. Фролов, 1987 г.)
Которое справедливо как для неэлектролитов, так и для электролитов. При положительной адсорбции величина да/да имеет отрицательный знак [см. уравнение (11.70)]. Чтобы’знаки поверхностной активности и гиббсовской адсорбции совпадали, в уравнении (11.75) перед производной ставят знак минус.
Общее определение поверхностной активности при переходе к концентрациям (для разбавленных систем активность можно заменить на концентрацию) принимает соответствующие выражения:
Для неэлектролитов g = — >д 0, да/дс 0
Вещества, повышающие поверхностное натяжение на границе раздела фаз с увеличением концентрации, называют поверх — постно-инактивными. Для них
G 0 (или Da/Dcv± >0) и Г 0). ПАВ типа обычных мыл (олеат натрия) в концентрации 10
3 моль/л понижают о воды при 298 К с 72,5 до 30 мДж/м2. Это значит, что в определенной толщине поверхностного слоя концентрация ПАВ в 3-Ю[2] раз (т. е. в десятки тысяч раз) превышает концентрацию ПАВ в объеме раствора.
Примером поверхностно-ииактивных веществ по отношению к воде являются неорганические соли, которые сильно гидрати — руются. Они взаимодействуют с водой сильнее, чем молекулы воды между собой. Вследствие этого они имеют отрицательную величину адсорбции (Г
Из уравнений (11.83) и (11.84) видно, что для расчета дифференциальных изменений энтропии и энтальпии необходимо знать зависимость давления пара от температуры при постоянной величине адсорбции Г (определение изостер). По этим зависимостям можно получить необходимые значения температурных коэффициентов для давления пара при данных заполнениях поверхности адсорбента — величинах адсорбции. Первый член правой части уравнения (11.84) выражает дифференциальную теплоту адсорбции:
Второй член отвечает теплоте объемной конденсации пара:
Изменение энтальпии адсорбции получило название чистой дифференциальной теплоты адсорбции-.
Источник
главная > справочник > химическая энциклопедия:
Поверхностная активность
Поверхностная активность, способность вещества при адсорбции на границе раздела фаз понижать поверхностное натяжение (межфазное натяжение). Адсорбция Г в-ва и вызванное ею понижение поверхностного натяжения s связаны с концентрацией с в-ва в фазе, из которой вещество адсорбируется на межфазную поверхность, уравнением Гиббса (1876):
где R- газовая постоянная, Т -абс. температура (см. Адсорбция). Производная 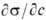
Поверхностную активность определяют с помощью изотерм адсорбции, на которых можно выделить линейный участок роста Г с увеличением с и предельное значение 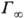

( 
В случае адсорбции вещества из раствора поверхностная активность определяется на основании эмпирич. уравнения Шишковского (1908):
где s 0 — поверхностное натяжение чистого растворителя, В -эмпирич. постоянная, практически не зависящая от природы вещества и равная примерно 0,2 при 293 К, 1 /А -уд. капиллярная постоянная, характеризующая природу вещества (см. Капиллярные явления). После дифференцирования уравнение (3) принимает вид:
Уравнение Шишковского позволяет определять поверхностную активность данного вещества более строго, чем уравнение Ленгмюра, из-за отсутствия концентрационных ограничений. Третьим уравнением, используемым для определения поверхностной активности, является уравнение изотермы адсорбции Фрумкина (1949):
Все три уравнения — Ленгмюра, Шишковского и Фрумкина — являются частными случаями уравнения Гиббса (1).
При прочих равных условиях (температура, состав раствора) поверхностная активность вещества зависит в первую очередь от состава и строения молекул.
Наибольшей поверхностной активностью обладают, как показали в 1916-17 И. Ленгмюр и У. Харкинс, вещества, молекулы которых дифильны, т. е. состоят из полярных и неполярных частей. Такие вещества наз. поверхностно-активными веществами (ПАВ). Полярная (гидрофильная) часть молекулы при адсорбции ориентируется в сторону полярной фазы (обычно воды), неполярная часть — углеводородный радикал — выталкивается из полярной фазы, ориентируясь в направлении менее полярной фазы, например воздуха, углеводородных или др. орг. жидкостей. Молекулы ПАВ образуют при адсорбц. насыщении как бы двухмерную (мономолекулярной толщины) кристаллич. решетку. Это дает возможность определять размеры и структуру адсорбирующихся молекул и устанавливать их связь с поверхностной активностью (см. Мономолекулярный слои).
Осн. параметры адсорбц. слоя ПАВ, помимо уже упоминавшейся поверхностной активности 
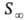
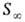
где N А — постоянная Авогадро. Значение d связано с массой M 1 моля вещества в адсорбц. слое при насыщении:
где d- плотность вещества в адсорбц. слое, равная его плотности в чистом состоянии. Из (6) и (7) следует:
При адсорбции веществ, относящихся к одному гомологич, ряду, переход от одного члена ряда к следующему изменяет d на постоянную величину, равную длине звена CH 2 . Чем длиннее неполярная часть молекулы, тем сильнее ее склонность к ориентации. По этой причине поверхностная активность ПАВ возрастает с увеличением длины углеводородного радикала. Согласно эмпирич. правилу Дюкло-Траубе, при одинаковой концентрации в растворе ПАВ его П. а. возрастает в 3-3,5 раза при увеличении углеводородной цепи на одну группу CH 2 . Это значение подтверждается расчетом изменения работы переноса молекулы ПАВ из объема раствора на межфазную границу для двух соседних гомологов.
Для растворов ПАВ в неполярных растворителях на границе с воздухом, в отличие от водных растворов, с увеличением длины углеводородного радикала растворимость ПАВ возрастает. При адсорбции из углеводородного растворителя на границе с водой размер углеводородного радикала практически не влияет на поверхностную активность. Например, для жирных кислот работа адсорбции определяется переносом главным образом группы COOH из объема неполярной среды на границу раздела фаз. Аналогично протекает адсорбция жирных кислот из неполярных растворителей на твердых полярных адсорбентах, например силикагеле. С увеличением мол. массы кислоты адсорбция даже уменьшается, т. к. высшие жирные кислоты лучше растворимы в неполярной среде, чем в воде. Адсорбция ПАВ из воды на неполярных адсорбентах подчиняется правилу Дюкло-Траубе. Отсюда следует, что чем меньше растворимость вещества в к.-л. среде, тем больше его поверхностная активность на границе с этой средой. Так, поверхностная активность анилина на границе вода-толуол, вычисленная с водной стороны: G H2O = = 

С повышением температуры поверхностная активность любых веществ уменьшается вследствие десорбции.
Лит.: Абрамзон А. А., Поверхностно-активные вещества. Свойства и применение, 2 изд., Л., 1981; Успехи коллоидной химии, под ред. П.А. Ребиндера и Г. И. Фукса, M., 1973; то же, под ред. Ф. Д. Овчаренко, К., 1983; то же, под ред. И. В. Петрянова-Соколова и К. С. Ахмедова, Ташкент, 1987. © В. П. Тихонов.
Источник