Способы определения первичной структуры белка
кафедра органической химии
ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА
Определение первичной структуры белка требут предварительного проведения ряда операций. Белок должен быть тщательно очищен, чистота материала должна быть подтверждена как минимум двумя независимыми методами. Чаще всего использется гель-электрофорез на полиакриламиде (ПААГ) и ультрацентрифугирование . После очистки белка его делят на две-три или более частей. Каждую часть обрабатывают разными ферментам и- протеиназами (трипсин, химотрипсин) или реагентами (бромциан, иодозобензойная кислота). В результате получают два-три (или более) наборов полипептидов (отрезков белка). К ферментам- протеиназам предъявляются особые требования по чистоте, иначе будет затруднено последующее определение последовательности чередования отрезков пептидов в нативной цепи белка. Особые сложности представляет распознавание мест дисульфидных мостиков между остатками цистеина. Полученная смесь пептидов разделяется электрофорезом, после чего возможно начать непосредственно процедуру севенирования . Длина отдельного пептида не должна превышать 40 АК-остатков.
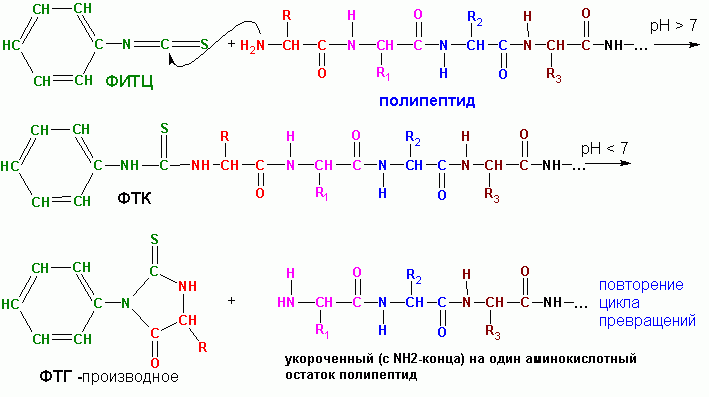
Наиболее часто используемым методом секвенирования пептидов (установления последовательности АК-остатков в них) является процедура П. Эдмана , с использованием фенилизотиоцианата (ФИТЦ). Процедура лежит в основе работы автоматических секвенаторов . Образец очищенного пептида наносится на поверхность реакционного сосуда в виде пленки. Часто осуществляют ковалентное пришивание пептида с конца свободной СООН-группы с материалом поверхности реакционного сосуда. После чего проводят повторяющиеся циклы из серии реакций. Одна серия реакций включает:
— взаимодействие ФИТЦ с концевым АК-остатком, имеющим свободную NH2-группу, при этом образуется так называемое ФТ К- ( фенилтиокарбамоил )-производное:
— избыток ФИТЦ удаляется, меняется рН среды добавлением гептафтормасляной кислоты, при этом происходит превращение ФТК в ФТГ ( фенилтиогидантоин )-производное:
— ФТГ-производное аминокислоты удаляется из реакционной среды экстракцией с 1-хлорбутаном и серия реакций повторяется в следующем цикле.
За один цикл удаляется один аминокислотный остаток с NH2-края пептида. Поскольку, реакции с ФИТЦ протекают не количественно, а в лучшем случае, на 95 процентов, постепенно накапливаются мешающие фактор ы- ФТГ-производные от не прореагировавших в предыдущие циклы АК-остатков. В самых благоприятных случаях удается надежно идентифицировать последовательность всего только около 40 АК-остатков. Однако, благодаря автоматизации процесса, работа все же существенно облегчается.
РАСШИФРОВКА ПРИ ПОМОЩИ ПЕПТИДАЗ:
а) с N-концевых остатков при помощи АМИНОПЕПТИДАЗ ( хроматографическая идентификация и кинетика накопления соответствующих АК.
б) с С-концов при помощи карбоксипептидаз (аналогично).
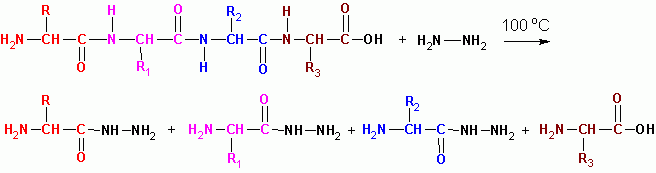
ГИДРАЗИНОЛИЗ (в безводной среде при 100 град С) за исключением последнего остатка со свободной СООН, все превращаются в гидразиды кислот:
Порядок чередования пептидов в молекулах белков определяется по перекрыванию фрагментов пептидов:
G-W-V-R A-O-V-K C-E-C-D триптические пептиды (трипсин)
G-W V-R-A-O V-K-C-E-C-D химотриптические пептиды (химотрипсин)
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
1. Строев Е.А. Биологическая химия. М., 1986.
2. Страйер Л. Биохимия, в 3-х т. М., Мир, 1984.
3. Уайт, Хендлер , Смит и др. Основы биохимии, в 3-х т. М., Мир, 1981.
4. Овчинников Ю.А. Биоорганическая химия, М., Просвещение, 1987.
5. Анисимов и др. Основы биохимии. М., Высшая школа, 1986.
Источник
Способы определения первичной структуры белка

Определение первичной структуры белков
Глава 7. Методы исследования белков
7.3. Определение первичной структуры белков
Определение первичной структуры белков сводится к выяснению порядка расположения аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода секвенирования (от англ. sequence последовательность).
Собственно секвенирование на его сегодняшнем уровне позволяет определить аминокислотную последовательность а полипептидах, размер которых не превышает несколько десятков аминокислотных остатков. В то же время исследуемые полипептидные фрагменты значительно короче тех природных белков, с которыми приходится иметь дело. Поэтому необходимо предварительное разрезание исходного полипептида на короткие фрагменты. После секвенирования полученных фрагментов их необходимо снова сшить в первоначальной последовательности.
Таким образом определение первичной последовательности белка сводится к следующим основным этапам:
1) Расщепление белка на несколько фрагментов длиной, доступной для секвенирования.
2) Секвенирование каждого из полученных фрагментов.
3) Сборка полной структуры белка из установленных структур его фрагментов.
Для специфического расщепления белков по определенным точкам применяются как ферментативные, так и химические методы. Из ферментов, катализирующих гидролиз белков по определенным точкам, наиболее широко используют трипсин и химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет белки после остатков ароматических аминокислот — фенилаланина, тирозина и триптофана. При необходимости специфичность трипсина может быть повышена или изменена. Например, обработка цитраконовым ангидридом исследуемого белка приводит к ацилированию остатков лизина. В таком модифицированном белке расщепление будет проходить только по остаткам аргинина.
Наряду с ферментативными методами используются и химические методы расщепления белков. Для этой цели часто применяют бромциан, расщепляющий белок по остаткам метионина:
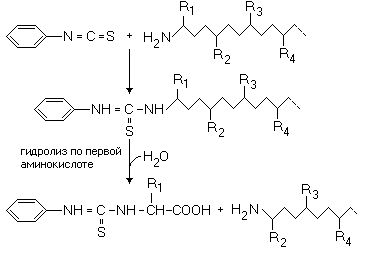
Секвенирование проводят методом, известным как метод Эдмана. Последовательная обработка полипептида, имеющего свободную концевую 
В результате образуется фенилтиогидантоин, содержащий боковой радикал аминокислоты R 1 , который может быть идентифицирован путем измерения какой-либо физической или физико-химической характеристики, позволяющей различать гидантоины, соответствующие разным входящим в состав белков аминокислотам. В качестве такой характеристики может служить хроматографическая подвижность в какой-либо предварительно проградуированной по стандартным образцам гидантоинов системе или молекулярная масса, определяемая с помощью масс-спектрометра.
Превращение N-концевого аминокислотного остатка в тиогидантоин приводит к укорочению анализируемой полипептидной цепи на одно звено. Выделив этот пептид, исследователь получает возможность повторить всю процедуру, установить природу второго аминокислотного остатка и выделить полипептид, укороченный на два звена. Многократное повторение такой ступенчатой деградации дает возможность последовательно идентифицировать все составляющие исходный полипептид остатки аминокислот, т.е. установить его первичную структуру. Практически метод Эдмана позволяет сделать один-два десятка шагов. Работа сводится к многократному повторению одних и тех же чередующихся процедур: добавления изотиоцианата, отщепления тиогидантоина, отделения его от укороченного пептида для последующей идентификации, выделение оставшегося полипептида в виде пригодном для следующего шага обработки. Чтобы избавить исследователей от такой монотонной работы, требующей вместе с тем строгого соблюдения условий эксперимента на каждом шаге, созданы специальные автоматизированные установки для проведения всех перечисленных операций — автоматические секвенаторы полипептидов. С их помощью удается произвести до 40-60 шагов ступенчатой деградации.
Завершающим этапом установления первичной структуры белка является восстановление порядка, в котором просеквенированные фрагменты располагались в исходном полипептиде. Чаще всего для этой цели используют подход изветный как метод перекрывающихся белков. Ниже излагается основная идея метода.
Если установлена структура всех полипептидов, полученных расщеплением исследуемого белка с помощью трипсина (далее такие полипептиды обозначаются буквой Т от слова «трипсиновые»), то остается определить для каждого из этих пептидов, с какими двумя Т-пептидами он соседствует с N- и С-конца. В структуре просеквенированных Т-пептидов такая информация полностью отсутствует. Однако ее можно частично, а в ряде случаев и полностью восстановить, если располагать аналогичными данными для серии полипептидов, полученных расщеплением того же исследуемого белка по какой-либо другой группе аминокислотных остатков. Для определенности ниже речь будет идти о полипептидах, полученных расщеплением химотрипсином (пептиды группы С, chymotryptic).
Как видно из рисунка, если два Т-пептида являются соседними в исходной цепи, то существует С-пептид, который либо содержит в своем составе полностью оба или один из рассматриваемых Т-пептидов, либо как минимум содержит С-концевую часть левого и N-концевую часть правого пептида группы Т. этот С-пептид перекрывает два соседних Т-пептида, с чем и связано название метода.
Таким образом, просматривая структуры пептидов Т и С, можно для любой пары Т-пептидов выявить, являются ли они соседями в исследуемом белке или разделены одним или несколькими другими Т-пептидами. Неоднозначность может появиться только в том случае, если перекрываемый каким-либо из С-петидов концевой фрагмент встречается у двух или нескольких Т-пептидов. Вероятность этого как правило невелика. Если это все же происходит, то применяют более сложные методы комбинаторики.
Источник
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА
Деградация по Эдмону
К раствору белка добавляют реактив Эдмона, содержащий фенилизотиоцианат.
Фенилизотиоцианат взаимодействует с альфа-аминогруппой первой (N-концевой) аминокислоты, а затем происходит ее отщепление от полипептидной цепи путем гидролиза:
После этого идентифицируют первую аминокислоту. Затем процесс повторяется.
В настоящее время процесс автоматизирован.
Секвенирование ДНК
Первичная структура любой белковой молекулы напрямую зависит от структуры ДНК-генома. Поэтому сначала выделяют ген, в котором закодирована структура белка. Далее определяют последовательность азотистых оснований в ДНК. Каждая аминокислота в белковой молекуле закодирована сочетанием трех азотистых оснований — триплетом (кодоном) в молекуле ДНК. Например, сочетание трех оснований аденина (ААА) кодирует аминокислоту фенилаланин, а последовательность из трех оснований цитозина – глицин. Это дает возможность получить информацию о первичной структуре белковой молекуле, а, значит, прогнозировать строение всей молекулы в целом, поскольку именно первичная структура определяет строение всех высших уровней организации – и вторичной, и третичной, а, иногда и четвертичной структур.
Для проверки предположений о строении высших структур используется еще один метод:
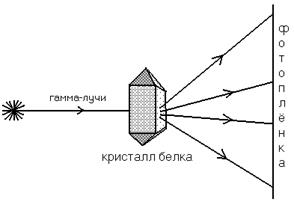
Рентгеноструктурный анализ
Схема, поясняющая принцип этого метода, представлена на рисунке:
В результате облучения на фотопленке фиксируется карта электронной плотности (похожа на географическую карту). Далее производится компьютерный анализ полученного изображения, в результате чего строится пространственная модель белковой молекулы.
Электронная микроскопия
Может быть использована для выяснения структуры белковых молекул с большой молекулярной массой – от 500.000 до 1.000.000 Да (дальтон). Дальтон (Да) и килодальтон (кДа)– единицы измерения массы белков. 1кДа=10 3 Да. 1 дальтон равен 1/16 массы атома кислорода (кислородная единица массы).
КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
Из всего сказанного можно заключить, что пространственная организация белков очень сложна. В химии существует понятие — пространственная КОНФИГУРАЦИЯ — жестко закрепленное ковалентными связями пространственное взаимное расположение частей молекулы (например: принадлежность к L-ряду стереоизомеров или к D-ряду).
Для белков также используется понятие КОНФОРМАЦИЯ белковой молекулы — определенное, но не застывшее, не неизменное взаимное расположение частей молекулы. Так как конформация белковой молекулы формируется при участии слабых типов связей, то она является подвижной (способной к изменениям), и белок может изменять свою структуру. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят друг в друга. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой молекулы. Это обратимые конформационные изменения (встречаются в организме, например, при проведении нервного импульса, при переносе кислорода гемоглобином). При изменении конформации часть слабых связей разрушается, и образуются новые связи слабого типа.
ЛИГАНДЫ
Взаимодействие белка с каким-нибудь веществом иногда приводит к связыванию молекулы этого вещества молекулой белка. Этот явление известно как «сорбция» (связывание). Обратный же процесс — освобождение другой молекулы от белковой называется «десорбция».
Если для какой-нибудь пары молекул процесс сорбции преобладает над десорбцией, то это уже специфическая сорбция, а вещество, которое сорбируется, называется «лиганд».
1) Лиганд белка-фермента – субстрат.
2) Лиганд траспортного белка – транспортируемое вещество.
3) Лиганд антитела (иммуноглобулина) – антиген.
4) Лиганд рецептора гормона или нейромедиатора – гормон или нейромедиатор.
Белок может изменять свою конформацию не только при взаимодействии с лигандом, но и в результате любого химического взаимодействия. Примером такого взаимодействия может служить присоединение остатка фосфорной кислоты.
В природных условиях белки имеют несколько термодинамически выгодных конформационных состояний. Это нативные состояния (природные). Natura (лат.) – природа.
НАТИВНОСТЬ БЕЛКОВОЙ МОЛЕКУЛЫ
НАТИВНОСТЬ — это уникальный комплекс физических, физико-химических, химических и биологических свойств белковой молекулы, который принадлежит ей, когда молекула белка находится в естественном, природном (нативном) состоянии.
Например: белок хрусталика глаза — кристаллин — обладает высокой прозрачностью только в нативном состоянии).
ДЕНАТУРАЦИЯ БЕЛКА
Для обозначения процесса, при котором нативные свойства белка теряются, используют термин ДЕНАТУРАЦИЯ.
ДЕНАТУРАЦИЯ — это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза белковой молекулы длительным кипячением в растворе кислоты или щелочи.
Дата добавления: 2018-11-24 ; просмотров: 3418 ; Мы поможем в написании вашей работы!
Источник