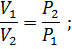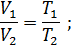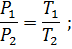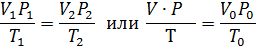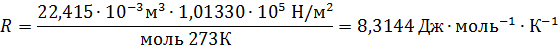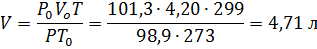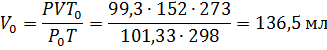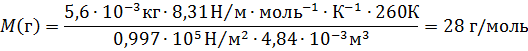Способы определения молярной массы газов
Существует ряд методов определения молекулярной массы газов при определенных внешних параметрах: давлении (Р), объеме (V) и температуре (Т).
1. По закону Авогадро и следствиям из него
Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие 1: один моль любого вещества содержит количество структурных единиц данного вещества, равное постоянной Авогадро (Na = 6,02∙10 23 моль -1 ).
Следствие 2: при нормальных условиях (н.у.) (Р = 10 5 Па, Т = 273 К) один моль любого газа занимает объем 22,4 л. Эта величина получила название молярный объем (VM).
Зная массу m (г) какого-либо объема газа при н.у. и его объем V0 (л), можно рассчитать его молекулярную массу.
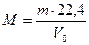 . . | (2.3.1) |
Следствие 3: массы равных объемов двух газов, взятых при одинаковых давлении и температуре, относятся друг к другу, как их молярные массы:
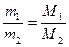 . . | (2.3.2) |
Отношение массы определенного объема первого газа к массе такого же объема второго газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму (D). Тогда:
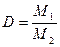 . . | (2.3.3) |
Обычно плотность газа определяют по отношению к водороду (DH2) или воздуху ( 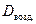
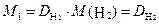 · 2, · 2, | (2.3.4) |
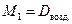 М возд.= М возд.= 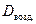 ·29. ·29. | (2.3.5) |
С учётом вышеуказанных условий для расчёта количества вещества используют следующие соотношения:
n 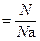 , , | (2.3.6) |
где N – количество структурных единиц в системе;
n 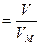 , , | (2.3.7) |
2. По уравнению Клапейрона – Менделеева
Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
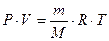 , , | (2.3.8) |
тогда молекулярную массу газа рассчитывают по формуле: 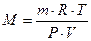 . . | (2.3.9) |
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1).
Источник
Законы газового состояния. Определение молярных масс газообразных веществ



Три параметра – объем V, давление P и температура T (T=273+t) – определяют физическое состояние газа. Давление 1,013∙10 5 Па (760 мм рт. ст.) и температура 273 К или 0 о С называют нормальными условиями состояния газа, что в буквенных обозначениях этих величин указывается индексом: Po, To, to. Объем газа при н.у. – Vo.
Закон Бойля – Мариотта. При постоянной температуре объем данной массы газа изменяется обратно пропорционально давлению:
Закон Гей-Люссака. При постоянном давлении объем данной массы газа меняется прямо пропорционально абсолютной температуре
При постоянном объеме:
Уравнение Менделеева – Клапейрона. Объединение законов Бойля, Мариотта и Гей-Люссака дает уравнение состояния газа
если одно из состояний является нормальным. Для любого газа количеством вещества 1 моль величина 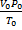
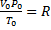
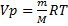
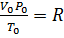
Если объем газа измерен в литрах, а давление газа в мегапаскалях (МПа=10 6 Па), то R=0,083л∙МПа∙моль -1 ∙К -1 . В расчетах обычно используют числа, имеющие три значащие цифры, что дает вполне достаточную точность: 22,4910 -3 м 3 , 22,4 л, 273 К, 8,31 Дж∙моль -1 ∙К -1 .
Согласно закону Авогадро, в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул.
Иными словами, одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется мольным объемом газа и при нормальных условиях (0 0 С, давление 101,325 кПа) равен 22,4 л.
Пример 1.Определить объём, занимаемый 5,25 г азота при 26 0 С и давлении 98,9 кПа (742 мм рт.ст.).
Решение. Зная мольный объём и мольную массу (28,0 г/моль) азота, находим объём, который будут занимать 5,25 г азота при нормальных условиях:
28,0 г азота занимают объём 22,4л
5,25 г азота занимают объём VO ,
откуда VO = 5,25∙22,4/ 28,0 = 4,20 л
Затем приводим полученный объём к указанным в задаче условиям:
Пример 2.При25 0 С и давлении 99,3 кПа (745 мм рт.ст.) некоторое количество газа занимает объём 152 мл. Найти, какой объём займет это же количество газа при 0 0 С и давлении101,33 кПа.
Решение. Подставляя данные задачи в последнее уравнение, получаем:
Пример 3.Некоторый газ массой 5,6 г занимает объём 4,84 л притемпературе 17 0 С и давлении 0,997∙10 5 Па. Чему равна относительная молекулярная масса этого газа?
Решение. Из уравнения Менделеева-Клайперона 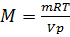
Так как числовое значение молярной массы, выраженной в г/моль, равно относительной молекулярной массе, т.е.
Источник
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·10 23 атомов . Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·10 23 молекул . Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·10 23 × 0,25 = 1,505·10 23 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Источник