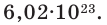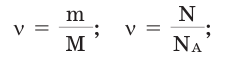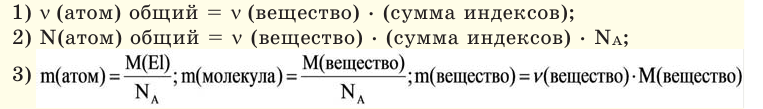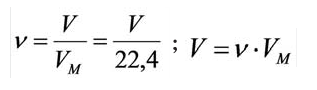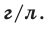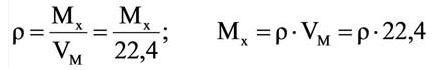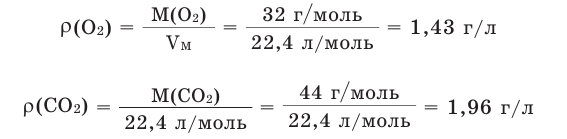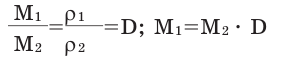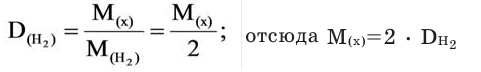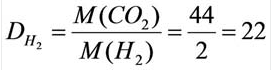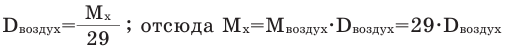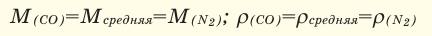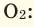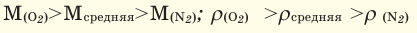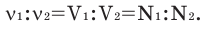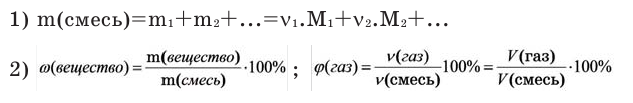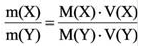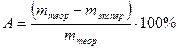Молярная масса в химии — формулы и определения с примерами
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

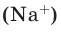

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 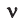
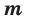
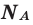
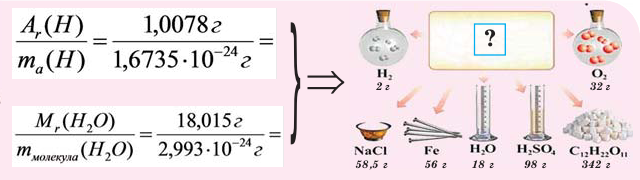
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
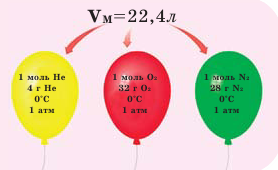
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 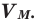
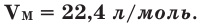
Здесь 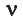
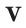
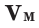
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 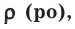
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 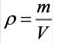
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 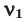
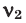
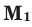
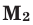

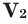
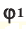
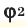
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 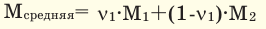
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 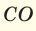
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 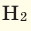
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
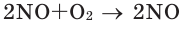
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Источник
Определение молекулярной массы газообразных веществ



Цель работы: экспериментально определить молекулярную массу оксида углерода (IV).
Определение молярной массы газа может быть выполнено несколькими способами.
Чаще всего его определяют исходя из абсолютной и относительной плотности газов.
Абсолютной плотностью газа 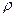
М = 22,4 ∙
Для приведения объёма, газа к нормальным условиям используют уравнение газового состояния
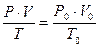
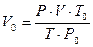
где V – объёма газа, измеренный при реальных условиях, т.е. при атмосферном давлении P и температуре Т.
Относительной плотностью D первого газа по второму называют отношение плотностей этих газов
D = 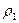
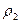
где 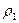
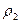
Это отношение можно заменить отношение масс газов, содержащихся в одинаковых объёмах при одинаковой температуре
D = 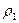
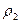
где m1 — масса первого газа,
По закону Авогадро в одинаковых объёмах любых газов при одних и тех же условиях содержится равное число молекул. Следовательно, их массы относятся друг к другу как их молярные массы
Так как m1 / m2 – плотность первого газа по второму, то
Молярную массу газа можно вычислить также, пользуясь уравнением Менделеева – Клайперона
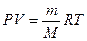
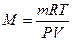
где P – давление, Па;
М – молярная масса, кг/моль;
R — молярная газовая постоянная, равная 8,314 Дж/(моль∙К);
Т – абсолютная температура, К.
Экспериментальная часть
Определение молекулярной массы оксида углерода (IV).
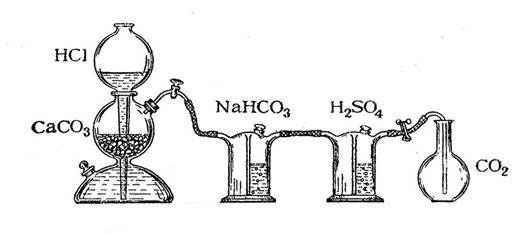
Определение молекулярной массы оксида углерода (IV) проводится в приборе, изображённом на рис.1. Оксид углерода (IV) получается в аппарате Киппа действием 10%-ой соляной кислоты на мрамор:
Оксид углерода (IV) подвергают очистке, пропуская последовательно через растворы NaHCO3 и H2SO4.
Рисунок 1. Аппарат Кипа
Взвесить колбу с пробкой на технохимических весах с точностью до 0,01г. Данные записать. Наполнить колбу оксидом углерода (IV), опустив газоотводную трубку до дна колбы. Закрыть колбу пробкой (пробка должна входить на ту же глубину, что при взвешивании колбы) и вновь взвесить. Чтобы быть уверенным в том, что воздух из колбы полностью вытеснен, и она целиком наполнена оксидом углерода (IV), надо, взвесив колбу, ещё раз на несколько минут опустить в неё газоотводную трубку, опустить и вновь взвесить колбу, повторяя эту операцию до получения постоянной массы колбы. Массу колбы с оксидом углерода (IV) записать. Определить объём колбы, наполнив её водой до пробки, затем измерить объём воды мерным цилиндром и записать результаты. Отметить и записать показания термометра и барометра во время опыта.
Форма записи наблюдений и обработка результатов.
| 1. | Масса колбы (с пробкой) с воздухом – m1, г |
| 2. | Масса колбы (с пробкой) с оксидом углерода (IV) – m2, г |
| 3. | Объём колбы – V, мл |
| 4. | Температура – t, 0 С |
| 5. | Давление – Р1, мм рт.ст. |
По полученным данным вычислить молекулярную массу оксида углерода (IV) с помощью уравнения Менделеева – Клапейрона, исходя из относительной плотности оксида углерода (IV) по водороду, если известно, что масса 1л Н2 при н.у. 0,09г.
В конце опыта вычислить относительную ошибку в процентах:
Вопросы и задачи.
1. Как следует формулировать закон Авогадро? Что показывает число Авогадро?
2. Что называется относительной плотностью газа?
3. Как можно вычислить молекулярную массу вещества, зная плотность его паров по воздуху?
4. Какова плотность по воздуху азота N2, хлора Сl2 и оксида углерода (II) СО?
5. Что тяжелее: сухой углекислый газ или равный объём того же газа, содержащего водяные пары?
6. Масса 1 л газа при нормальных условиях 1,43 г. Чему равна молекулярная масса газа?
7. Вычислить молекулярную массу газа, если относительную плотность его по воздуху равна 0,966.
8. Плотность газа по воздуху 1,17. Определить молекулярную массу газа.
9. Вычислить относительную плотность по воздуху газов: NH3, CH4, N2.
10. Вычислить относительную плотность по воздуху газов: N2O, NO, F2.

11. Вычислить какой объём (н.у.) займут 3,5 г азота; 640 г кислорода; 110 г углекислого газа; 70 г оксида углерода?
12. Какие объёмы занимают при н.у. следующие количества газов: 1 г водорода; 1 г кислорода и 1 г углекислого газа?
13. Сколько молекул содержится в 1 мл водорода при н.у.?
14. Плотность газа по водороду 17. Какова масса 1 л этого газа при н.у.? Какова его плотность по воздуху?
15. Плотность газа по воздуху 1,52. Какой объём займут при н.у. 5,5 г этого газа?
16. Какой объём займут 2∙10 23 молекул хлора при 27 0 С и 600 мм рт. ст.
17. Масса 87 мл пара при 62 0 С и 758 мм рт. ст. равна 0,24 г. Вычислить молекулярную массу вещества.
18. Вычислить массу 1 м 3 воздуха при 17 0 С и 624 мм рт. ст.
19. Вычислить объём, который займёт при 17 0 С и 1 атм. 1кг воздуха.
20. Из опыта найдено, что газ, собранный над водой, при 25 0 С имеет объём 600 мл при атмосферном давлении 97,325 кПа. Вычислить, чему равен объём сухого газа при нормальных условиях.
21. В стальном баллоне ёмкостью 20 л находится кислород под давлением в 12 кПа при температуре 17 0 С. Вычислите массу кислорода в баллоне.
22. Вычислите молекулярную массу газа тремя различным способами, если известно, что массы 1 л воздуха и водорода при н.у., соответственно равны 1,29 и 0,09 г, а масса 1 л газообразного вещества при тех же условиях равна: а) 3,57 г; б) 0,76 г; в) 3,17 г; г)2,058 г; д) 4,82 г; е) 1,965 г; ж) 1,25 г; з) 2,86 г.
Источник