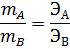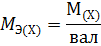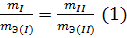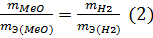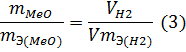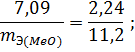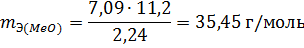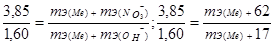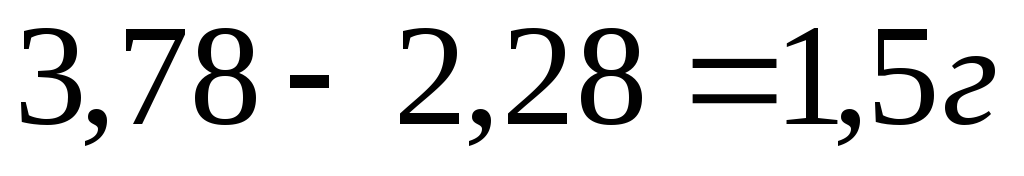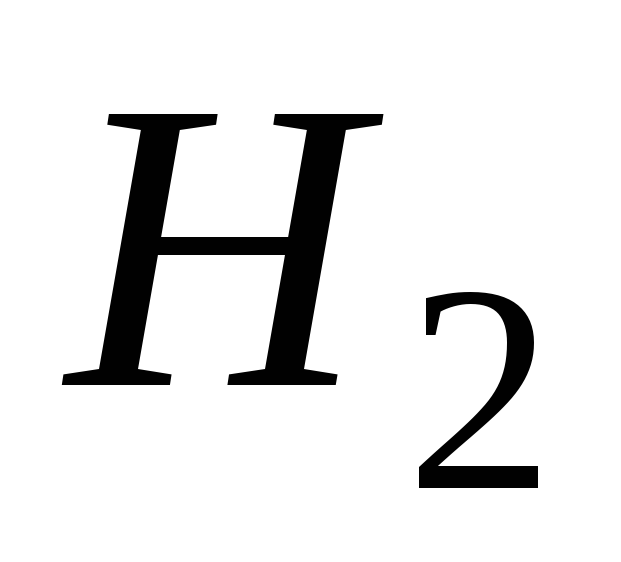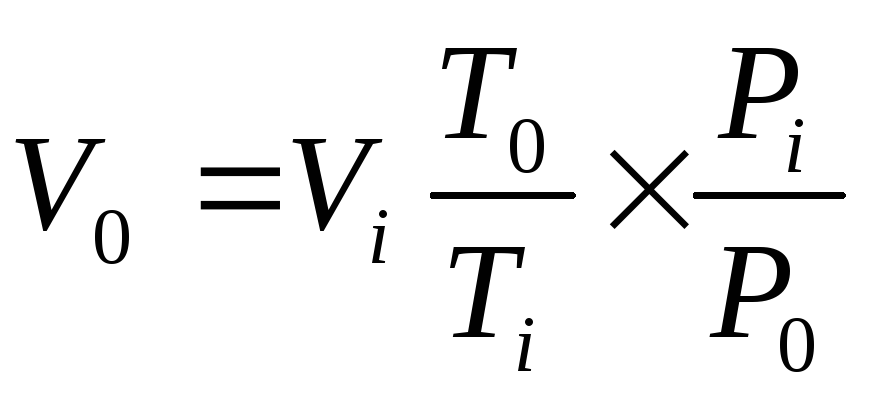- Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
- Способы расчета молярной массы эквивалента (Mf) в ионных соединениях
- Упражнения для самостоятельного решения
- *Закон эквивалентов:
- 1. Метод прямого определения молярной массы эквивалента вещества
- 2. Аналитический метод нахождения молярной массы эквивалента вещества
- 3. Электрохимический метод нахождения молярной массы эквивалента металла
- 4. Нахождение молярной массы эквивалента металла методом вытеснения водорода
Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента



Одним из основных законов химии является закон эквивалентов, открытый в конце 18 века: массы элементов, соединяющихся друг с другом, пропорциональны их эквивалентам:
где mA, mВ – массы взаимодействующих веществ А и В;
ЭА и ЭВ – эквиваленты этих веществ.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях ионного обмена равноценна одному атому или одному иону водорода, а в окислительно-восстановительных реакциях одному электрону.
Массу одного моля эквивалента элемента называют молярной массой эквивалента MЭ(X). Значение эквивалента веществ зависит от того, в какой конкретной реакции участвует это вещество.
Молярная масса эквивалента химического элемента (MЭ(X)), а также простых или сложных веществ рассчитывается по формуле
где M(X) – молярная масса; вал – суммарная валентность.
Для простых веществ суммарная валентность определяется произведением валентности атома химического элемента и числа атомов. Так, молярная масса эквивалента алюминия составляет MЭ(AI) = 27/3 = 9г моль -1 . Молярные массы эквивалента кислорода и водорода следует запомнить, они равны соответственно MЭ(О) = 16/2=8г моль -1 , МЭ(Н) = 1/1 = 1 г моль -1 .
Молярные массы эквивалента сложных веществ вычисляются по их химическим формулам с учетом происходящих химических реакций.
К сложным веществам относятся оксиды, гидроксиды, соли.
Суммарная валентность оксидов равна произведению валентности кислорода (2) на количество атомов кислорода в молекуле. Суммарная валентность гидроксидов определяется их кислотностью, которая равняется числу замещенных гидроксильных групп. Суммарная валентность кислот равняется основности данных соединений, которая определятся числом замещенных атомов водорода. Суммарная валентность соли равняется произведению валентности катиона и количества катионов в молекуле, или валентности аниона и количества анионов в молекуле.
Молярная масса эквивалентов сложных веществ может быть определена как сумма молярных масс эквивалентов элементов или условных частиц, образующих данное вещество.
Мэ (оксиды) = Мэ (О) + Мэ (элемента) = 8 + Мэ (элемента), т.к. Мэ кислорода величина постоянная, равна 8г моль -1 .
Мэ (кислота) = Мэ (Н) + Мэ (кислотного остатка) = 1 + Мэ (кислотного остатка), т.к. Мэ водорода величина постоянная, 1г моль -1
Мэ (гидроксиды) = Мэ (OH — ) + Мэ (металла) = 17 + Мэ (металла), т.к. Мэ “OH” групп величина постоянная, равна 17г моль -1 .
Мэ (соли) = Мэ (катиона) + Мэ (кислотного остатка).
Пример 1. Выразите в молях: а) 6,0210 21 молекул CO2; б) 1,2010 24 атомов кислорода; в) 2,0010 23 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02 10 23 ). Отсюда:
а) 6,0210 21 , т.е. 0,01 моль; б) 1,20 10 24 , т.е. 2 моль; в) 2,00 10 23 м, т.е. 1/3 моль.
Так как молекулярные массы СО2 и H2O и атомная масса кислорода соответственно равны 44; 18 и 16 а.е.м., то их мольные (молярные) массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. Определите эквивалент (Э) и эквивалентную массу МЭ (Х) азота, серы и хлора в соединениях NHз ,H2S и HCl.
Решение. Масса вещества и количество вещества – понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества – в молях.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота,1/2 моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S) = 1/2 моль, Э(Cl) = 1 моль. Исходя из мольных масс этих элементов определяем их эквивалентные массы:
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла? Нормальные условия по Международной системе единиц (СИ): давление 1,013 10 5 Па (760 мм рт. ст. = 1 атм), температура 273 К или 0 0 С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам):
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см 3 , л, м 3 ).

Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объёмом этого вещества. Мольный объём любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объём водорода VmЭ (Н2) = 22,4/2 = 11,2 л, а эквивалентный объём кислорода равен 5,6 л.
В формуле (2) отношение mН2/mЭ(Н2) заменяем равным ему отношением VН2/VmЭ(Н2), где VН2 — объём водорода, VmЭ(MeO) — эквивалентный объём водорода:
Из уравнения (3) находим эквивалентную массу оксида металла mЭ (МеО):
Согласно закону эквивалентов mЭ (МеО) = mЭ (Ме) + mЭ (О2), отсюда
Мольная масса металла определяется из соотношения mЭ = А/В ,
где mЭ — эквивалентная масса, А — мольная масса металла, В- стехиометрическая валентность элемента; А = mЭ В = 27,452 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 4. Вычислите эквиваленты и эквивалентные массы H2SО4 и Аl(OH)3 в реакциях, выраженных уравнениями:
Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основность) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп).
Пример 5. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см 3 кислорода (н.у.)?
Решение. Так как молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 м, то объем молярной массы эквивалента кислорода (8 г/моль) будет равен 22,4/4 = 5,6 = 5600 см 3 . По закон эквивалентов
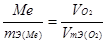
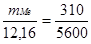
откуда тМе = 12,16 ? 310/5600 = 0,673 г.
Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла (тЭ(Ме) ).
Решение. При решении задачи следует иметь в виду:
а) молярная масса эквивалента гидроксида равна сумме молярных масс эквивалентов металла и гидроксильной группы;
б) молярная масса эквивалента соли равна сумме молярных масс эквивалентов металла и кислотного остатка. Вообще молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
Пример 7. В какой массе Са(ОН)2 содержится столько же эквивалентных масс, сколько в 312 г А1(ОН)3?
Решение. Молярная масса эквивалента А1(ОН)3 равна 1/3 его молярной массы, т.е. 78/3 = 26 г/моль. Следовательно в 312 г А1(ОН)3 содержится 312/26 =12 эквивалентов. Молярная масса эквивалента Са(ОН)2 равна ½ его молярной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль? 12 моль = 444 г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Молярная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,0210 23 ) = 1,6310 -22 г.
Источник
Способы расчета молярной массы эквивалента (Mf) в ионных соединениях
Молярная масса эквивалента ионного соединения может быть определена двумя способами:
1. Как произведение молярной массы формульной единицы вещества на фактор эквивалентности: Mf = f × М
2. Как сумма молярных масс эквивалентов катиона и аниона:
Второй способ удобнее и проще осуществлять табличным способом:
Упражнения для самостоятельного решения
Рассчитайте двумя способами молярную массу эквивалента для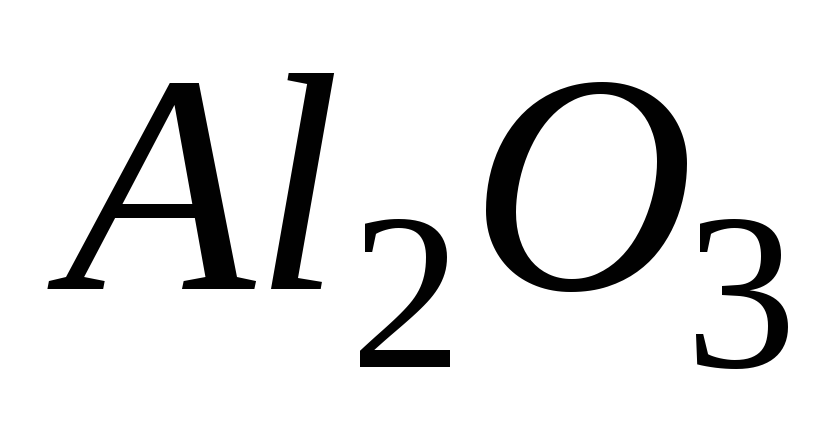



Рассчитайте молярные массы эквивалента перечисленных соединений, исходя из их молярных масс: 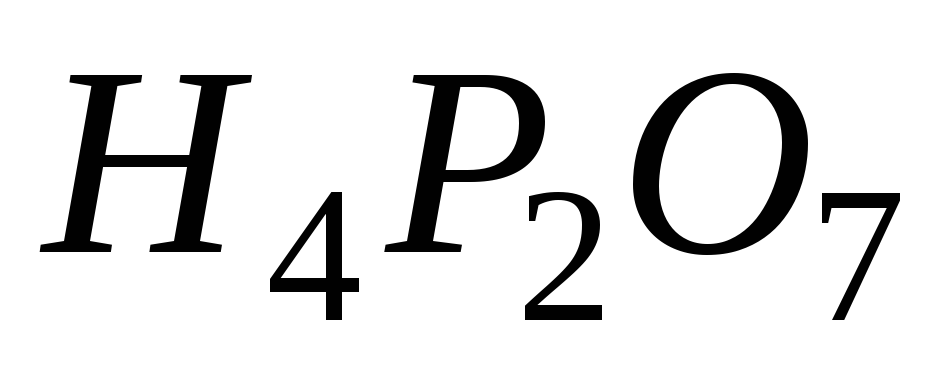


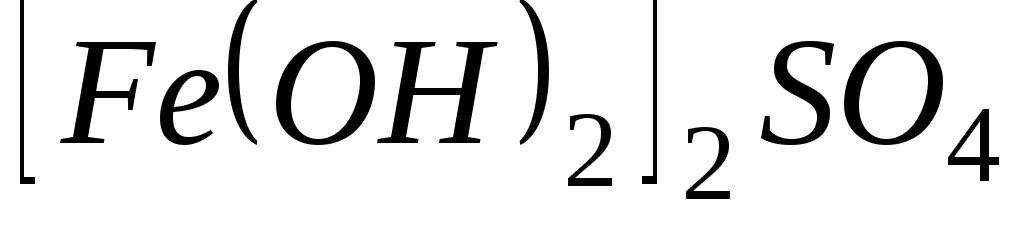

Чему равен фактор эквивалентности воды при ее взаимодействии: а) с оксидом натрия, б) с металлическим натрием?
Одинаков ли эквивалент металла в двух соединениях:
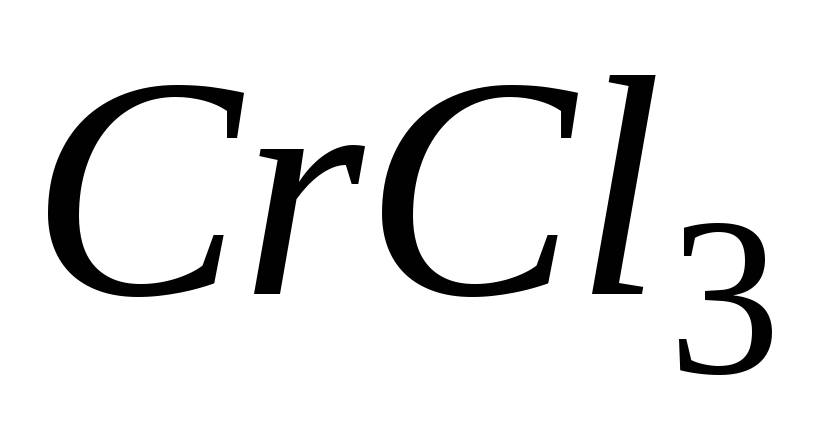



*Закон эквивалентов:
«Эквивалентные количества всех веществ, участвующих в реакции одинаковы»:
Для реакции А + В = С
Этот закон лег в основу практических методов определения эквивалентов, атомных и молярных масс.
1. Метод прямого определения молярной массы эквивалента вещества
Пример 1. При сжигании 2,28 г металла получено 3,78 г его оксида. Найти молярную массу эквивалента вещества Mf.
Находим массу кислорода, пошедшего на окисление металла:
Далее из пропорции, согласно закону эквивалентов, находим эквивалент металла:
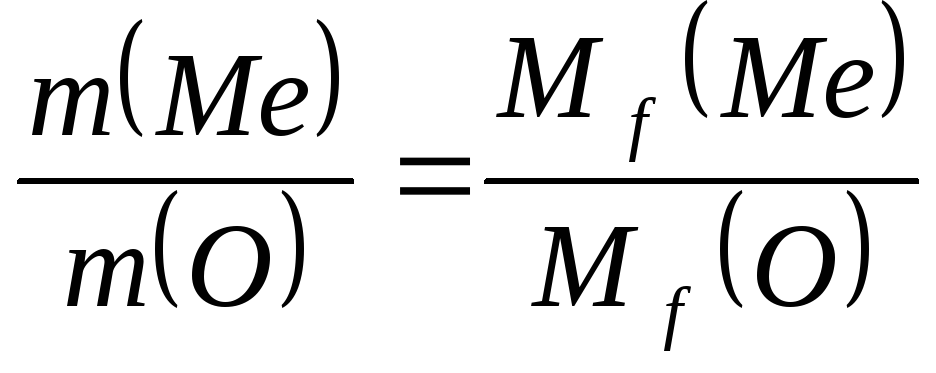


2. Аналитический метод нахождения молярной массы эквивалента вещества
Пример 2. Вычислить молярную массу эквивалента металла, если химическим анализом установлено, что сульфид металла содержит 67,15% металла по массе, а эквивалент серы равен 16 г/моль.
Пусть масса образца 100 г, тогда масса металла 67,15 г, а масса серы (100 – 67,5) = 32,85 г.
По закону эквивалентов:

3. Электрохимический метод нахождения молярной массы эквивалента металла
Пример 3. Определить молярную массу эквивалента никеля, если для выделения на катоде 4 г металла через раствор его соли было пропущено 13150 Кл электричества.
В соответствии с уравнением, объединяющим два закона Фарадея,





Следовательно,

4. Нахождение молярной массы эквивалента металла методом вытеснения водорода
Для газообразных веществ вводится понятие «эквивалентный объем» — объем, занимаемый 1 моль эквивалента вещества (Vm,f, л/моль).
При нормальных условиях согласно гипотезе Авогадро Vm = 22,4 л/моль
Пример 4. При взаимодействии 5 г металла с кислотой выделилось 2,8 л водорода (н.у.). Вычислить 
Согласно закону эквивалентов эквивалент металла должен вытеснить из кислоты эквивалент водорода.
При нормальных условиях: 5 г 



Примечание 1. Если объем водорода измерен при условиях, отличающихся от нормальных, необходимо привести его к н.у. по формуле объединенного газового закона:
Примечание 2. Если выделяющийся водород собран методом вытеснения воды, хранится в газометре над водой, то он насыщен водяными парами. Объем сухого водорода рассчитывается с учетом давления насыщенных водяных паров при температуре опыта 

и 
Источник