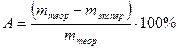Способы определения молярной массы газов
Существует ряд методов определения молекулярной массы газов при определенных внешних параметрах: давлении (Р), объеме (V) и температуре (Т).
1. По закону Авогадро и следствиям из него
Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие 1: один моль любого вещества содержит количество структурных единиц данного вещества, равное постоянной Авогадро (Na = 6,02∙10 23 моль -1 ).
Следствие 2: при нормальных условиях (н.у.) (Р = 10 5 Па, Т = 273 К) один моль любого газа занимает объем 22,4 л. Эта величина получила название молярный объем (VM).
Зная массу m (г) какого-либо объема газа при н.у. и его объем V0 (л), можно рассчитать его молекулярную массу.
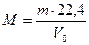 . . | (2.3.1) |
Следствие 3: массы равных объемов двух газов, взятых при одинаковых давлении и температуре, относятся друг к другу, как их молярные массы:
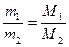 . . | (2.3.2) |
Отношение массы определенного объема первого газа к массе такого же объема второго газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму (D). Тогда:
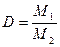 . . | (2.3.3) |
Обычно плотность газа определяют по отношению к водороду (DH2) или воздуху ( 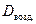
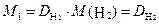 · 2, · 2, | (2.3.4) |
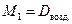 М возд.= М возд.= 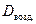 ·29. ·29. | (2.3.5) |
С учётом вышеуказанных условий для расчёта количества вещества используют следующие соотношения:
n 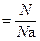 , , | (2.3.6) |
где N – количество структурных единиц в системе;
n 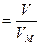 , , | (2.3.7) |
2. По уравнению Клапейрона – Менделеева
Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
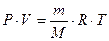 , , | (2.3.8) |
тогда молекулярную массу газа рассчитывают по формуле: 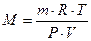 . . | (2.3.9) |
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1).
Источник
Определение молекулярной массы газообразных веществ



Цель работы: экспериментально определить молекулярную массу оксида углерода (IV).
Определение молярной массы газа может быть выполнено несколькими способами.
Чаще всего его определяют исходя из абсолютной и относительной плотности газов.
Абсолютной плотностью газа 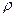
М = 22,4 ∙
Для приведения объёма, газа к нормальным условиям используют уравнение газового состояния
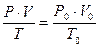
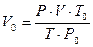
где V – объёма газа, измеренный при реальных условиях, т.е. при атмосферном давлении P и температуре Т.
Относительной плотностью D первого газа по второму называют отношение плотностей этих газов
D = 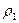
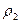
где 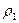
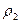
Это отношение можно заменить отношение масс газов, содержащихся в одинаковых объёмах при одинаковой температуре
D = 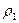
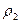
где m1 — масса первого газа,
По закону Авогадро в одинаковых объёмах любых газов при одних и тех же условиях содержится равное число молекул. Следовательно, их массы относятся друг к другу как их молярные массы
Так как m1 / m2 – плотность первого газа по второму, то
Молярную массу газа можно вычислить также, пользуясь уравнением Менделеева – Клайперона
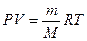
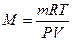
где P – давление, Па;
М – молярная масса, кг/моль;
R — молярная газовая постоянная, равная 8,314 Дж/(моль∙К);
Т – абсолютная температура, К.
Экспериментальная часть
Определение молекулярной массы оксида углерода (IV).
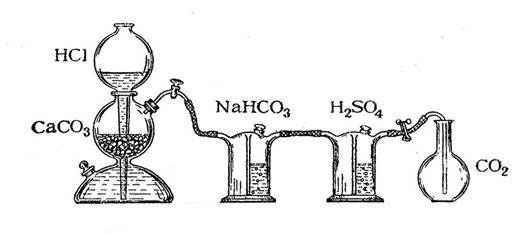
Определение молекулярной массы оксида углерода (IV) проводится в приборе, изображённом на рис.1. Оксид углерода (IV) получается в аппарате Киппа действием 10%-ой соляной кислоты на мрамор:
Оксид углерода (IV) подвергают очистке, пропуская последовательно через растворы NaHCO3 и H2SO4.
Рисунок 1. Аппарат Кипа
Взвесить колбу с пробкой на технохимических весах с точностью до 0,01г. Данные записать. Наполнить колбу оксидом углерода (IV), опустив газоотводную трубку до дна колбы. Закрыть колбу пробкой (пробка должна входить на ту же глубину, что при взвешивании колбы) и вновь взвесить. Чтобы быть уверенным в том, что воздух из колбы полностью вытеснен, и она целиком наполнена оксидом углерода (IV), надо, взвесив колбу, ещё раз на несколько минут опустить в неё газоотводную трубку, опустить и вновь взвесить колбу, повторяя эту операцию до получения постоянной массы колбы. Массу колбы с оксидом углерода (IV) записать. Определить объём колбы, наполнив её водой до пробки, затем измерить объём воды мерным цилиндром и записать результаты. Отметить и записать показания термометра и барометра во время опыта.
Форма записи наблюдений и обработка результатов.
| 1. | Масса колбы (с пробкой) с воздухом – m1, г |
| 2. | Масса колбы (с пробкой) с оксидом углерода (IV) – m2, г |
| 3. | Объём колбы – V, мл |
| 4. | Температура – t, 0 С |
| 5. | Давление – Р1, мм рт.ст. |
По полученным данным вычислить молекулярную массу оксида углерода (IV) с помощью уравнения Менделеева – Клапейрона, исходя из относительной плотности оксида углерода (IV) по водороду, если известно, что масса 1л Н2 при н.у. 0,09г.
В конце опыта вычислить относительную ошибку в процентах:
Вопросы и задачи.
1. Как следует формулировать закон Авогадро? Что показывает число Авогадро?
2. Что называется относительной плотностью газа?
3. Как можно вычислить молекулярную массу вещества, зная плотность его паров по воздуху?
4. Какова плотность по воздуху азота N2, хлора Сl2 и оксида углерода (II) СО?
5. Что тяжелее: сухой углекислый газ или равный объём того же газа, содержащего водяные пары?
6. Масса 1 л газа при нормальных условиях 1,43 г. Чему равна молекулярная масса газа?
7. Вычислить молекулярную массу газа, если относительную плотность его по воздуху равна 0,966.
8. Плотность газа по воздуху 1,17. Определить молекулярную массу газа.
9. Вычислить относительную плотность по воздуху газов: NH3, CH4, N2.
10. Вычислить относительную плотность по воздуху газов: N2O, NO, F2.

11. Вычислить какой объём (н.у.) займут 3,5 г азота; 640 г кислорода; 110 г углекислого газа; 70 г оксида углерода?
12. Какие объёмы занимают при н.у. следующие количества газов: 1 г водорода; 1 г кислорода и 1 г углекислого газа?
13. Сколько молекул содержится в 1 мл водорода при н.у.?
14. Плотность газа по водороду 17. Какова масса 1 л этого газа при н.у.? Какова его плотность по воздуху?
15. Плотность газа по воздуху 1,52. Какой объём займут при н.у. 5,5 г этого газа?
16. Какой объём займут 2∙10 23 молекул хлора при 27 0 С и 600 мм рт. ст.
17. Масса 87 мл пара при 62 0 С и 758 мм рт. ст. равна 0,24 г. Вычислить молекулярную массу вещества.
18. Вычислить массу 1 м 3 воздуха при 17 0 С и 624 мм рт. ст.
19. Вычислить объём, который займёт при 17 0 С и 1 атм. 1кг воздуха.
20. Из опыта найдено, что газ, собранный над водой, при 25 0 С имеет объём 600 мл при атмосферном давлении 97,325 кПа. Вычислить, чему равен объём сухого газа при нормальных условиях.
21. В стальном баллоне ёмкостью 20 л находится кислород под давлением в 12 кПа при температуре 17 0 С. Вычислите массу кислорода в баллоне.
22. Вычислите молекулярную массу газа тремя различным способами, если известно, что массы 1 л воздуха и водорода при н.у., соответственно равны 1,29 и 0,09 г, а масса 1 л газообразного вещества при тех же условиях равна: а) 3,57 г; б) 0,76 г; в) 3,17 г; г)2,058 г; д) 4,82 г; е) 1,965 г; ж) 1,25 г; з) 2,86 г.
Источник
Способы определения молекулярных масс газов
По закону Авогадро равные объемы газов, взятые при одинаковой температуре и одинаковом давлении, содержат равное число молекул. Отсюда следует, что массы двух газов, взятых в одинаковых объемах, должны относиться друг к другу, как их молекулярные массы или как численно равные их молярные массы:
Здесь 



Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диоксида углерода в объеме 1 л равна 1,98 грамм, а масса водорода в том же объеме и при тех же условиях — 0,09 грамм, откуда плотность диоксида углерода по водороду составит:
Обозначим относительную плотность газа 
Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид
или, если округлить молярную массу водорода до 2:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше, равна 22, находим:
Нередко также молярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же можно говорить о средней молярной массе воздуха, определенной из плотности воздуха по водороду. Найденная таким путем молярная масса воздуха равна 29 г/моль.
Обозначив плотность исследуемого газа по воздуху через 
Молярную массу вещества (а следовательно, и его относительную молекулярную массу) можно определить и другим способом, используя понятие о молярном объеме вещества в газообразном состоянии. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества в газообразном состоянии, а затем вычисляют массу 
Пример. 0,7924 грамм хлора при 

Находим массу хлора, содержащегося в объеме 
Следовательно, молярная масса хлора равна 71 г/моль, а относительная молекулярная масса хлора равна 71.
Измерения объемов газов обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля — Мариотта и Гей-Люссака
Здесь V объем газа при давлении Р и температуре Т; 



Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа — уравнением Клапейрона — Менделеева
где Р — давление газа, 


Если объем газа выражен в литрах, то уравнение Клапейрона — Менделеева приобретает вид
Описанными способами можно определять молекулярные массы не только газов, но и всех веществ, переходящих при нагревании (без разложения) в газообразное состояние. Для этого навеску исследуемого вещества превращают в пар и измеряют его объем, температуру и давление. Последующие вычисления производят так же, как и при определении молекулярных масс газов.
Молекулярные массы, определенные этими способами, не вполне точны, потому что рассмотренные газовые законы и уравнение Клапейрона — Менделеева строго справедливы лишь при очень малых давлениях (см. § 11). Более точно молекулярные массы вычисляют на основании данных анализа вещества (см. § 14).
Источник