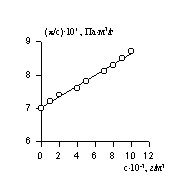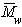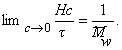- Способы определения массы молекул
- Темы исследований
- Оформление работы
- Наш баннер
- Исследовательские работы и проекты
- Способы определения размеров молекул
- Определение размеров молекул
- Практическое получение наночастиц
- 5.2.2. Методы определения молекулярной массы полимеров по свойствам растворов Свойства растворов
Способы определения массы молекул
Темы исследований
Оформление работы
Наш баннер
Исследовательские работы и проекты
Способы определения размеров молекул
Определение размеров молекул
1 способ. Основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V некоторой массы m вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V на число молекул N.
Отсюда объем V0 одной молекулы определяется из равенства
В это выражение входит отношение объема вещества к его массе.
Обратное же отношение
есть плотность вещества,
так что
Плотность практически любого вещества можно найти в доступных всем таблицах. Молярную массу легко определить, если известна химическая формула вещества.
Объем одной молекулы, если считать ее шариком, равен 
где r — радиус шарика.
Первый из этих двух корней — постоянная величина, равная ≈ 7,4 · 10-9 моль 1/3, поэтому формула для r принимает вид 
Например, радиус молекулы воды, вычисленный по этой формуле, равен rВ ≈ 1,9 · 10-10 м.
Описанный способ определения радиусов молекул не может быть точным уже потому, что шарики нельзя уложить так, чтобы между ними не было промежутков, даже если они соприкасаются друг с другом. Кроме того, при такой «упаковке» молекул – шариков были бы невозможны молекулярные движения. Тем не менее, вычисления размеров молекул по формуле, приведенной выше, дают результаты, почти совпадающие с результатами других методов, несравненно более точных.
2 способ. Метод Ленгмюра и Дево. В данном методе исследуемая жидкость должна растворяться в спирте (эфире) и быть легче воды, не растворяясь в ней. При попадании капли раствора на поверхность воды спирт растворяется в воде, а исследуемая жидкость образует пятно площадью S и толщиной d (порядка диаметра молекул).
Если допустить, что молекула имеет форму шара, то объем одной молекулы равен:

Необходимо определить диаметр молекулы d. В микропипетку набрать 0,5 мл раствора и, расположив ее над сосудом, отсчитать число капель n, содержащихся в этом объеме. Проделав опыт несколько раз, найти среднее значение числа капель в объеме 0,5 мл, а затем подсчитать объём исследуемой жидкости в капле: 
В ванну налить воду толщиной 1 – 2 см. Насыпать тальк тонким слоем на лист бумаги, ударяя слегка пальцем по коробочке. Расположив лист бумаги выше и сбоку от ванны на расстоянии 10 – 20 см, тальк сдуть с бумаги. На поверхность воды в ванне из пипетки капнуть одну каплю раствора. Линейкой измерить, средний диаметр образовавшегося пятна D и подсчитываю его площадь. Опыт повторить 2- 3 раза, а затем подсчитать диаметр молекул d.
Объём капли масла можно определить следующим образом: накапать 100 капель из капилляра в сосуд и измерить массу масла в нём. После этого массу, выраженную в килограммах, поделить на плотность масла, которую можно взять из таблицы плотности некоторых веществ (плотность масла растительного 800 кг/м3).
Затем полученный результат поделить на количество капель. Объём капли можно определить также с помощью мерного цилиндра: накапать масло в цилиндр, измерить его объём в см3 и перевести в м3, для чего поделить на 1000000, затем на количество капель масла. После того, как объём капли стал известен нужно капнуть одну каплю масла на поверхность воды, которая налита в широкий сосуд.
Для ускорения реакции предварительно немного нужно нагреть воду – приблизительно до 400С. Масло начнёт растекаться, и в результате получится круглое пятно. После того, как пятно перестанет расширяться, с помощью линейки измерить его диаметр и рассчитать площадь пятна по формуле:
Практическое получение наночастиц
В современном мире в связи с общей тенденцией к миниатюризации большими темпами стала развиваться такая наука, как нанотехнология. Методы нанотехнологии позволяют получить принципиально новые устройства и материалы с характеристиками, значительно превосходящими их современный уровень, что весьма важно для интенсивного развития многих областей техники, биотехнологии, медицины, охраны окружающей среды и др.
Ход работы:
1) Определение объёма капли

2) Определение объёма капли путём взвешивания.
1. На весы накапали 10 капель растительного масла, измерили массу
- Масса 1 капли m1=0,2 г/10=0,02 г
- Определение объёма капли V=m1/q=0,01г/0,8 г/см3=13 мм3
3) Определяем площадь пятна Sмасла=ПR2=11304 мм2
4) Площадь пятна нефти Sнефти=20*16=32000 мм2
5) Определяем толщину плёнки h=V/S
Для масла h=13/11304=1,2*10-7=120 нм
Для нефтиh=13/32000=4*10-8 м=40 нм
Вывод: В лабораторных условиях можно получать нанопленки
Источник
5.2.2. Методы определения молекулярной массы полимеров по свойствам растворов
Свойства растворов
Наиболее часто среднечисленную молекулярную массу 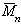
Молекулярная масса определяется как коэффициент, связывающий весовую и частичную концентрации
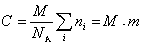
где С – весовая концентрация, г/см 3 ; 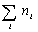
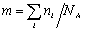
Таким образом, задача сводится к определению мольной концентрации раствора известной весовой концентрации.
Стремление молекул растворителя к самопроизвольному проникновению через мембрану определяется разностью химических потенциалов растворителя в частях системы, разделенных перегородкой, причем 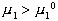
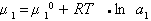
где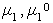
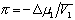
где 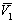
Связь между осмотическим давлением и весовой концентрацией растворов описывается следующими уравнениями:
(уравнение Вант-Гоффа) для растворов низкомолекулярных веществ
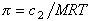
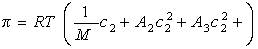
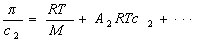
где А2 – второй вириальный коэффициент, характеризующий взаимодействие полимера с растворителем и форму макромолекул в растворе, обычно А3®0.
Величина p /c2 носит название приведенного осмотического давления. На рис. 2.50 показан пример зависимости приведенного осмотического давления для растворов полимера в различных растворителях. Чем больше наклон прямых, тем сильнее проявляется взаимодействие между компонентами раствора и тем больше величина
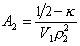
где k- параметр взаимодействия, r2 – плотность полимера в растворе, V1 – мольный объём растворителя.
При k = 0,5 А2 =0 и раствор ведет себя как идеальный. Таким образом, определяя наклон зависимости p /c2 = fc2 , можно охарактеризовать сродство компонентов раствора. Величина молекулярной массы определяется как
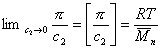
Найденная из измерений осмотического давления молекулярная масса характеризует 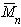
Метод светорассеяния. Среднемассовая молекулярная масса
Явление светорассеяния в растворах полимеров наблюдается в том случае, если размер макромолекул менее l/2 — половины длины волны проходящего света. Существуют различные теории рассеяния света, положенные в основу расчетных уравнений экспериментальных методов определения молекулярной массы. При условии, что размер молекул полимера меньше l/2, для растворов полимеров справедлива теория рассеяния света Эйнштейна.
Если рассеяние света происходит на сферических частицах, то интенсивность рассеяния будет одинаковой во всех направлениях. Обозначим угол, под которым по отношению к падающему лучу определяется интенсивность рассеянного света, Q. Рассеивающая способность характеризуется коэффициентом рассеяния R:
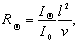
где IQ, I0— интенсивность рассеянного и падающего света; l– расстояние, на котором наблюдается рассеянный свет от рассеивающего объёма; v – рассеивающий объём.
В практике определения интенсивности рассеянного света наиболее часто определяется R90, т.е. рассеяние света под углом 90 o , хотя с помощью современных приборов, особенно использующих в качестве источника света лазер, можно определять интенсивность рассеянного света от Q = 4 o .
Для расчета молекулярной массы полимеров используется уравнение Дебая:
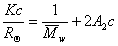
где с – весовая концентрация, г/см 3 ; K – оптическая постоянная, зависящая от коэффициента преломления среды (n0), концентрационного инкремента коэффициента преломления раствора (dn/dc) и длины волны света l,
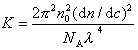
Таким образом для определения молекулярной массы следует измерять угловое рассеяние света, коэффициент преломления среды. Особенно тщательно следует определять (dn/dc), так как эта величина обычно чрезвычайно мала. Следует привлекать приборы, позволяющие определить коэффициент преломления с точностью до 6-го знака.
По аналогии с поглощением света можем записать для интенсивности рассеяния
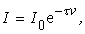
гдеt – мутность 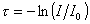
Мутность связана с коэффициентом рассеяния соотношением
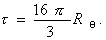
Поэтому, с учетом уравнения (2.5.19), можно проводить расчет молекулярной массы по уравнению
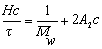
где Н – оптическая постоянная, Н = 16p K/3.
Для расчета молекулярной массы определяется величина
По углу наклона можно определить значение А2 и охарактеризовать взаимодействие компонентов раствора. Изменение температуры, замена растворителя могут вызвать изменение межмолекулярного взаимодействия компонентов раствора и формы макромолекул в растворе.
Молекулы могут приобретать и асимметрическую форму. В этом случае рассеяние света под разными углами к падающему лучу будет неравномерным и найденное значение молекулярной массы содержит погрешность. Поэтому необходимо вводить поправку на внутреннюю интерференцию света, появляющуюся в результате рассеяния света с некоторой разностью фаз от различных участков молекул. Для введения поправок существуют два основных метода: метод Дебая и метод Зимма.
Метод Дебая основан на измерении интенсивности рассеянного света при значении углов рассеяния, равных 135 и 45 o , соответственно R45 и R135. Отношение интенсивности равно отношению поправок Р и называется коэффициентом асимметрии
Величина z зависит от концентрации раствора, так как форма макромолекул в растворе может изменяться с увеличением концентрации. Для определения истинного значения z строят зависимость 1/(z-1)=fс и определяют 1/([z]-1) = limс®0 1/(z-1).
Зная z,по существующим таблицам находят величину Р, которую вводят в расчетное уравнение
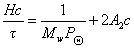
Метод Зимма основан на построении специальной диаграммы, на которой по оси абсцисс откладывается и концентрация, и угол рассеяния света. Линии на диаграмме образуют два семейства параллельных (практически прямых) линий. Более крутые линии представляют собой зависимость рассеяния света от концентрации растворов. Более пологие – зависимость рассеяния света от угла определения. Нижняя линия соответствует рассеянию света при с = 0, крайняя левая — дает совокупность точек при sin Q/2 =0. Обе прямые пересекаются с осью ординат в точке, характеризующей 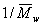
Для определения молекулярной массы полимеров можно измерять коэффициент диффузии растворенного вещества. Если представить, что макромолекулы имеют узкое распределение по молекулярной массе и каждая молекула не взаимодействует с другими молекулами полимера, то для молекулы, перемещающейся вдали от стенки сосуда, сила трения со средой может быть описана выражением
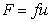
где F- сила трения; u – скорость перемещения молекулы; f =6ph0r- коэффициент трения сферических частиц; h0 – вязкость растворителя; r – радиус макромолекулы в растворе.
Уравнение (2.5.26) справедливо при скорости перемещения макромолекул 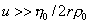
Предполагая применимость уравнения Эйнштейна для диффузии полимерных молекул в растворе, запишем
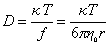
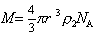
Сочетание (2.5.27) и (2.5.28) дает
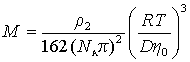
Cущественную ошибку может внести в расчет использование в качестве r2 значения плотности полимера, так как в растворе плотность макромолекул может значительно отличаться от плотности “сухого” полимера. Поэтому следует использовать значение 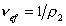
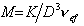
где vef— это тот удельный объём, который занимают макромолекулы в растворе, см 3 /г, учитывающий взаимодействие макромолекул в растворителе.
Вискозиметрический метод определенияvef и 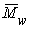
Существуют несколько уравнений, связывающих вязкость растворов полимеров с их концентрацией. Уравнение Симха для сферических частиц связывает удельную вязкость с объёмной концентрацией полимера:
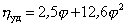
где j – объёмная доля, занимаемая полимером, 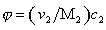
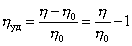
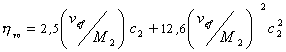
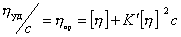
где 
Уравнение (2.5.33) носит название уравнения Хаггинса, K’ – постоянная Хаггинса, характеризующая форму макромолекул в растворе. Для сферических макромолекул K’ = 2, для эллипсоид-
ных K’ = 2¸10; для игольчатых форм K’ 2 x – ускорение центробежного поля, w – угловая скорость вращения; x – расстояние от молекулы до центра вращения; mh – масса одной сольватированной молекулы; vh – объем одной молекулы, r0 — плотность растворителя, vhr0 – поправка на выталкивающую силу.
Масса одной сольватированной молекулы, в соответствии с концепцией сольватированной частицы Онслея, определяется как
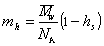
Объем одной сольватированной макромолекулы
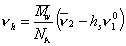
где v2— парциальный удельный объем макромолекул, см 3 /г; hsv1 0 — поправка на объем связанного растворителя; v1 0 = 1/r0 – — удельный объем растворителя, см 3 /г.
С учетом (2.5.36) и (2.5.37) запишем уравнение (2.5.35) в виде
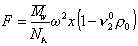
Можно видеть, что величина сольватации hs исключается из расчетного уравнения. Сила трения, уравновешивающая центробежную силу в стационарном режиме,
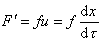
Из условия стационарности F= F’, следовательно,
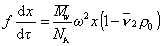
Для перехода от дифференциальной формы уравнения к интегральной Сведберг предложил использовать понятие постоянной седиментации
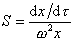
характеризующей скорость осаждения макромолекул под действием единицы центробежного поля. Эта постоянная зависит только от свойств макромолекул.
Коэффициент трения может быть определен из измерения коэффициента диффузии по уравнению Эйнштейна
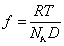

Уравнение (2.5.42) носит название уравнения Сведберга. Коэффициент диффузии D и коэффициент седиментации s определяются независимо. Для исключения эффекта взаимодействия макромолекул значение s экстраполируют к бесконечно малой концентрации и в расчетах используют значение s0.
Метод седиментации позволяет наиболее точно определить значение молекулярной массы полимера, так как здесь не надо определять или предполагать форму макромолекул, а величина сольватации исключается из расчетного уравнения. Экспериментально установлено, что
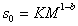
гдеK и b – постоянные, для многих полимеров приведенные в таблицах. Поэтому после калибровки постоянных уравнение (2.5.43) можно использовать для определения молекулярной массы без привлечения диффузионных измерений.
Определение средней молекулярной массы методом
По этому методу не проводят осаждения полимера, а ведут процесс только до установления равновесия между седиментацией и диффузией.
Для седиментационного потока
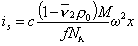
Для диффузионного потока
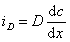
При седиментационно-диффузионном равновесии iD= is, следовательно,
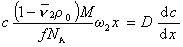
После преобразования с учетом D = kT/f и kNА=R получаем
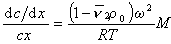
Откуда после интегрирования
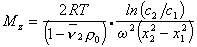
Таким образом достаточно определить значения концентрации раствора в двух точках кюветы чтобы рассчитать значение Mz . Этот метод носит название метода Арчибальда. Можно проводить расчет и по неустановившемуся равновесию, что значительно сокращает время эксперимента, но усложняет расчет.
Кроме определения молекулярной массы метод седиментационного ультрацентрифугирования в сочетании с вискозиметрией позволяет охарактеризовать форму макромолекул в растворе, определяя фактор Шераги — Манделькерна b, который для сферических частиц равен b = 2,12×10 6 .
Расчет проводится по формуле
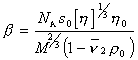
где s0 – коэффициент седиментации, экстраполированный к бесконечному разбавлению; [h] – характеристическая вязкость;h0 – вязкость растворителя.
Источник