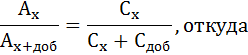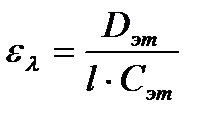МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ВЕЩЕСТВА В РАСТВОРЕ



1). Метод градуировочного графика.
2). Метод добавок.
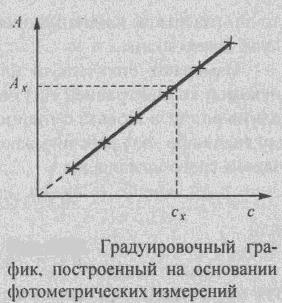
1). Для определения концентрации вещества по методу градуировочного графика «ГГ» готовят серию стандартных растворов, концентрация которых охватывают интересующую нас область. Если данный раствор подчиняется основному закону поглощения, то для построения ГГ обычно находят 5 – 8 точек, отличающихся по концентрациям не менее чем на 30%.
Неизвестную концентрацию находят из градуировочного графика.
2). Метод добавок. Этот метод применим только при полном подчинении данного раствора основному закону светопоглощения. Сравнивают оптическую плотность исследуемого раствора и того же раствора с добавкой известного количества определяемого вещества.
Методы абсорбционной спектрометрии применяют для анализа объектов окружающей среды, в основном, для определения металлов в воде, воздухе, почве, а также применяют в сельском хозяйстве, в медицине, в химической промышленности.
АТОМНО – ЭМИССИОННАЯ СПЕКТРОСКОПИЯ
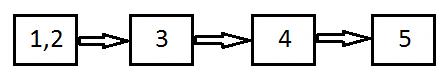
Метод атомно – эмиссионной спектроскопии (АЭС) основан на испускании (эмиссии) квантов электромагнитного излучения возбуждёнными атомами. Схему атомной эмиссии можно представить следующим образом:
где А – атом элемента; Е – энергия, поглощаемая элементом; А • — возбуждённый атом; hν – испускаемый квант света.
1,2 — источник света, выполняет три функции:
1) испарение образца;
2) атомизация молекул;
3) возбуждение атомов.
3 — селектор частоты (излучаемый свет для анализа необходимо диспергировать на монохроматические линии).
4 — детектор излучения.
5- регистрирующее устройство.
В качестве источника возбуждения применяют пламя, электрические дуги (постоянного и переменного тока), низковольтную или высоковольтную конденсированную искру, тлеющие разряды, высокочастотные разряды (индуктивно связанная плазма, микроволновой разряд и лазер). Возбуждение атома происходит при столкновении с частицами плазмы, дуги или сикры, обладающими высокой кинетической энергией. При поглощении атомом энергии внешний электрон переходит на более высокий энергетический уровень и через 10 -7 – 10 -9 секунд возвращается на основной уровень, при этом энергия выделяется в виде кванта света – hν. Положение спектральной линии в спектре зависит от природы элемента, а интенсивность зависит от количества атомов, в которых осуществляется переход.
В атомной спектроскопии необходимо перевести вещество в атомарное состояние – атомизировать. В атомно – эмиссионных методах способ атомизации является одновременно и способом возбуждения атомов. Образуются линейчатые спектры атомов. Атомизацию осуществляют пламенным и электротермическим способами.
Эмиссионная фотометрия пламени.Метод основан на измерении интенсивности излучения, испускаемого атомами, возбуждаемыми в пламени.
Пламя образуется при сгорании горючего газа в окислителях. Температура пламени невысока (1700 – 3000 о С), однако её достаточно для возбуждения резонансных линий наиболее легко возбудимых атомов (щелочные и щелочноземельные металлы). Интенсивность излучения атомами пропорциональна их концентрации в пламени, которая, в свою очередь, пропорциональна концентрации ионов в растворе:
I = K ∙ c,
где I – интенсивность спектральной линии; c – концентрация вещества.
Эта прямолинейная зависимость соблюдается при постоянстве коэффициента К, на значение которого могут повлиять помехи: образование труднолетучих соединений, ионизация, изменение режима работы источника возбуждения, самопоглощение. Не все кванты, испускаемые возбуждёнными частицами, достигают приёмника света, квант может быть поглощён невозбуждённым атомом и , таким образом, не будет зафиксирован приёмником излучения. Это так называемое самопоглощение.
Интенсивность излучения измеряют в пламенных фотометрах и спектрофотометрах, преобразуя световой поток спектральной линии при определённой резонансной длине волны в электрический ток (фототок) с помощью фотоэлемента.
Способы определения концентрации такие же как в молекулярной спектроскопии: метод градуировочного графика и метод добавок.

Атомно – эмиссионный анализ с электротермическим возбуждением. Для большинства элементов для возбуждения используют дуговые и искровые электротермические источники, дуги постоянного и переменного тока с температурой 5 000 – 7 000 о С в зависимости от материалов электрода. Можно определять почти все металлы периодической системы Менделеева.
Конденсированная искра – температура 10 000 о С, возбуждаются все элементы периодической системы.
Спектральную линию наблюдают визуально (в спектроскопах и стилоскопах), регистрируют на фотопластинках (в спектрографах), преобразуют в электрический сигнал с помощью фотоэлементов и фотоумножителей (в квантометрах).
Определяя длину волны анализируемой спектральной линии можно проводить качественный анализ пробы, т.е. идентифицировать вещества, присутствующие в образце.
Количественный эмиссионный спектральный анализ основан на зависимости интенсивности спектральной линии от концентрации вещества (c) в пробе – формула Ломакина-Шайбе
I = a ∙ c b ,
где a – коэффициент, зависящий от режима работы источника возбуждения, его стабильности, температуры и т.д.; b – коэффициент самопоглощения, учитывающий поглощение кванта света невозбуждёнными атомами.
При логарифмировании этого уравнения получаем:
Ig I = Ig a + bIg c = const + bIg c
Это уравнение является основой количественного спектральног анализа.
Чтобы исключить искажения спектральной линии за счёт различных помех применяют для анализа гомологическую пару линий.
Аналитическая линия – линия определяемого элемента. Линия сравнения – линия основы и специальной добавки (внутренний стандарт), заранее введённый в образец.
При фотографической регистрации используют зависимость
∆S=f (Ig c),
где S – почернение спектральной линии на фотопластинке
В квантометрах для приёма сигнала используют фотоэлектрические детекторы.
Преимущества метода.
Атомно – эмиссионный метод с применением дуги используется для качественного и полуколичественного анализа различных объектов.
Можно анализировать твёрдые и жидкие образцы. Метод избирательный. Из одной пробы можно обнаружить до 30 элементов без предварительного разделения.
Для анализа требуется незначительное количества вещества.
Невысокая точность метода.
Эмиссионная фотометрия пламени – это самый распространённый, чувствительный и воспроизводимый метод определения натрия и калия в почвах, биологических и медицинских объектах, водах.
Источник
Способы определения концентрации веществ
1. Определение концентрации вещества с помощью градуировочного (калибровочного) графика.Измеряют оптическую плотность приготовленных стандартных окрашенных растворов и строят градуировочный график: в координатах – оптическая плотность D (ось ординат) – концентрация определяемого вещества – в растворе С (ось абсцисс). При условии выполнения основного закона светопоглощения градуировочный график представляет собой прямую, выходящую из начала координат. Измерив оптическую плотность анализируемого раствора (Dx), по калибровочному графику находят концентрацию определяемого вещества (Cx) (рис. 14).
2. Определение концентрации вещества методом сравнения оптических плотностей эталонного (стандартного) и исследуемого растворов. В этом методе используют два раствора: стандартный с точно известной концентрацией вещества Сэти исследуемый с концентрацией Сх. Последовательно измеряют оптические плотности стандартного Dэт и исследуемого Dx растворов. Концентрацию определяемого вещества Сх находят по формуле:
3. Определение концентрации вещества в растворе по значению молярного коэффициента поглощения. Готовят эталонный раствор исследуемого вещества определенной концентрации Сэт и измеряют значение оптической плотности Dэт этого раствора при длине волны λ. Значение ελ вычисляют по формуле:
Определив значение оптической плотности анализируемого раствора Dх, при той же длине волны находят концентрацию раствора Схпо формуле:

Способом с построением калибровочного графика пользуются при проведении большого количества анализов. Другие способы расчёта Сх используются при проведении единичных анализов.
Дата добавления: 2015-09-11 ; просмотров: 5 | Нарушение авторских прав
Источник
Способы определения концентрации вещества
Методы определения концентрации делятся на две группы:
I. Абсолютные – аналитический сигнал (оптическая плотность) фиксируется по сравнению с нулевым раствором, не содержащим определяемый компонент.
II. Дифференциальные – в качестве нулевого раствора используют какой-либо стандартный раствор определяемого вещества.
Молярный коэффициент поглощения определяют по градуировочному графику либо находят по литературным источникам. При расчете ε используют такие же эталонные растворы, при той же оптимальной длине волны, что и при определении концентрации испытуемого раствора. Этот метод используют для определения концентрации вещества в растворе, не содержащем примесей.
2. Метод сравнения оптических плотностей стандартного и исследуемого раствора

Готовим серию стандартных растворов (с известной концентрацией определяемого вещества). Создаем для исследуемого раствора те же оптимальные условия фотометрирования (оптимальная длина волны, кислотность, количество реагента, время, толщина кюветы), что и для стандартных растворов. Сравниваем интенсивность окраски эталонных растворов и исследуемого. Нужно подобрать раствор с такой концентрацией Сст., чтобы оптические плотности стандартного и исследуемого растворов были как можно ближе (интенсивность окраски примерно одинакова), т.к. закон Б-Л-Б выполняется в узком интервале концентраций. Этот метод используют, когда знают приблизительную концентрацию определяемого вещества в пробе и при проведении единичных анализов.
3. Метод градуировочного графика
Этот метод применяется при наличии большого количества проб и содержание вещества в пробах может быть различным в широком интервале концентраций. Для проведения метода готовим серию стандартных растворов определяемого вещества. Стандартные растворы должны быть выбраны по следующим принципам:
— стандартные растворы должны охватывать весь интервал ожидаемых концентраций;
— должен выполняться основной закон светопоглощения, т.е. линейность градуировочного графика (Г.Г.);
— интервал оптических плотностей стандартных растворов должен соответствовать максимальной воспроизводимости (
Оптическую плотность исследуемого раствора измеряют относительно растворителя или «холостого» опыта. При построении Г.Г. дальше последней точки график не строят. В идеале Г.Г. должен проходить через начало координат, тангенс угла наклона равен 1 (α = 45˚). Но довольно часто Г.Г. идет выше, т.е. по уравнению прямой: А = вс+а. Это может быть в результате не очень чистых реактивов. Работать с подобным графиком можно, т.к. исследуемый раствор фотометрируют в этих же условиях. Коэффициент в (А = вс+а) является тангенсом угла наклона Г.Г. или угловым коэффициентом. Чем круче идет Г.Г., тем метод будет чувствительней. Если линейность Г.Г. не соблюдается, готовят больше стандартных растворов, чтобы концентрация отличалась не больше, чем на 10%. С Г.Г. можно работать только в том случае, если α > 15˚.
4. Метод добавок
Представляет собой разновидность метода сравнения. Этот метод целесообразно применять для определения малых количеств различных элементов в присутствии больших количеств посторонних веществ при анализе солевых растворов (т.е. для устранения мешающего влияния посторонних примесей). Метод добавок требует обязательного соблюдения основного закона светопоглощения. Сущность метода: определение концентрации основано на сравнении оптической плотности исследуемого раствора и оптической плотности того же исследуемого раствора с добавкой известного количества стандартного раствора определяемого вещества. Существует два варианта этого метода: расчетный и графический.
а) Графический метод
Методика: в несколько мерных колб вносят одинаковое количество (объем) исследуемой пробы и во все колбы кроме одной определенные количества стандартного раствора определяемого вещества. Измеряют оптические плотности Ах, Ах+а1, Ах+а2, ….Ах+аn. Строят график зависимости -А – f (Ca), где а – добавка стандартного раствора определяемого раствора.
б) Расчетный метод
Методика: в две мерные колбы вносят одинаковое количество (объем) исследуемой пробы и в одну из них определенное количество стандартного раствора определяемого вещества. Измеряют оптические плотности — Ах и Ах+а.





Дифференциальный метод применяется для повышения точности анализа при определении больших количеств веществ. Сущность метода состоит в том, что оптические плотности исследуемого и стандартного растворов измеряются не по отношению к чистому растворителю с нулевым поглощением, а по отношению к окрашенному раствору определяемого элемента с концентрацией Со, близкой к концентрации исследуемого раствора.
а) Графический вариант
Методика: также как и для Г.Г. готовят серию стандартных растворов определяемого вещества; в качестве раствора сравнения выбирают стандартный раствор с минимальной концентрацией Со.
б) Расчетный вариант





Обратный угловой коэффициент: 

Источник