- Иногда достаточно и волоса. Разбираемся, как работает ДНК-тест на отцовство
- Определение концентрации нуклеиновых кислот и чистоты препарата
- Определение чистоты препарата ДНК или РНК
- Способы определения концентрации днк
- Поиск
- Определение внеклеточных ДНК крови – клиническое и диагностическое значение
- Determination of extracellular DNA in the blood — clinical and diagnostic value
Иногда достаточно и волоса. Разбираемся, как работает ДНК-тест на отцовство
Человек наследует половину генетического материала от матери, половину — от отца. Это далеко не всегда означает, что ребенок будет похож на родителей. Внешность и характер могут отличаться, но ДНК никогда не врет: генетический анализ помогает найти друг друга близким людям или восстановить справедливость.
Как проводится тест на отцовство? Какие материалы для него нужно предоставить? И всегда ли результат достоверен? С этими и другими вопросами мы отправились в Центр генетики «Наследие».
Тест на отцовство — один из самых востребованных анализов ДНК?
— Да, действительно. Это один из самых частых запросов. Чуть отстает от теста анализ на родство, когда требуется установить, есть ли генетическая связь с другими предполагаемыми родственниками. А вот тест на материнство на последнем месте.
Кстати
Нередко тест на материнство выполняется, когда новоиспеченная мама испытывает послеродовую депрессию и под давлением эмоций считает, что в роддоме ей подменили ребенка.
Тест на отцовство можно провести и без предполагаемого отца. Тогда сравниваются результаты генетического анализа ребенка и близких родственников мужчины. Этот метод помогает, если возможный папа вынужден долго находиться за границей, не хочет проходить тест или его уже нет в живых. При этом достоверность анализа остается прежней.
А какую точность обещают эти анализы?
— Достоверность родства (если оно выявлено) составляет 99,9%, при отрицательном итоге в бланке с результатом будет написано, что вероятность родства — 0%.
Лаборатории не смогут гарантировать высокую точность лишь в случае, если проводится генетический анализ данных дальних родственников мужчины, например, двоюродного брата или сестры.
Почему нельзя дать гарантию в 100%?
— Во-первых, мы не можем исключить наличия у мужчины брата-близнеца, а у таких родственников ДНК практически идентичны.
Во-вторых, процент высчитывается по определенным маркерам. Анализируется каждый из них, затем выводится так называемый индекс отцовства. А по нему — итоговые проценты.
Что подойдет в качестве материала для исследования?
— Чаще всего анализируется буккальный эпителий отца и ребенка. Его собирают на внутренней стороне щеки. Генетический материал матери для данного анализа не требуется.
Забор материала — несложная и безболезненная процедура. Бояться ее точно не стоит. Просто нужно провести специальной палочкой по слизистой. Это займет всего пару секунд.
Для исследования пригоден и другой материал, содержащий ДНК, например, ногти, ушная сера, предметы со следами буккального эпителия (ложка, стакан или трубочка для сока, воздушный шарик). Из продуктов, которые надкусил человек, очень сложно выделить необходимый материал для исследования, так как это органика, которая под действием реагентов легко растворяется, однако иногда получается и с ними. Тут придется принять риск того, что, возможно, анализ вообще не удастся провести.
Во многих фильмах мы нередко видим, что для исследования отрезается прядь волос. Выглядит красиво, но в жизни такой локон не подойдет. Волос обязательно должен быть извлечен вместе с луковицей. Именно из нее выделяется генетический материал для определения отцовства. Причем это очень сложный процесс. Не каждая луковица подойдет для такого анализа. По отрезанной же пряди можно определить родство только по женской (материнской) линии.
Независимо от предоставленного материала, если анализ провести удалось, достоверность будет такая же, как и при заборе буккального эпителия.
Как проводится тест?
— В лаборатории создается множество копий ДНК, а затем специалисты при помощи аппаратуры сравнивают определенные участки ДНК (локусы). Чем больше локусов сравнивается, тем точнее ответ. Для результата достаточно и 16 локусов, но, чтобы перестраховаться, в лабораториях нередко исследуется большее количество — вплоть до 25. Брать еще больше просто нет смысла. Достоверность не изменится. Для исключения ошибки результаты перепроверяются двумя группами экспертов.
Как долго нужно ждать результатов?
— До 8 рабочих дней, но, как правило, результаты появляются быстрее. Время ожидания зависит от сложности анализа (например, если предоставлен нестандартный материал для исследования). Только аппарат выделяет чистый профиль для теста сутки. После чего он еще должен быть проанализирован специалистами лаборатории.
К слову, тест на материнство проводится точно так же.
Существует ли способ проверить отцовство до появления
малыша на свет?
— Да, но это исследование сложнее и, соответственно, всегда дороже.
Для анализа забирается венозная кровь матери. Из нее выделяется ДНК плода. Как? Плацента растет и развивается. Разрушенные клетки уходят в кровоток матери. И уже к определенному сроку (обычно это 10-я неделя) накапливается нужная концентрация этих клеток (необходимый показатель — около 5%), чтобы выделить генетический материал плода и сравнить его с ДНК предполагаемого отца. Исследование длится около месяца.
Какая информация указана в бланке с результатом?
— Там размещены все имеющиеся данные о предоставленном генетическом материале, об исследовании и информация о ребенке и предполагаемом отце. Кстати, для суда бланк с результатом без указания данных предполагаемого отца считается недействительным. То есть, если вы хотите провести тайный анализ, результат будет полезен только для вас. Суд же постановит провести повторный тест с указанием личности предполагаемого отца или его родственников.
Далее в ответе идет само заключение (доказано отцовство или исключается), прописываются все цифры (вероятность отцовства, индекс отцовства, таблица с анализируемыми маркерами). В общем, ответ достаточно развернутый. Но по любым вопросам обратившегося обязательно сориентируют и все объяснят.
Источник
Определение концентрации нуклеиновых кислот и чистоты препарата
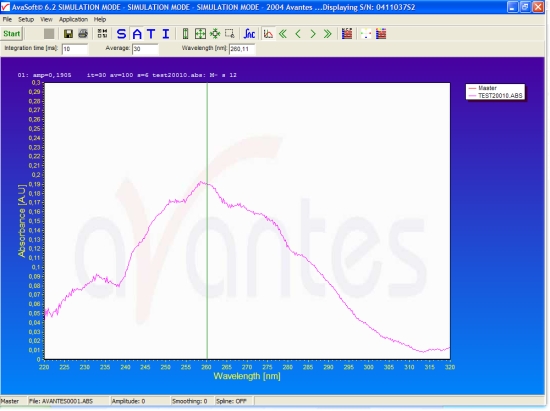
Метод определения концентрации нуклеиновых кислот (ДНК или РНК) в растворе основан на существовании у ДНК и РНК максимума поглощения при длине волны 260 нм. Это означает, что в растворах нуклеиновых кислот максимальная фотометрическая абсорбция наблюдается при 260 нм и прямо коррелирует с концентрацией ДНК или РНК.
Определение чистоты препарата ДНК или РНК
Отношение поглощения при длинах волн 260 нм и 280 нм (260нм/280нм) показывает чистоту препарата ДНК или РНК. Препарат считается чистым, если отношение значений 260нм/280нм приблизительно равно 1.8 для ДНК и 2.8 для РНК. В случае меньших значений показателя 260нм/280нм препарат содержит большое количество примесей белка, фенола или иных контаминирующих агентов, имеющих значительное поглощение при 280 нм.
Другим показателем чистоты препарата ДНК или РНК является отношение значений поглощения 260нм/230нм. В случае чистого препарата это соотношение обычно равно 1.8 – 2.2. Меньшие значения коэффициента 260нм/230нм свидетельствуют о загрязнении препарата компонентами, которые остаются после процедуры выделения ДНК или РНК.
Метод определения концентрации ДНК и РНК в растворе: на рисунке показан спектр поглощения раствора ДНК в воде с максимумом при 260 нм
Концентрация препарата ДНК — 3.6 мкг/мкл. Кювета с длиной оптического пути 1 мм, объем — 200 мкл
Отношение поглощения при длинах волн 260 нм и 280 нм (коэффициент 260нм/280нм) равен 1.73, что свидетельствует об относительно высокой чистоте препарата ДНК
Спектр поглощения получен как результат автоматического (программного) усреднения результатов 30 измерений продолжительностью по 10 мс
Определение концентрации нуклеиновых кислот и чистоты препарата можно проводить в кюветах объемом 200 мкл (длина оптического пути 1 мм), или 1000 мкл (длина оптического пути 10 мм)
Возможно построение отчетных бланков с графиками спектра поглощения и значениями поглощения при определенной длине волны для 12 образцов на одном бланке
Значения полного спектра поглощения могут быть конвертированы в формат MS Exel
При постановке измерения образец ДНК разбавляют дистиллированной водой в 40 раз (к 5 мкл раствора ДНК добавляют 195 мкл воды). Измерение поглощения при 260 нм проводят в кювете с длиной оптического пути 1 мм, используя воду в качестве референса. Значение концентрации ДНК в исходном растворе (мкг/мкл) находят, умножая значение поглощения при длине волны 260 нм на К=20.
РНК разбавляют водой в 10 раз (к 20 мкл раствора ДНК добавляют 180 мкл воды). Измерение поглощения при 260 нм проводят в кювете с длиной оптического пути 1 мм, используя воду в качестве референса. Значение концентрации РНК в исходном растворе (мкг/мкл) находят, умножая значение поглощения при длине волны 260 нм на К=4.
Источник
Способы определения концентрации днк

Cтатьи. Работа с контентом
Поиск
Определение внеклеточных ДНК крови – клиническое и диагностическое значение
Авторы представили обзор литературы, касающийся определению внеклеточных ДНК в крови. Показана их прогностическая и диагностическая значимость при различных патологических состояниях. Особое значение имеет определение внеклеточных ДНК в перинатальной патологии.
Determination of extracellular DNA in the blood — clinical and diagnostic value
The authors present a literature review concerning the definition of extracellular DNA in the blood. It is shown their predictive and diagnostic value in various pathological conditions. Particular importance is the definition of extracellular DNA in perinatal pathology.
До определенного времени считалось, что ДНК находится только в клеточных структурах: преимущественно в ядрах клеток и некоторое количество — в митохондриях, где она исполняет роль носителя генетической информации. К настоящему времени уже установлено, что небольшие количества ДНК обнаруживаются и вне клеток, прежде всего в плазме крови животных и человека. Интерес к внеклеточным ДНК неизмеримо возрос после того, как выяснилось, что количество ее может существенно возрастать при ряде заболеваний, что возможно учитывать как ранний признак соответствующих патологий. Это придало совершенно четкое практическое значение дальнейшему изучению циркулирующих нуклеиновых кислот.
Циркулирующая ДНК может появляться в кровотоке в результате гибели ядросодержащих клеточных элементов, созревания эритроцитов и тромбоцитов, а также активной секреции нуклеиновых кислот во внеклеточное пространство. Кроме того, при развитии инфекционных заболеваний в крови пациентов обнаруживаются нуклеиновые кислоты возбудителей. Уровень экзогенной ДНК в кровообращении больных, как правило, не превышает нескольких десятков пкг/мл, что слишком мало по сравнению с приводимыми в литературе данными для нормального содержания внеклеточной ДНК (до 60 нг/мл) [1]. При беременности уже на первом месяце в кровотоке матери появляется фетальная ДНК [2], обнаружение которой открывает новые возможности для неинвазивной пренатальной диагностики.
Одним из известных механизмов появления внДНК в кровотоке может быть процесс образования и созревания постклеточных структур крови — тромбоцитов и эритроцитов. В кровотоке эритроциты функционируют в течение всего периода своей жизни (100-120 суток), а затем разрушаются макрофагами селезенки, печени и красного костного мозга. В процессе созревания эритроцита, когда клетка находится в составе эритробластного островка или мигрирует через стенку кровеносных сосудов костного мозга в кровоток, происходит выталкивание ядра. За счет ежедневного обновления эритроцитов в составе ядер в кровь попадает значительное количество ДНК, которая в основной массе быстро фагоцитируется макрофагами стромы, но часть ДНК может оставаться циркулировать в кровотоке. Менее представлены в крови тромбоциты — безъядерные постклеточные структуры, образующиеся в результате фрагментации участков цитоплазмы мегакариоцитов. Тромбоциты циркулируют в крови в течение 5-10 суток, после чего фагоцитируются макрофагами, преимущественно в селезенке и легких.
Одним из простых объяснений появления внеклеточных нуклеиновых кислот в крови могут быть постоянно идущие в организме процессы отмирания клеток и деградации их хроматина. Таким образом, в первую очередь источником внеклеточной ДНК крови может быть некроз [3] или апоптоз ядросодержащих клеточных элементов крови или эндотелиальных клеток [4]. Апоптоз — наиболее широко представленная форма программируемой клеточной смерти, которая приводит к ежедневной гибели части клеток. Примерный подсчет показывает, что в организме человека в результате апоптоза деградирует 1-10 г ДНК в сутки. Апоптотические клетки и апоптотические тельца поглощаются и перевариваются макрофагами, дендритными или эндотелиальными клетками [5]. Возможно, часть апоптотических телец избегает этой участи и попадает в кровь.
В норме некроз распространен значительно меньше, чем апоптоз. Некроз может индуцироваться тяжелыми необратимыми повреждениями, такими как затянувшаяся ишемия, высокие дозы ионизирующего излучения, высокая температура и обработка агентами, которые повреждают клеточную мембрану или блокируют продукцию энергии в клетке. Некроз характеризуется конденсацией хроматина, увеличением размера клетки с ее последующим лизисом. Поскольку в норме некротические клетки в основном не обнаруживаются, этот тип клеточной гибели не может обеспечивать появление значительной части ДНК в плазме, хотя он часто наблюдается при развитии опухолей, вероятно, как результат недостаточной васкуляризации. В то же время некроз не может рассматриваться как основной источник внеклеточной ДНК у онкологических больных, поскольку высокие концентрации циркулирующей в крови ДНК зачастую наблюдаются не только на последней стадии с обширными метастазами, но и на первом этапе развития опухоли [6]. Тем не менее в некоторых случаях, например при травме, некроз может вносить значительный вклад в генерацию циркулирующих ДНК крови. Действительно, обнаружена достоверная корреляция увеличения концентрации циркулирующей в крови ДНК в зависимости от тяжести травмы у пациентов [7].
Позднее высказано предположение, что появление ДНК в крови онкологических больных может быть связано не только с процессом апоптоза, но и с активной секрецией ДНК. По-видимому, ДНК могут появляться и циркулировать в крови как в результате формирования постклеточных структур крови и гибели клеток, так и путем секреции во внеклеточное пространство. Однако следует отметить, что механизмы, обеспечивающие активную секрецию внеклеточных ДНК, окончательно не выяснены, так же, как и вклад каждого из процессов в появление циркулирующих нуклеиновых кислот во внеклеточной среде.
Авторы предполагают, что короткий срок циркуляции олигонуклеотидов в крови может быть связан не только с разрушающим действием сывороточных нуклеаз, но и с быстрым выведением олигомеров из циркуляции и перераспределением по органам и тканям. Отмечается двухступенчатый характер выведения олигонуклеотидов из кровеносного русла [8]. Первый этап характеризуется высокой скоростью снижения концентрации в крови олигонуклеотидов со временем полужизни менее 30 минут. Второй этап — это длительная циркуляция в крови олигомера в низкой концентрации, со временем полужизни 20-40 часов. Современные данные о длительности циркуляции внеклеточной ДНК полностью их подтверждают: время полужизни фетальной ДНК в кровотоке родившей женщины составляет 16 минут, а полное ее выведение достигается за 2 часа [9].
Исследования фармакокинетики олигонуклеотидов показали, что за первые сутки с мочой выводится около 30% введенного материала. Действительно, недавно обнаружены опухолеспецифические нуклеиновые кислоты не только в крови, но и в моче больных с новообразованиями, локализованными вдали от мочевыводящих путей [10].
После обнаружения циркулирующей ДНК в крови человека и животных были предприняты попытки выявить корреляцию между концентрацией внеклеточной ДНК и развитием ряда патологических состояний. Для определения концентрации внеклеточной ДНК в плазме/сыворотке крови использовали разнообразные методы, в связи с чем данные о концентрации циркулирующей ДНК в норме значительно варьируют. Наиболее достоверными представляются данные последних исследований, в которых концентрацию ДНК определяли при помощи флуоресцентных красителей и количественной ПЦР. Литературные данные позволяют сделать вывод, что в норме концентрация циркулирующей ДНК не должна превышать 50-60 нг/мл плазмы/сыворотки, а увеличение концентрации до 100 нг/мл и выше может указывать на возможное развитие патологии [11].
Интерес к внеклеточной ДНК плазмы крови в настоящее время все более возрастает, что связано с прогностической и диагностической значимостью этого показателя при лучевом облучении, онкологических, аутоиммунных заболеваниях, неврологических расстройствах и посттравматическом синдроме. При перечисленной патологии существенно изменяются не только концентрация, но и фракционный состав внеклеточной ДНК: появление в плазме крови ее низкомолекулярных фрагментов зачастую возникает во время развития рака, инсульта, при ишемических процессах.
Доказано появление низкомолекулярной фракции ДНК в плазме крови при лучевой патологии уже через несколько часов после воздействия ионизирующих излучений, причем с прямо пропорциональной зависимостью прироста фракции от дозы воздействия и снижением при улучшении состояния больного [12]. Кроме того, отмечена диагностическая значимость концентрации циркулирующей в крови ДНК при оценке тяжести травмы. Обнаруженная достоверная корреляция уровня внеклеточной ДНК с тяжестью травмы позволяет прогнозировать возможность травматического шока и оценить степень тяжести травмы [13].
Уровень циркулирующей ДНК в крови возрастает при развитии аутоиммунной патологии [14], причем концентрация ДНК в плазме больных системной красной волчанкой, находящихся в состоянии ремиссии, не отличается от нормы, а значительное повышение концентрации циркулирующей ДНК отмечено только у пациентов с активной формой заболевания [15].
Относительно невысоким уровнем свободной ДНК в сыворотке больных характеризуются вирусные заболевания, в частности гепатиты В и С [16]. Поэтому прогностическую значимость может иметь, по-видимому, измерение уровня ДНК в сыворотке крови больных гепатитом лишь в динамике заболевания.
Активно разрабатываются методики исследования внДНК у онкологических больных. Уровень циркулирующей ДНК возрастает также при развитии целого ряда онкологических заболеваний [17]. Некоторые исследователи предлагают использовать концентрацию циркулирующей в крови ДНК для дифференцированного диагноза доброкачественных и злокачественных опухолей желудочно-кишечного происхождения, утверждая, что при злокачественных опухолях, по сравнению с доброкачественными, концентрация ДНК значительно повышается (412 ± 63 и 118 + 14 нг/мл соответственно). Этим данным противоречат работы ряда авторов [18, 19], в которых показано, что уровень циркулирующей ДНК при развитии патологии по сравнению с нормой достоверно повышается уже на ранних стадиях заболевания, однако четкой корреляции между концентрацией ДНК в плазме крови онкологических больных и клиническим течением заболевания не прослеживается. Корреляции между концентрацией циркулирующей ДНК и локализацией опухоли не найдено, однако при метастазах в крови наблюдается более высокое содержание циркулирующей ДНК.
По-видимому, определение концентрации ДНК в крови может быть использовано для мониторинга эффективности хирургического лечения [18] и/или радио- [20], химио- или гормонотерапии. При этом наибольший интерес вызывает именно динамика изменения уровня циркулирующих нуклеиновых кислот, а не единичное значение их концентрации в крови. Возрастание концентрации циркулирующих ДНК позволяет сделать заключение о прогрессировании заболевания, в частности о появлении метастазов.
Для повышения диагностической ценности были предприняты попытки связать концентрацию и форму циркуляции ДНК с развитием патологии. Оказалось, что концентрация циркулирующих в крови нуклеосом коррелирует с клиническим статусом пациента после химио- и радиационной терапии. Поскольку большинство лекарств, применяемых в химиотерапии, индуцируют апоптоз в опухолевых и отчасти в нормальных клетках, по содержанию нуклеосом в крови пациентов возможен мониторинг эффективности специфической терапии злокачественных образований.
Исследование распределения циркулирующей ДНК в крови больных раком молочной железы и желудочно-кишечного тракта [19] показало, что при развитии данной патологии на фоне повышения концентрации циркулирующей ДНК в плазме происходит достоверное снижение концентрации дезоксирибонуклеиновых кислот, связанных с поверхностью форменных элементов крови, по сравнению со здоровыми донорами. По-видимому, изменение распределения циркулирующей ДНК в крови онкологических больных характерно для злокачественных новообразований, и данные о концентрации циркулирующей ДНК в плазме крови и на поверхности клеток могут быть использованы для дифференциальной диагностики опухолей. При этом очевидно, что для точной постановки диагноза необходим анализ онкоспецифических последовательностей циркулирующих ДНК, а связанные с поверхностью циркулирующие ДНК могут быть использованы наряду с циркулирующей ДНК плазмы для ПЦР-диагностики рака.
Выявлено значительное увеличение концентрации внДНК у недоношенных новорожденных и у новорожденных с перинатальной патологией, описано влияние внДНК на изменения иммунного статуса новорожденных при перинатальных поражениях [21].
В 1997 году впервые было продемонстрировано присутствие фетальной внеклеточной ДНК в плазме и сыворотке беременных женщин [22]. Данное открытие способствовало интенсивному изучению плодной ДНК в качестве потенциального маркера для неинвазивной пренатальной диагностики. Метод измерения концентрации внДНК плода в крови матери основывался на обнаружении последовательности Y-хромосомы (SRY) методом количественной ПЦР в реальном времени. Была прослежена положительная связь между сроком беременности и уровнем фетальной внДНК. Биологические основы, благодаря которым происходит увеличение концентрации внДНК матери и плода с развитием беременности, остаются неясными. К этому приводит усиление трансплацентарного транспорта нуклеиновых кислот или интенсификация пролиферативных / апоптотических процессов в самой плаценте. Существует мнение, что повышение концентрации внеклеточной фетальной ДНК в материнской циркуляции происходит вследствие возможной редукции выведения ДНК из организма матери, причиной чего могут быть различные физиологические изменения функций органов выделения женщины в течение беременности. Доказано [23], что в плазме крови беременных женщин циркулируют более длинные молекулы ДНК, чем в плазме небеременных женщин. При этом молекулы фетальной ДНК в целом короче, чем материнской ДНК, и более фрагментированы. Предполагается, что фетальная ДНК попадает в кровь матери путем транспорта через плаценту фетальных клеток, которые быстро разрушаются иммунной системой матери и в результате лизиса клеток плаценты и прямого выброса ДНК плода в кровь матери [24]. Фетальная ДНК обнаруживается уже на первых неделях развития плода (у 80% беременных женщин она обнаруживается на 28й день после зачатия). Эти данные свидетельствуют в пользу того, что фетальная ДНК появляется в крови матери раньше времени формирования системы кровообращения плода. В настоящее время многие работы подтверждают, что источником внДНК плода в материнском кровотоке являются клетки трофобласта.
Одни из первых работ, посвященных изучению фетальной внДНК в крови матери как маркера для неинвазивной пренатальной диагностики были направлены на обнаружение последовательностей Y-хромосомы как маркера плода мужского пола в крови беременных женщин с целью дородовой диагностики заболеваний, сцепленных с полом [25]. Было показано, что чувствительность определения локусов Y-хромосомы до 7-й недели беременности методом обычной ПЦР составляет 95%, а при использовании ПЦР в реальном времени пол эмбриона со 100% точностью можно определить уже на 5-й неделе развития.
Проведены работы по выявлению резус-антигена Rh-D плода в крови резус-негативных женщин [26], что позволяет сформировать группу риска и как можно раньше начать мероприятия, направленные на предотвращение резус-конфликта между матерью и плодом.
Одной из важных функций пренатальной диагностики является своевременное определение у плода хромосомных заболеваний [27]. Показано, что уровень фетальной ДНК в плазме и сыворотке матери, при вынашивании плода с синдромом Дауна, повышается в среднем в 2 раза. Изменяется уровень внДНК при других анеуплодиях — повышается в случае трисомии по хромосоме 13, и остается низким при трисомии 18. Предполагается, что возможной причиной изменения концентрации внДНК при развитии плода с аномальным кариотипом является патология плаценты (ворсины с неправильной структурой могут быть либо гипер- либо гиповаскуляризированы, что усиливает или ослабляет выход клеток и нуклеиновых кислот плода в материнский кровоток). Помимо измерения концентрации внДНК плода в крови матери в настоящее время исследуются новые молекулярные маркеры для обнаружения хромосомного дисбаланса у плода, а также выполнены успешные эксперименты по выявлению у плода однонуклеотидных полиморфизмов и точковых мутаций.
Еще в 1999 году было обнаружено почти 5-кратное повышение внДНК плода в кровотоке матери при преэклампсии по сравнению с группой женщин с нормально протекающей беременностью [28]. При дальнейшем изучении этой патологии выявлены не только рост концентрации внДНК плода, но и значительное повышение внДНК матери, причем увеличение обоих показателей соответствовало степени тяжести заболевания. Кроме того, было показано, что концентрация внДНК плода возрастает задолго до появления первых клинических симптомов. Так как ДНК плазмы является маркером клеточной гибели, повышенная концентрация фетальной ДНК может быть результатом некроза и апоптоза клеток плаценты. А нарушение функции почек и печени, наблюдаемое при преэклампсии, ослабляет выведение циркулирующей ДНК из материнской крови.
Увеличение концентрации фетальной ДНК в крови матери описаны и при других нарушениях течения беременности, таких как начавшийся самопроизвольный выкидыш в I триместре, преждевременные роды [29], истинное приращение плаценты [30].
Современные технологии позволяют использовать новые знания в практической медицине. Дальнейшее изучение нуклеиновых кислот плода в крови матери необходимо с целью разработки новых маркеров в неинвазивной пренатальной диагностике патологических состояний плода на раннем этапе их возникновения.
Ю.А. Ковалева, А.А. Хасанов, Л.М. Сингатуллина
Казанский государственный медицинский университет
Казанский государственный университет
Ковалева Юлия Анатольевна — врач акушер-гинеколог акушерского физиологического отделения Клиники медицинского университета
1. Hacker H J., Zhang W., Tokus M., Bock T., Schroder C.H. Patterns of circulating hepatitis В virus serum nucleic acids during lamivudine therapy. Ann. N. Y. Acad. 2004. Sci. 1022, 271-281.
2. Федченко В.И., Гурьев CO., Семенова Н.В. Неинвазивная пренатальная ПЦР диагностика пола. Биомед. химия 2005; 51: 527-535.
3. Rainer T.H., Lo Y.M., Chan L.Y.. et al. Derivation of a prediction rule for posttraumatic organ failure using plasma DNA and other variables. Ann. N.Y. Acad. Sci. 2001; 945: 211-220.
4. Jahr S., Hentze H., Englisch S., et al. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancel Res. 2001; 61: 1659-1665
5. Nagata S. Apoptotic DNA fragmentation. Exp. Cell. Res. 2000; 256: 12-28.
6. Laktionov P.P. Tamkovich S.N., Rykova E.Yu.. et al. Extracellular circulating nucleic acids in human plasma in health and disease. Nucleosides Nucleotides Nucleic Acids. 2004; 23: 879-883.
7. Lam N.Y.. RainerT.H., Chan L.Y.. Joynt G.M.. Lo Y.M. Time course of early and late changes in plasma DNA in trauma patients. Clin. Chem. 2003; 49: 1286-1291.
8. ShawJ.P., Kent K., Bird J., Fishback J., Froehler B. Modified deoxyoligonucleotides stable lo exsonuclease degradation in serum. Nucleic Acids Res. 1991; 19: 747-750
9. Lo Y.M., Zhang J., Leung T.M.et al. Rapid clearance of fetal DNA from maternal plasma. Am. J. Hum. Genet. 1999; 64: 218-224.
10. Bryzgunova O.E., Skvortsova Т.Е., Kolesnikova E.V. et al. Isolation and comparative study of cell-free nucleic acids from human urine. Ann. N. Y. Acad. Sci. 2006; 1075: 334-340.
11. Тамкович С.Н., Власов В.В., Лактионов П.П. Циркулирующие ДНК крови и их использование в медицинской диагностике. Молекулярная биология 2008; 42: 1: 12-23.
12. Vasilyeva I.N. Low-molecular-weight DNA in blood plasma as an index of the influence of ionizing radiation. Ann. N. Y. Acad Sci. 2001; 945: 221-228.
13.Lam NY., Rainer Т.Н.. Chan L. Y., Joynt G.M., Lo Y.M. Time course of early and late changes in plasma DNA in trauma patients. Clin. Chem. 2003; 49: 1286-1291.
14. Steinman C.R. Circulating DNA in systemic lupus erythematosus. Association with central nervous system involvement and systemic vasculitis. 1979. Am.1. Med. 67. 429-435.
15. RaptisL.. Menard H. Quantitation and characterization of plasma DNA in normals and patients with systemic lupus erythematosus. .1. Clin. Invest. 1980; 66: 1391-1399.
16. Шевчук Н.А. Время-разрешенный иммуно-флюоресцентный анализ на ДНК и исследование содержания ДНК в сыворотке человека. Вопр. мед. Химии 2001; 47: 439-448.
17. Anker P., Mulcahy H., Stroun M. Circulating nucleic acids in plasma and serum as a noninvasive investigation for cancer: time for large-scale clinical studies? Int. I. Cancer. 2003; 103: 149-152.
18. Sozzi G., Conte D., Mariani L.. et al. Analysis of circulating tumor DNA in plasma at diagnosis and during follow-up of lung cancer patients. Cancer Res. 2001; 61: 4675-4678.
19.Тамкович С.Н., Брызгунова О.Е., Рыкова Е.Ю.. и др. Циркулирующие нуклеиновые кислоты в крови больных раком желудка и толстой кишки. Биомед. химия 2005; 51: 321-328.
20. Lo Y. M. Leung S.F., Chan L.Y. et al. Kinetics of plasma Epstein-Barr virus DNA during radiation therapy for nasopharynceal carcinoma. Cancer Res. 2000; 60: 2351-2355
21. Туаева Н.О. Внеклеточная ДНК и ее участие в иммунном ответе у новорожденных детей: автореферат дисс. … канд. биол. Наук. Казань, 2007. 22. Lo Y.M.D., Corbetta N., Chamberlain P.F. et al. Presence of fetal DNA in maternal plasma and serum. Lancet 1997; 350: 485-487.
23. Chan K.C.A., Zhang J. et all. Size distributions of maternal and fetal DNA in maternal plasma. Clin. Chem. 2004; 50: 88-92.
24. Токарева А.Г., Лебедев И.Н. и др. Внеклеточные нуклеиновые кислоты плода в крови матери: характеристика, происхождение, значение для пренатальной диагностики. Медицинская генетика 2006; 5: 8(50).
25. Farina A., Caramelli E., Concu M. et al. Testing normality of fetal DNA concentration in maternal plasma at 10-12 completed weeks gestation: a preliminary approach to a new marker for genetic screening. Prenat. Diagn. 2002; 22: 148-152.
26. Li Y., Zimmerman B., Zhong X.Y., et al. Determination of RhD zygosity using real-time guantitative PCR. Swiss Med. Wkly. 2003; 133: 442-445.
27. Gahan P., Swaminathan R. et al. Circulating Nucleic Acids in Plasma and Serum V.-2008. Annals of the New York Academy of sciences. 345
28. Lo Y.M.D., Leung T.N., Tein M.S.C. et al. Quantitative abnormalities of fetal DNA in maternal serum in preeclampsia. Clin. Cem. 1999; 45: 184-188.
29. Farina A., Leshane E. S., Romero R. et al. High levels of fetal cell-free DNA in maternal serum: a risk factor for spontaneous preterm delivery. Am. J. Obstet.Gynecol. 2005; 193: 421-425.
30. Sekizawa A., Jimbo M., Saito H. et al. Increased cell-free fetal DNA in plasma of two women with invasive placenta. Clin. Chem. 2002; 48: 353-354.
Источник