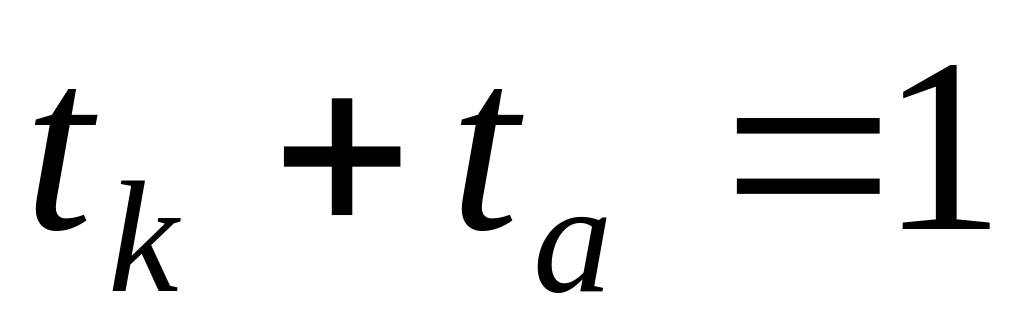Шпаргалки к экзаменам и зачётам
студентам и школьникам
Шпаргалки по электрохимии. Часть 2 — Числа переноса ионов. Методы определения чисел переноса
Числа переноса ионов. Методы определения чисел переноса. Числа переноса истинные и кажущиеся. Зависимость чисел переноса от концентрации и температуры.
Одним из важнейших понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, поэтому возникает вопрос, каково участие в этом процессе ионов каждого знака.
Количество переносимого электричества определяется концентрацией ионов и скоростью их движения; когда концентрации катионов и анионов одинаковы, участие их в переносе электричества зависит лишь от относительной скорости их движения. Так как скорости движения катионов и анионов могут быть существенно различными, потому и числа переноса должны быть разными. Это было установлено Гитторфом (1854).
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов :
t+ = 


I+ = 


t+ = 





Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона. Так как подвижности катиона и аниона изменяются с концентрацией и температурой в общем случае неодинаково, то и числа переноса зависят от концентрации и температуры, хотя эта зависимость более слабая.
Выведенное соотношение позволяет вычислить числа переноса, если известны значения подвижностей ионов. С другой стороны, опытное определение чисел переноса дает возможность вычислить подвижности.
Видно, что число переноса не является характеристикой только данного иона, так как зависит от подвижности парного с ним иона. Таким образом, число переноса ti характеризует не индивидуальное свойство иона, а роль этого иона в миграционном переносе зарядов в данном растворе электролита. В бинарном растворе число переноса зависит от подвижности второго иона, а в многокомпонентном растворе еще и от соотношения концентраций компонентов раствора. Например, число переноса хлорид-иона в растворе Н Cl меньше, чем в растворе К Cl той же концентрации, поскольку ионы водорода более подвижны, чем ионы калия.
Экспериментально числа переноса определяются по изменению концентрации ионов у электродов (метод Гитторфа) .

А + + + + + + + + + + + + + + + + + +
Б + + + + + + + + + + + + +
В – – – + + + + + + + + + + + + + + +
– – – – – – – – – – – – – – – + + +
I II III
Рис. 29. Определение чисел переноса ионов по методу Гитторфа
Рассмотрим схему движения ионов (переноса электричества) в растворе HCl при электролизе (см. рис. 29). Разделим мысленно ванну с электролитом на три отделения: I — анодная часть (анолит), II — центральная часть, III — катодная часть (католит). В процессе электролиза в отделении II концентрация электролита не изменяется, в отделениях I и III — изменяется. Схема А: до электролиза концентрация раствора во всех отделениях одинакова (в каждом из отделений находится по 6 пар ионов). Схема Б: абсолютная скорость движения Н + приблизительно в 5 раз больше, чем скорость Cl – , поэтому в течение определенного промежутка времени при электролизе ионы Н + пройдут слева направо путь, в 5 раз больший, чем ионы С l – за то же время справа налево. В результате в катодном пространстве появится 6 лишних ионов водорода, а в анодном — столько же лишних ионов хлора. Схема В: эти ионы разряжаются на электродах и выделяются в виде газов. В анодном пространстве остается одна пара ионов, в катодном — 5 пар. Убыль электролита у анода D са (5 пар ионов) в 5 раз больше убыли электролита у катода D ск (1 пара ионов). Отношение D са/ D ск равно отношению абсолютных скоростей катиона и аниона и равно отношению их подвижностей:
Числа переноса определяются из соотношений
t + = 



и в рассмотренном примере t + ( H + ) » 5/6 = 0,83 , t – ( Cl – ) » 1/6 = 0,17 , откуда видно, что количество ионов данного типа, участвующих в переносе электричества, никак не связано с количеством ионов, передавших свой заряд электроду.
Для успешного применения метода Гитторфа необходимо, чтобы на границе электрод – раствор при пропускании электрического тока не происходили побочные процессы (например, разряд молекул растворителя) и чтобы время пропускания тока не было очень длительным (тогда можно пренебречь выравниванием концентрации за счет диффузии через пористую перегородку). В результате этого изменения концентрации оказываются небольшими, и это повышает требования к аналитическим методам, при помощи которых определяют изменение содержания соли.
Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса; они не являются истинными, так как этот метод не учитывает сольватации ионов. Измеряемые в методе Гитторфа концентрации определяются не только количеством катионов и анионов, но и количеством растворителя, перенесенного этими ионами в виде сольватных оболочек. Оболочки ионов разных знаков неодинаковы по величине.
Существование рассмотренного эффекта можно легко установить, прибавив к электролиту недиссоциирующее на ионы вещество, например, сахар или мочевину. Учитывая изменение концентрации прибавленного неэлектролита при определении чисел переноса, можно ввести поправку на перенос воды из анодного пространства в катодное в виде сольватных оболочек и найти истинные числа переноса t + и t – . Но обычно в значения чисел переноса, найденные опытным путем по методу Гитторфа, поправки не вводятся.
Существуют и другие методы определения чисел переноса. В лекции 57 будет рассмотрен метод, в котором для определения чисел переноса измеряется ЭДС концентрационной цепи 2-го рода (электрохимической цепи, состоящей из двух одинаковых электродов, отличающихся концентрацией электролита). В этой цепи имеется жидкостная граница – граница между двумя растворами одинаковой природы и разной концентрации, через которую происходит перенос ионов в соответствии с их числами переноса. ЭДС такой цепи зависит от числа переноса катиона либо аниона.
Еще один метод определения чисел переноса – метод движущейся границы. Сущность этого метода состоит в том, что растворы двух солей, имеющих одинаковый ион, помещают в узкую вертикальную трубку, причем так, что они образуют резкую границу раздела. Раствор-индикатор в трубке находится внизу и имеет большую плотность. Вверху трубки находится исследуемый раствор. При выполнении некоторых условий граница двух растворов не размывается при пропускании электрического тока. Например, концентрацию исследуемого раствора подбирают таким образом, чтобы выполнялось регулирующее соотношение Кольрауша:
Определяя положение границы через определенный промежуток времени, можно рассчитать число переноса.
Например, пусть растворы солей K Cl и BaCl 2 имеют общий анион Cl – . Раствор K Cl – исследуемый, а BaCl 2 – индикатор. Тогда регулирующее соотношение Кольрауша имеет вид
Через растворы пропускают электрический ток и наблюдают за перемещением границы раздела. Если за время t через систему прошло q Кулонов, то количество электричества, перенесенное катионами К + , равно t + q . Заряд t + q должен быть равен заряду всех катионов К + , которые содержались в объеме V , определенном по перемещению границы. Поэтому t + q = z + Fc + V , откуда
Аналогично можно оценить число переноса аниона.
Зависимость чисел переноса от концентрации обычно невелика. Экстраполяция этой зависимости к нулевой концентрации дает предельные числа переноса ti o . Однако в некоторых случаях число переноса сильно изменяется с концентрацией и может оказаться равным нулю и даже меньше нуля (например, для концентрированного раствора CdI 2 t + 0). Это можно объяснить образованием комплексных анионов CdI 4 2– .
При не очень высоких концентрациях полностью диссоциирующего бинарного электролита наблюдается следующая закономерность в зависимости ti от концентрации. Если ti o = 0,5, то при увеличении концентрации раствора число переноса остается практически неизменным. Если ti o 0,5, то с ростом концентрации соли число переноса уменьшается, а если ti o > 0,5 – увеличивается.
Влияние температуры на числа переноса незначительно. Во многих случаях числа переноса при повышении температуры приближаются к 0,5, то есть подвижности катиона и аниона становятся почти одинаковы.
Растворы одной и той же соли в разных растворителях имеют различные числа переноса; это объясняется, в основном, различной степенью сольватации катионов и анионов в зависимости от растворителя.
Источник
Методы определения чисел переноса.
Для определения чисел переноса используют три метода.
По методу Гитторфа определяют аналитическим путем изменение количества электролита в анодном или катодном пространстве электрохимической системы при прохождении через нее постоянного тока и рассчитывают числа переноса по формуле
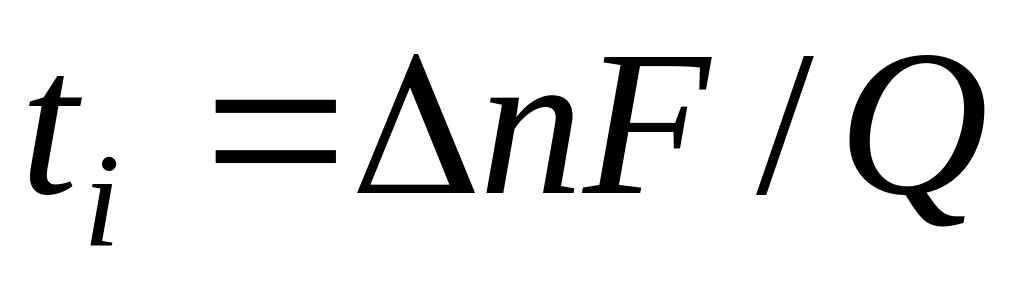
где n — изменение содержания электролита; определяемое аналитически вблизи каждого из электродов, г-экв; F— число Фарадея, Кл моль -1 ; Q — общее количество электричества, пропущенное через электрохимическую систему и определяемое кулонометрически.
В настоящее время применяют кулонометры — системы, в которых весь ток расходуется лишь на одну электрохимическую реакцию — трех типов: весовые — серебряные и медные; объемные — водородные и ртутные; титрационные — чаще других используют анодное растворение серебра (кулонометр В. А. Кистяковского) или электролитическое окисление ионов иода.
Найденные по формуле (10) числа переноса не учитывают гидратацию ионов и перенос молекул растворителя через мембраны, разделяющие приэлектродные пространства при электролизе, поэтому они называются эффективными, или кажущимися. При выборе в качестве системы отсчета растворителя в целом расчет чисел переноса (особенно для концентрированных растворов) следует проводить по уравнению
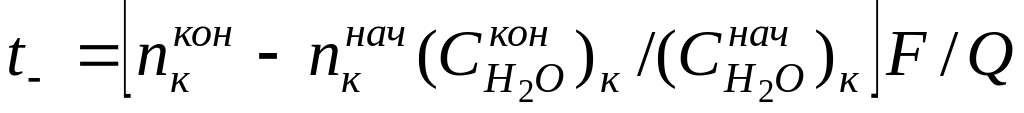
где 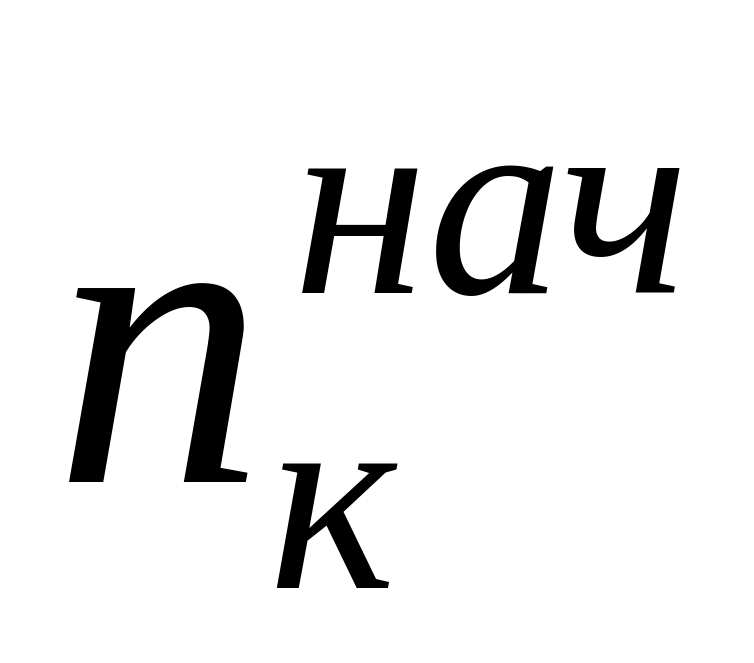
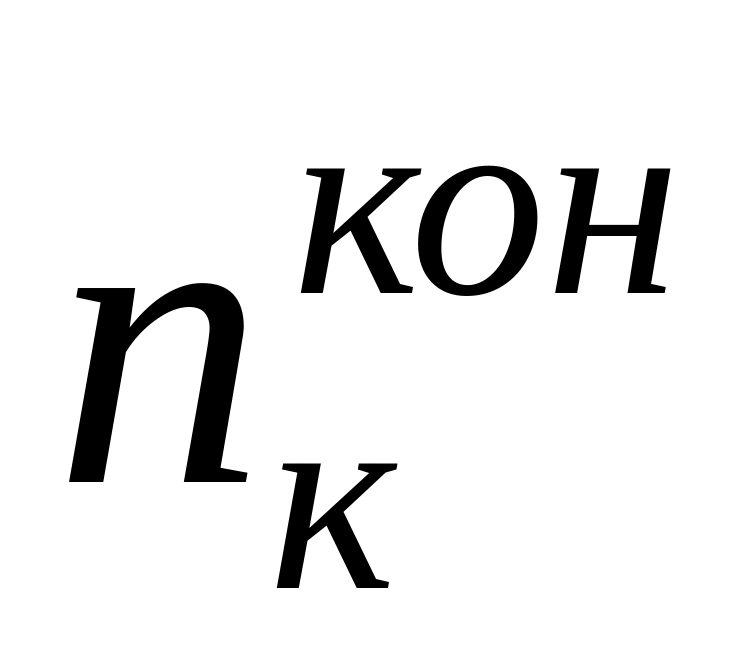
г-экв; 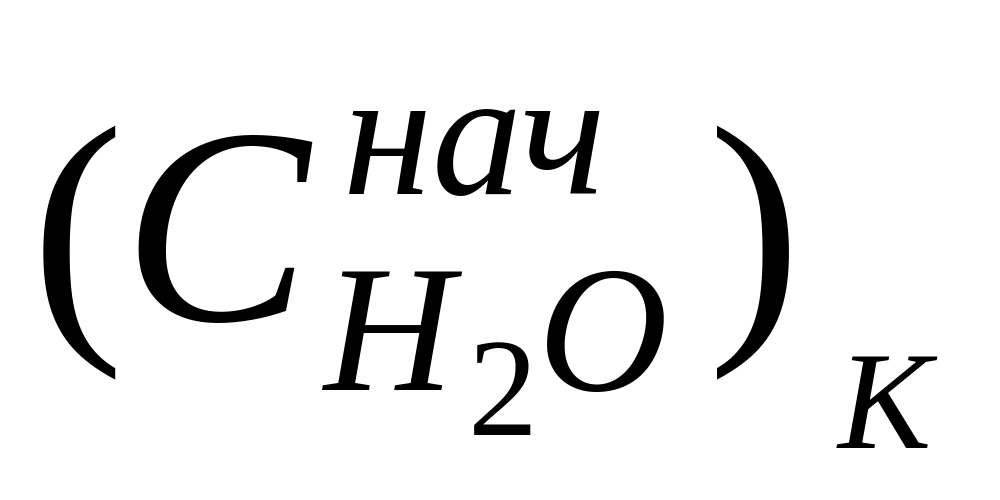
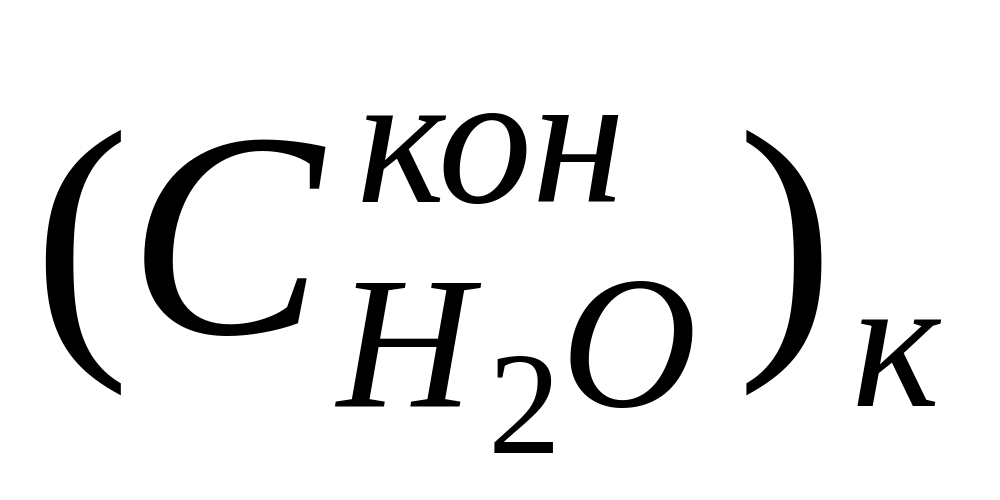
По методу движущейся границы определяют расстояние l, на которое перемещается граница между двумя окрашенными или разной плотности растворами с одним общим ионом в узкой вертикальной трубке сечением s под действием постоянной разности потенциалов за определенный промежуток времени при выполнении условий:
1) регулирующего соотношения Кольрауша (с точностью до 10%):
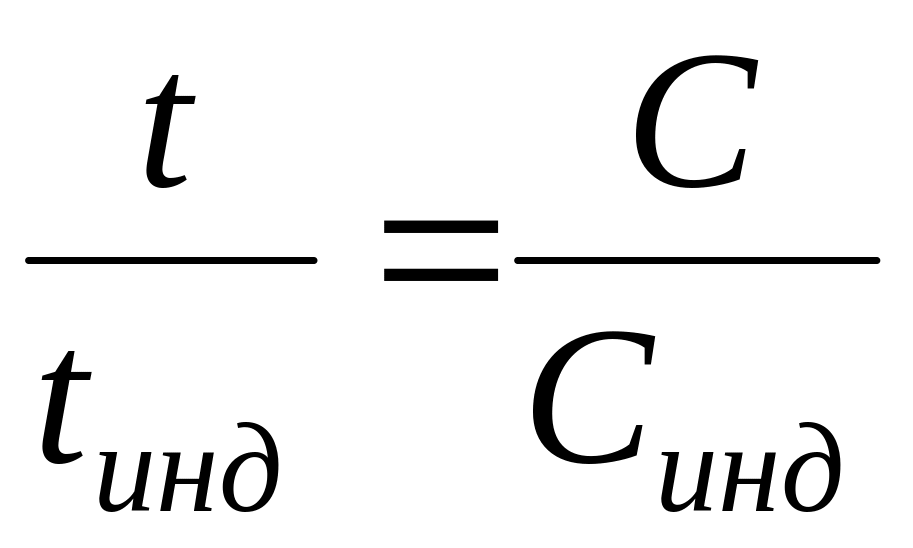
где t /tинд — числа переноса в исследуемом и индикаторном растворах; С, Синд — соответствующие концентрации;
2) число переноса индикаторного раствора меньше исследуемого, т.е. 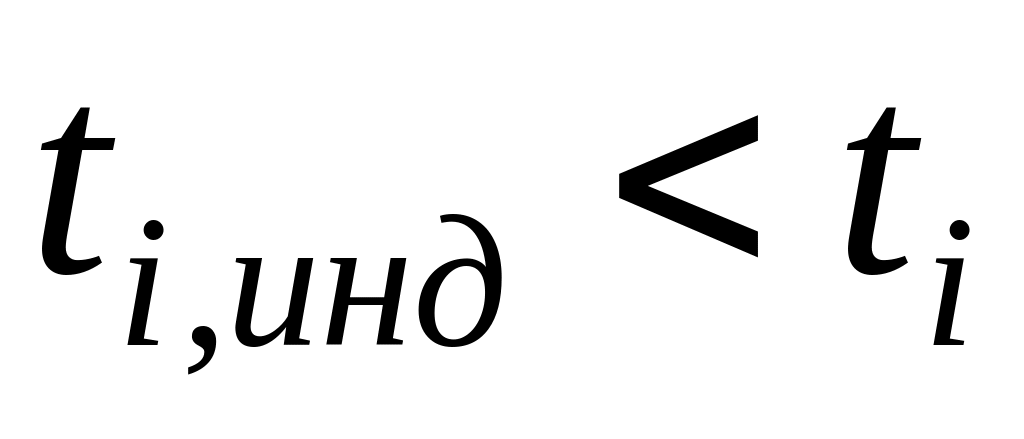
3) индикаторный раствор имеет большую, чем исследуемый, плотность и располагается в нижнем слое — сохраняется резкая граница между растворами при электролизе.
Число переноса в этом методе рассчитывают по формуле
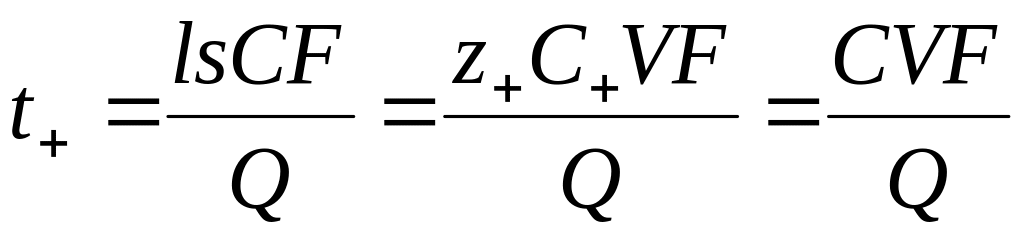
где С — концентрация исследуемого раствора; z+ — заряд иона; С+ — концентрация иона; V = ls — объем раствора, прошедшего по трубке за время . Видно, что формула (13) идентична (10). Отметим, что при выборе в качестве системы отсчета растворителя в соотношение (13) нужно ввести поправку на изменение объема V, связанное с перемещением по трубке из-за электродных реакций воды:
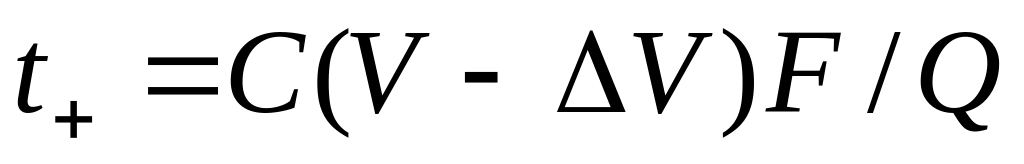
Также различают метод определения чисел переноса ионов, связанный с измерением диффузионного потенциала в концентрационных цепях с переносом.
В растворе перенос электричества осуществляется ионами, причем каждый вид ионов переносит определенное количество электричества в зависимости от содержания данных ионов в растворе, их валентности и скорости движения в электрическом поле.
Общее количество электричества е, прошедшего через раствор, складывается из количества электричества, перенесенного всеми ионами:
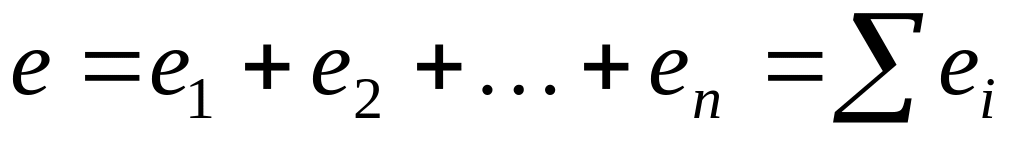
Доля количества электричества, перенесенного ионами i, называется числом переноса ti:
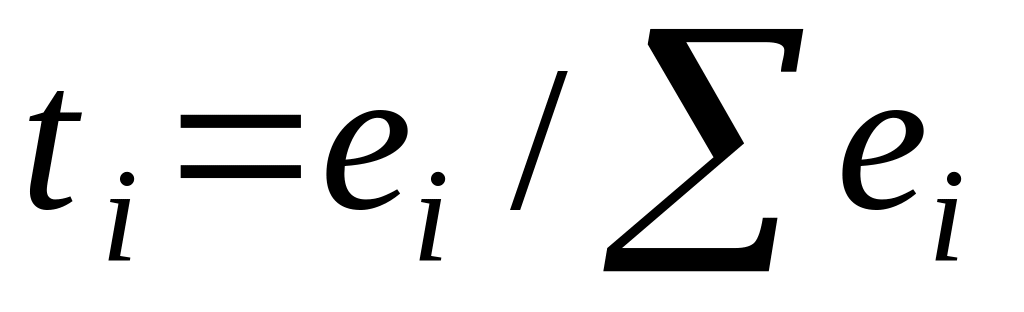
Для раствора электролита АВ, диссоциирующего по схеме
числа переноса могут быть выражены равенствами:

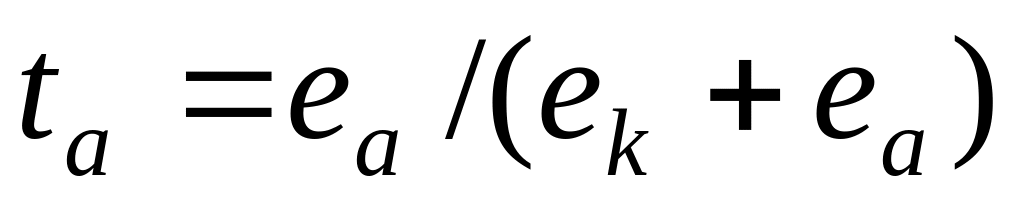
где ек и еа – количество электричества, перенесенное катионами А + и анионами В — соответственно.
Поскольку количество электричества, перенесенное ионами данного вида, пропорционально скорости их движения, то числа переноса можно определить через абсолютные скорости ионов:

Или, учитывая, что = uF , через подвижности (электропроводности) ионов:

Числа переноса зависят от подвижности всех ионов в растворе, природы растворителя, концентрации и температуры. Влияние изменения концентрации незначительно; при концентрации растворов ниже 0,2 н. числа переноса практически остаются постоянными. Благодаря этому можно легко определить значение ti при бесконечном разбавлении путем экстраполяции. Зная число переноса и эквивалентную электропроводность при бесконечном разбавлении, можно рассчитать подвижность ионов, решая уравнение:
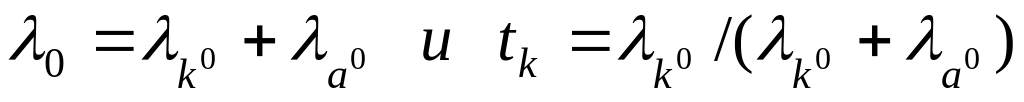
С увеличением температуры за счет неодинаковой степени дегидратации ионов А + и В — числа переноса выравниваются и стремятся к 0,5.
Установка для определения чисел переноса.
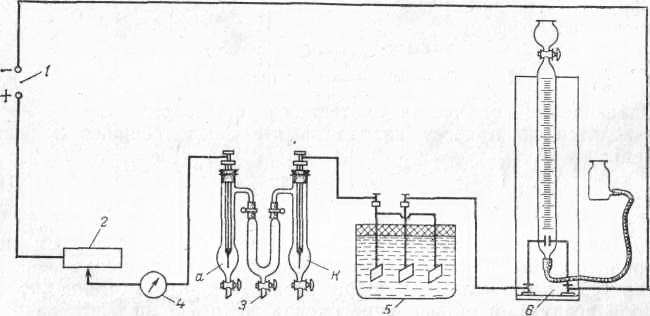
Схема лабораторной установки для определения чисел переноса показана рис. 2
Рис. 2 Схема установки для определения чисел переноса ионов:
/—источник постоянного тока; 2 — реостат; 3 — электролизер для определения чисел переноса ионов (а — анодный сосуд; к – катодный сосуд); 4 — миллиамперметр; 5 — медный кулонометр; 6 — газовый кулонометр.
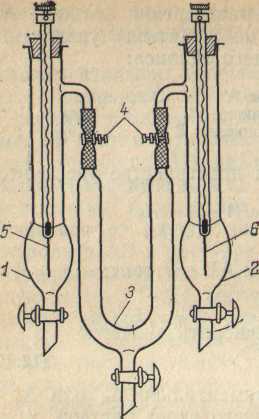
Рис. 3 Электролизер для определения чисел переноса ионов:
/ — анодный сосуд; 2 — катодный сосуд; 3 — соединительный сосуд; 4 — зажимы; 5, 6 — электроды.
Поскольку при измерении чисел переноса необходимо определять изменение содержания электролита у каждого электрода отдельно, то в электролизере 3 анодное и катодное пространство должны быть в достаточной степени разделены. Для этой цели удобно пользоваться прибором, изображенным на рис. 3.
Кулонометры. Количество протекающего через цепь электричества определяется с помощью кулонометров — приборов, основанных на электрохимическом принципе действия. Расчет количества электричества производится на основании законов электролиза Фарадея. Необходимым условием при этом является протекание на электроде одного единственного электрохимического процесса, отсутствие побочных химических реакций и механических потерь продукта, т. е. электродный процесс должен проходить с выходом по току 100%.
По методам определения количества образующихся веществ кулонометры подразделяются на весовые, объемные и титрационные.
Медный кулонометр (весовой) состоит из медных электродов — пластинок, погруженных в раствор CuSO4. На границе раздела «электрод — электролит» протекают процессы:
Сu 2+ + 2е — 
Определение количества протекающего электричества eF производится по привесу катода за счет выделившейся на нем меди:
где т — масса выделившейся меди, г; 31,77 — химический эквивалент меди.
Точность показаний кулонометра 0,1—0,5%- Основным источником погрешностей является частичное растворение медных электродов в кислом растворе, особенно в присутствии кислорода воздуха, и образование оксида меди (I) за счет реакции на катоде:
в нейтральном растворе и при малых плотностях тока, а также осаждение меди на катоде в губчатой форме при высоких плотностях тока. Для повышения точности показаний кулонометра рекомендуется в качестве электролита использовать раствор следующего состава: CuSO4*5H2O — 150 г/л; H2SO4 — 50 г/л; С2Н5ОН — 50 г/л; вести электролиз при умеренных плотностях тока на катоде в пределах от 2 до 20 мА-см -2 . В объемных кулонометрах количества выделяющихся на электродах веществ определяют измерением их объемов. Примером такого типа приборов является газовый кулонометр. Кулонометр состоит из градуированной бюретки, в нижний конец которой впаяны два платиновых электрода. Бюретку и уравнительную склянку заполняют 0,5 М раствором сульфата натрия.Для повышения точности показаний кулонометра рекомендуется перед каждым опытом насыщать раствор электролита водородом и кислородом. С этой целью собирают установку согласно рис.2, в которую включают только один газовый кулонометр (электролизер 3 и другие кулонометры не включаются) и пропускают ток 50 мА в течение 5—10 мин. Электролиз ведут при открытом кране. Затем, поднимая уравнительную склянку, заполняют газовую бюретку раствором настолько, чтобы в ней оставалось примерно 1—2 мл газа. После этого закрывают кран, уровни растворов в бюретке и склянке приводят к одной и той же высоте и отсчитывают объем V1 оставшегося в бюретке газа. Очевидно, давление газа в бюретке при этих условиях будет равно атмосферному. Аналогично определяется объем V2 газовой смеси и по окончании основного опыта. Разность V2—V1 = V будет соответствовать объему гремучей смеси, выделившейся в кулонометре за время опыта.
Количество электричества определяют по формуле:
где р — внешнее давление, мм рт. ст.; h — давление насыщенного пара воды при температуре опыта, мм рт. ст. (см. Справочник, Р, табл. 21).
Источник