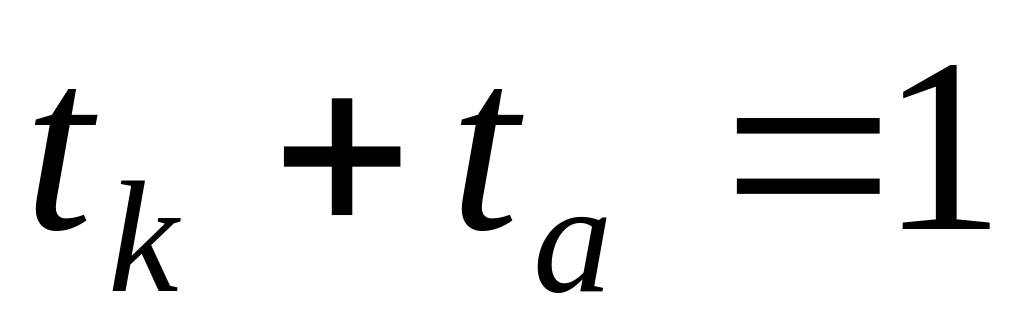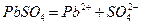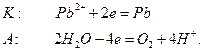Методы определения чисел переноса.
Для определения чисел переноса используют три метода.
По методу Гитторфа определяют аналитическим путем изменение количества электролита в анодном или катодном пространстве электрохимической системы при прохождении через нее постоянного тока и рассчитывают числа переноса по формуле
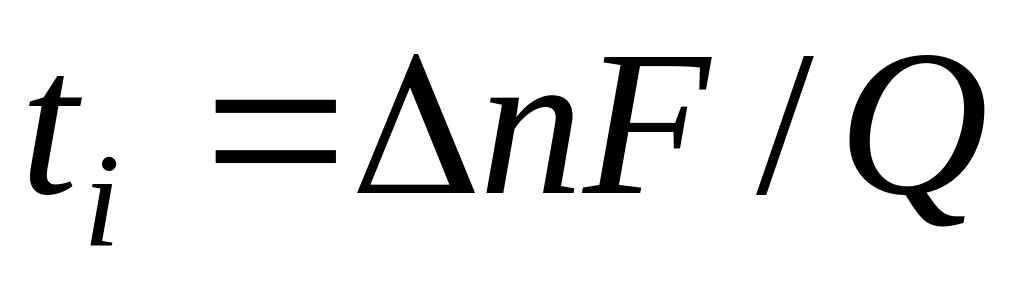
где n — изменение содержания электролита; определяемое аналитически вблизи каждого из электродов, г-экв; F— число Фарадея, Кл моль -1 ; Q — общее количество электричества, пропущенное через электрохимическую систему и определяемое кулонометрически.
В настоящее время применяют кулонометры — системы, в которых весь ток расходуется лишь на одну электрохимическую реакцию — трех типов: весовые — серебряные и медные; объемные — водородные и ртутные; титрационные — чаще других используют анодное растворение серебра (кулонометр В. А. Кистяковского) или электролитическое окисление ионов иода.
Найденные по формуле (10) числа переноса не учитывают гидратацию ионов и перенос молекул растворителя через мембраны, разделяющие приэлектродные пространства при электролизе, поэтому они называются эффективными, или кажущимися. При выборе в качестве системы отсчета растворителя в целом расчет чисел переноса (особенно для концентрированных растворов) следует проводить по уравнению
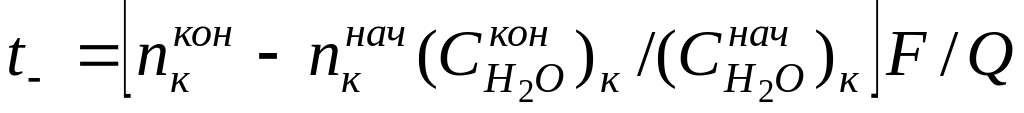
где 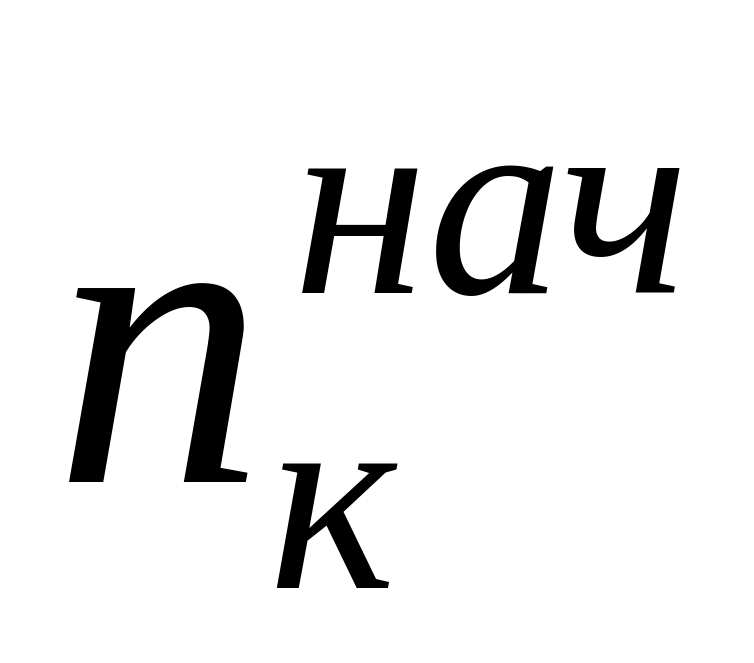
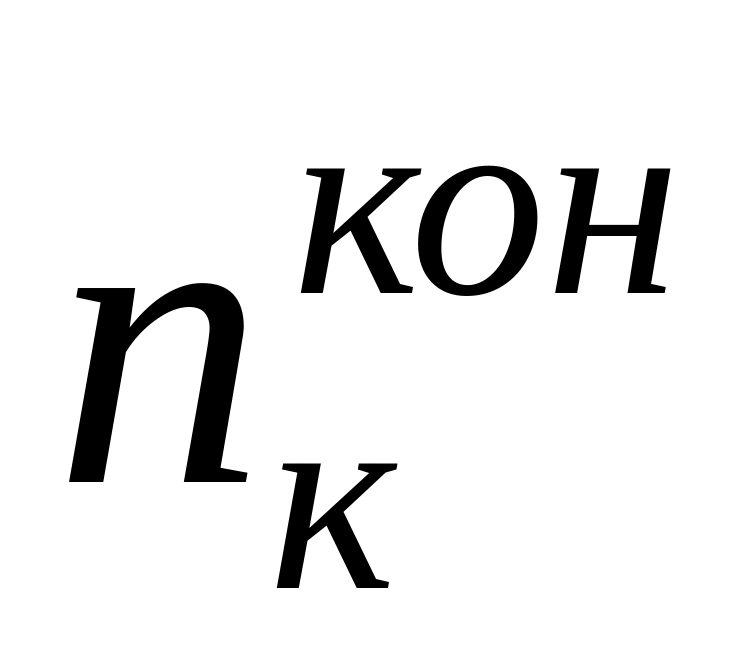
г-экв; 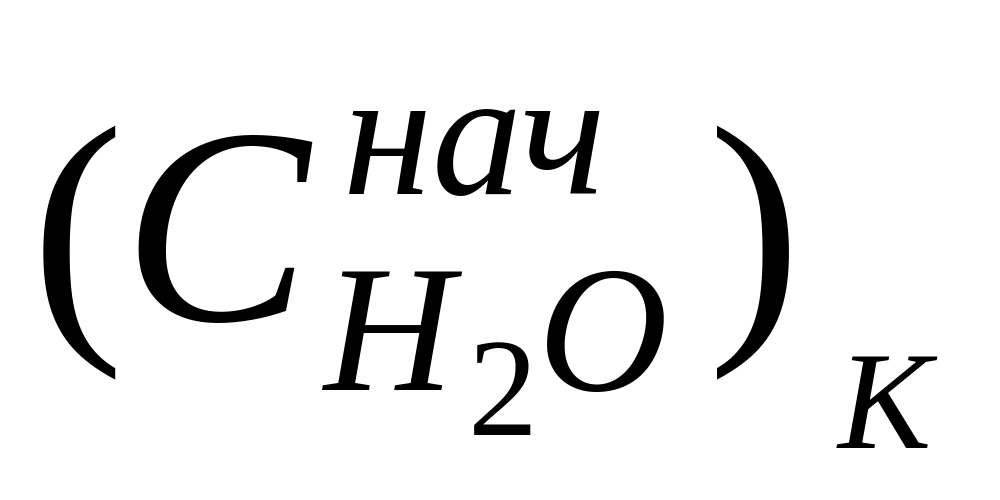
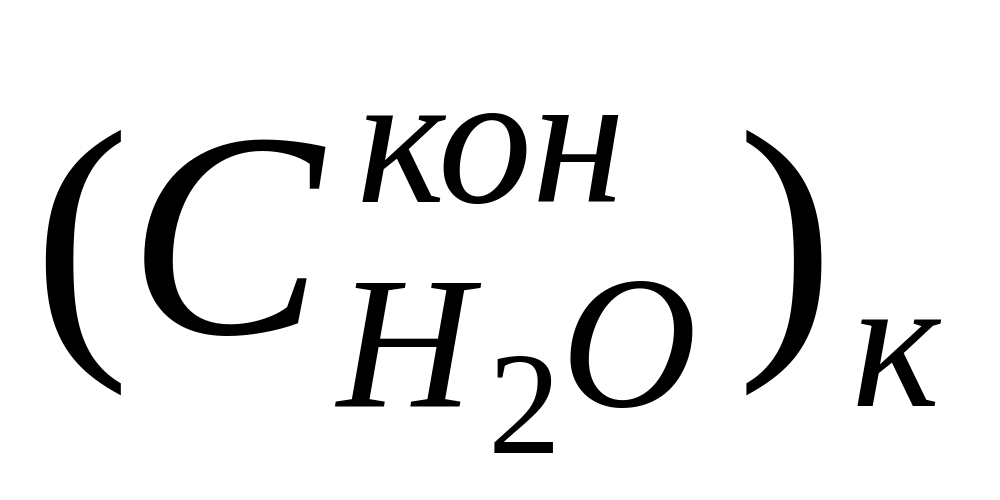
По методу движущейся границы определяют расстояние l, на которое перемещается граница между двумя окрашенными или разной плотности растворами с одним общим ионом в узкой вертикальной трубке сечением s под действием постоянной разности потенциалов за определенный промежуток времени при выполнении условий:
1) регулирующего соотношения Кольрауша (с точностью до 10%):
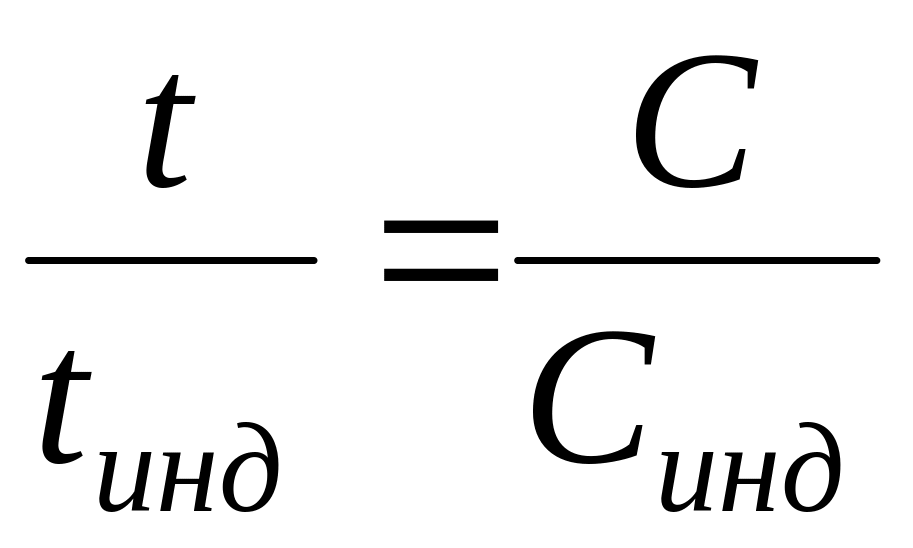
где t /tинд — числа переноса в исследуемом и индикаторном растворах; С, Синд — соответствующие концентрации;
2) число переноса индикаторного раствора меньше исследуемого, т.е. 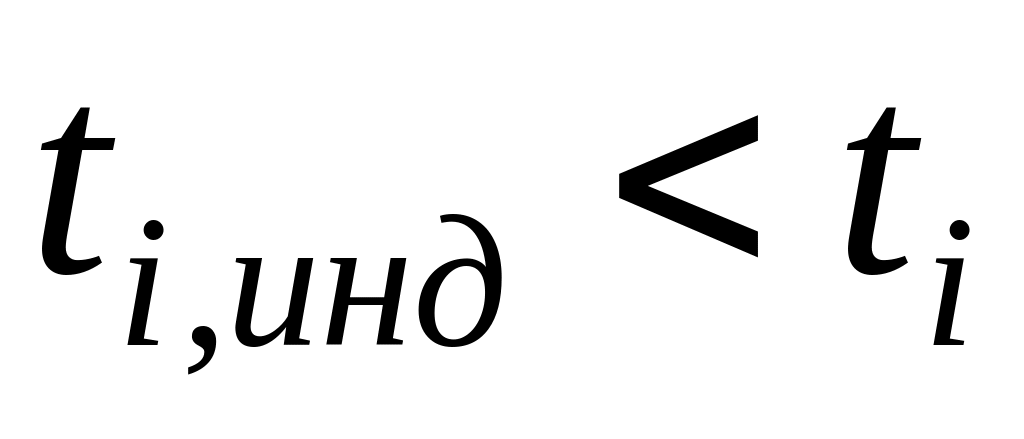
3) индикаторный раствор имеет большую, чем исследуемый, плотность и располагается в нижнем слое — сохраняется резкая граница между растворами при электролизе.
Число переноса в этом методе рассчитывают по формуле
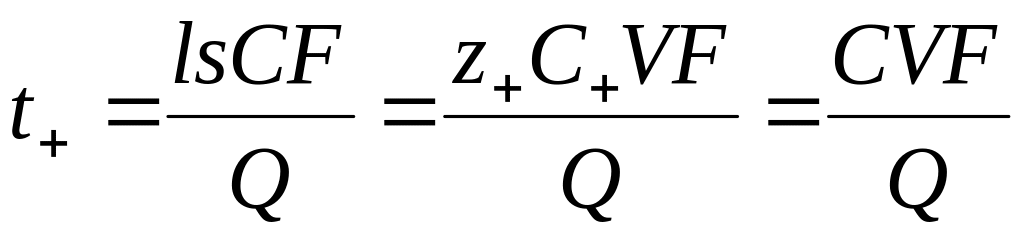
где С — концентрация исследуемого раствора; z+ — заряд иона; С+ — концентрация иона; V = ls — объем раствора, прошедшего по трубке за время . Видно, что формула (13) идентична (10). Отметим, что при выборе в качестве системы отсчета растворителя в соотношение (13) нужно ввести поправку на изменение объема V, связанное с перемещением по трубке из-за электродных реакций воды:
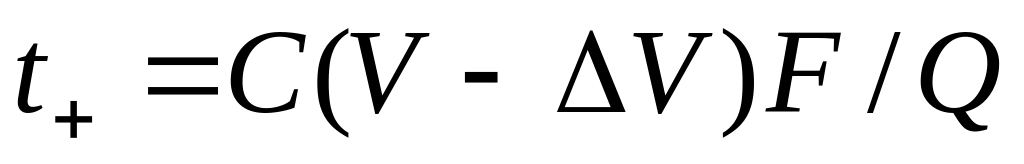
Также различают метод определения чисел переноса ионов, связанный с измерением диффузионного потенциала в концентрационных цепях с переносом.
В растворе перенос электричества осуществляется ионами, причем каждый вид ионов переносит определенное количество электричества в зависимости от содержания данных ионов в растворе, их валентности и скорости движения в электрическом поле.
Общее количество электричества е, прошедшего через раствор, складывается из количества электричества, перенесенного всеми ионами:
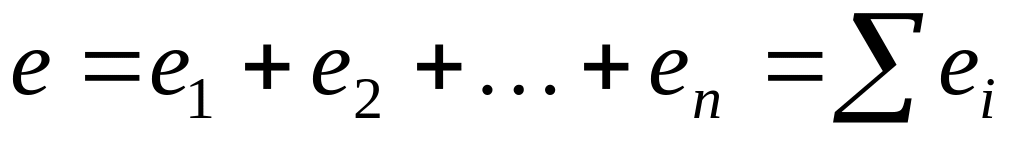
Доля количества электричества, перенесенного ионами i, называется числом переноса ti:
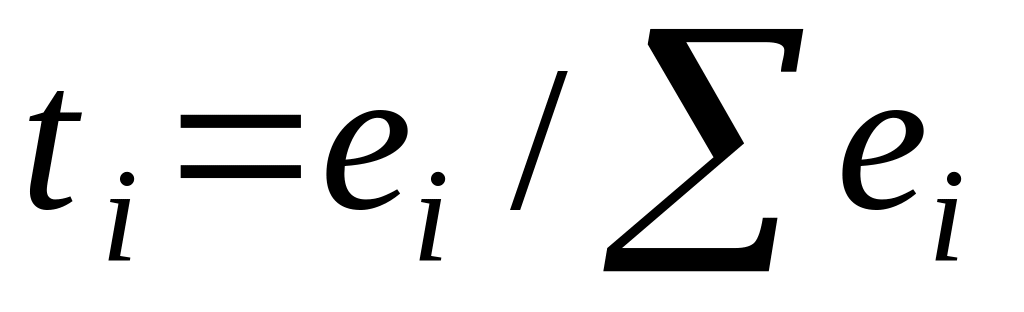
Для раствора электролита АВ, диссоциирующего по схеме
числа переноса могут быть выражены равенствами:

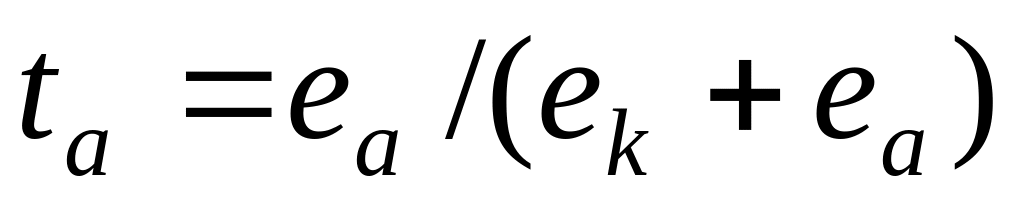
где ек и еа – количество электричества, перенесенное катионами А + и анионами В — соответственно.
Поскольку количество электричества, перенесенное ионами данного вида, пропорционально скорости их движения, то числа переноса можно определить через абсолютные скорости ионов:

Или, учитывая, что = uF , через подвижности (электропроводности) ионов:

Числа переноса зависят от подвижности всех ионов в растворе, природы растворителя, концентрации и температуры. Влияние изменения концентрации незначительно; при концентрации растворов ниже 0,2 н. числа переноса практически остаются постоянными. Благодаря этому можно легко определить значение ti при бесконечном разбавлении путем экстраполяции. Зная число переноса и эквивалентную электропроводность при бесконечном разбавлении, можно рассчитать подвижность ионов, решая уравнение:
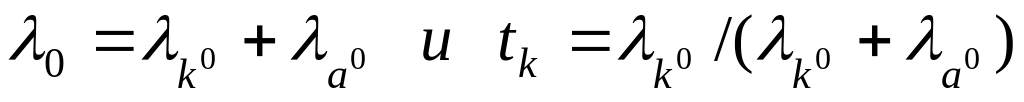
С увеличением температуры за счет неодинаковой степени дегидратации ионов А + и В — числа переноса выравниваются и стремятся к 0,5.
Установка для определения чисел переноса.
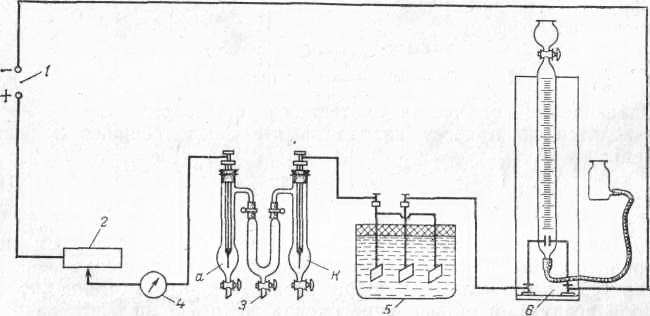
Схема лабораторной установки для определения чисел переноса показана рис. 2
Рис. 2 Схема установки для определения чисел переноса ионов:
/—источник постоянного тока; 2 — реостат; 3 — электролизер для определения чисел переноса ионов (а — анодный сосуд; к – катодный сосуд); 4 — миллиамперметр; 5 — медный кулонометр; 6 — газовый кулонометр.
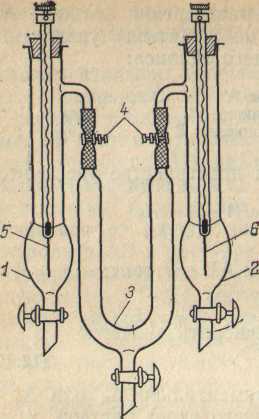
Рис. 3 Электролизер для определения чисел переноса ионов:
/ — анодный сосуд; 2 — катодный сосуд; 3 — соединительный сосуд; 4 — зажимы; 5, 6 — электроды.
Поскольку при измерении чисел переноса необходимо определять изменение содержания электролита у каждого электрода отдельно, то в электролизере 3 анодное и катодное пространство должны быть в достаточной степени разделены. Для этой цели удобно пользоваться прибором, изображенным на рис. 3.
Кулонометры. Количество протекающего через цепь электричества определяется с помощью кулонометров — приборов, основанных на электрохимическом принципе действия. Расчет количества электричества производится на основании законов электролиза Фарадея. Необходимым условием при этом является протекание на электроде одного единственного электрохимического процесса, отсутствие побочных химических реакций и механических потерь продукта, т. е. электродный процесс должен проходить с выходом по току 100%.
По методам определения количества образующихся веществ кулонометры подразделяются на весовые, объемные и титрационные.
Медный кулонометр (весовой) состоит из медных электродов — пластинок, погруженных в раствор CuSO4. На границе раздела «электрод — электролит» протекают процессы:
Сu 2+ + 2е — 
Определение количества протекающего электричества eF производится по привесу катода за счет выделившейся на нем меди:
где т — масса выделившейся меди, г; 31,77 — химический эквивалент меди.
Точность показаний кулонометра 0,1—0,5%- Основным источником погрешностей является частичное растворение медных электродов в кислом растворе, особенно в присутствии кислорода воздуха, и образование оксида меди (I) за счет реакции на катоде:
в нейтральном растворе и при малых плотностях тока, а также осаждение меди на катоде в губчатой форме при высоких плотностях тока. Для повышения точности показаний кулонометра рекомендуется в качестве электролита использовать раствор следующего состава: CuSO4*5H2O — 150 г/л; H2SO4 — 50 г/л; С2Н5ОН — 50 г/л; вести электролиз при умеренных плотностях тока на катоде в пределах от 2 до 20 мА-см -2 . В объемных кулонометрах количества выделяющихся на электродах веществ определяют измерением их объемов. Примером такого типа приборов является газовый кулонометр. Кулонометр состоит из градуированной бюретки, в нижний конец которой впаяны два платиновых электрода. Бюретку и уравнительную склянку заполняют 0,5 М раствором сульфата натрия.Для повышения точности показаний кулонометра рекомендуется перед каждым опытом насыщать раствор электролита водородом и кислородом. С этой целью собирают установку согласно рис.2, в которую включают только один газовый кулонометр (электролизер 3 и другие кулонометры не включаются) и пропускают ток 50 мА в течение 5—10 мин. Электролиз ведут при открытом кране. Затем, поднимая уравнительную склянку, заполняют газовую бюретку раствором настолько, чтобы в ней оставалось примерно 1—2 мл газа. После этого закрывают кран, уровни растворов в бюретке и склянке приводят к одной и той же высоте и отсчитывают объем V1 оставшегося в бюретке газа. Очевидно, давление газа в бюретке при этих условиях будет равно атмосферному. Аналогично определяется объем V2 газовой смеси и по окончании основного опыта. Разность V2—V1 = V будет соответствовать объему гремучей смеси, выделившейся в кулонометре за время опыта.
Количество электричества определяют по формуле:
где р — внешнее давление, мм рт. ст.; h — давление насыщенного пара воды при температуре опыта, мм рт. ст. (см. Справочник, Р, табл. 21).
Источник
Электролиз. Числа переноса



Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах. Основными элементами такой системы являются: металлические или полупроводниковые электроды (проводники первого рода) и проводники второго рода (раствор электролита, его расплав или твердый электролит).
По направлению процесса взаимного превращения электрической и химической форм энергии различают две группы электрохимических систем: электролизеры и химические источники тока.
Электрохимическая система, работающая за счет внешнего источника тока, называется электролизером.В электролизерах при электролизеза счёт внешней электрической энергии в системе происходят электрохимические превращения. На границе электрод – раствор происходит передача электронов от электрода к ионам или от ионов к электроду.
При электролизе на катоде происходит процесс восстановления (электрод отдаёт электроны, полученные от внешнего источника тока) по реакции
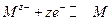
а на аноде идет процесс окисления по реакции
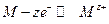
Освобождающиеся при окислении электроны поступают во внешнюю цепь.
Химические превращения при электролизе могут быть самыми различными, в зависимости от природы электролита и растворителя, а также от материала электрода и присутствия других веществ в растворе.
Количественными характеристиками процесса электролиза являются – масса полученных веществ, плотность тока, выход по току, напряжение электролиза и другие.
Масса вещества, разложившегося или образовавшегося при электролизе, прямо пропорциональна количеству пропущенного электричества этого:
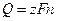
где 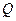
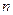
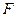
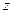
Из законов Фарадея следует, что при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны их молярным массам. Отсюда
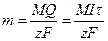
где — М – молярная масса вещества (г/моль), , 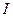
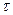
Число Фарадея является одной из основных постоянных современной физики. При пропускании через электролитическую ячейку одного фарадея электричества на аноде или на катоде в электрохимическую реакцию вступает моль/z количества вещества. Это следует из простого факта – заряд одного моля однозарядных ионов (N = 6,022 10 23 ионов) составляет 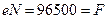
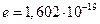
Плотность тока 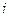
Законы Фарадея являются общими и точными законами электрохимии. Однако при электрохимических процессах часто наблюдаются отклонения от этих законов: масса mддействительно полученного или разложившегося продукта не соответствует теоретической mТ. Эти отклонения – кажущиеся и возникают за счёт одновременного протекания побочных электрохимических или химических процессов. Эффективность основного электрохимического процесса оценивается выходом по току:
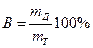
Для измерения количества прошедшего электричества используются электролизеры, в которых нет параллельных электрохимических и побочных химических реакций. Они называются кулонометрами.
По методам определения количества образующихся веществ кулонометры делятся на весовые, объемные, титрационные и др.
Например, действие серебряного кулонометра, представляющего собой электролизер
основано на взвешивании массы серебра, осевшей на катоде во время электролиза по реакции:
При пропускании одного Фарадея электричества на катоде выделяется один моль-экв. cеребра, равный 107 г.
В объемных кулонометрах определяют изменение объемов газообразных веществ, являющихся продуктами электролиза.

В титрационных кулонометрах методом титрования определяют количества вещества, образовавшегося при электролизе.
Плотность тока 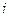
Процессы электролиза в принципе обратны процессам, протекающим на электродах при работе гальванического элемента. При электролизе сила тока, а, следовательно, и количество вещества, прореагировавшего на электродах, зависит от разности потенциалов (напряжения) на электродах. При повышении напряжения сила тока увеличивается, а при снижении, наоборот, — уменьшается. Для того, чтобы процесс электролиза протекал со значимым выходом, разность потенциалов, приложенная к электродам, должна быть не меньше некоторой определенной для данного процесса величиной.
Минимальная разность потенциалов, которую необходимо создать между электродами для того, чтобы на электродах пошел процесс электролиза с образованием электродных продуктов называется напряжением разложения. Напряжение разложения не может быть меньше, чем ЭДС гальванического элемента, в котором протекает суммарная реакция противоположного направления, чем при электролизе в электролизере.
В общем случае напряжение разложения складывается из разности электродных потенциалов анода и катода при плотности тока электролиза и падения напряжения в растворе электролита 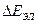
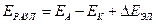
где 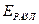
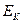
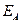
При работе электролизера происходит отклонение потенциалов электродов от равновесных значений (при отклонении потенциала электрода от равновесного через электрод протекает ток). Это явление называется поляризацией, а разность между потенциалом электрода и его равновесным значением называется перенапряжением на электродах. Перенапряжение принято считать положительной величиной. Поэтому анодное 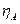
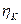
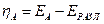
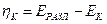
Термин перенапряжение применяется к отдельным электродным процессам и к данному процессу электролиза в целом. Перенапряжение электролиза равно сумме перенапряжений на электродах.
В водных растворах процесс электролиза осложняется возможной реакцией разложения воды: 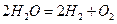
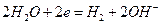
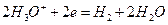
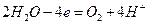
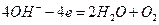
Потенциал восстановления ионов водорода в нейтральной среде равен -0,41 В, поэтому металлы с электродным потенциалом более положительным, чем эта величина (расположенные в ряду напряжений правее железа) восстанавливаются на катоде. Если электродный потенциал металла значительно отрицательнее, чем – 0,41 В, то металл не восстанавливается, а происходит восстановление воды и выделение водорода. Если электродный потенциал металла отрицательнее, но отличается от -0,41 В незначительно ( 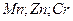
Стандартный потенциал окисления воды равен 1,23 В. У простых анионов ( 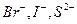
Если анод изготовлен из металлов, электродные потенциалы которых ниже чем потенциал окисления анионов соли, то происходит окисление анода. Например, электролиз раствора 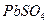
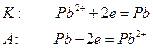
В этом случае новых веществ не образуется, а происходит перенос свинца с анода на катод.
Если в качестве анода использовать инертный электрод, например, графитовый, то на электродах будут протекать следующие реакции:
Скорости движения различных ионов в растворах электролитов отличаются друг от друга. Поэтому они при движении переносят разное количество электричества. Для оценки количества электричества, переносимого разными ионами введено понятие – число переноса. Числом переноса ионов называется доля количества электричества, переносимая данным видом ионов.
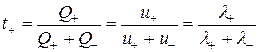
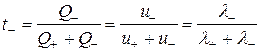
где t+ и t– – число переноса катиона и аниона.
К методам определения чисел переноса относят метод Гитторфа, основанный на определении изменения концентрации электролита в результате электролиза в катодном или анодном отделении электролизера и сопоставлении полученных результатов с данными материального баланса процесса электролиза.
Например, при пропускании через раствор соляной кислоты 1 фарадея (F = 96500 к) электричества в электролизере с платиновыми электродами (пространство между электродами разделено пористыми перегородками) будут протекать следующие электрохимические реакции:
на катоде 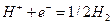
на аноде 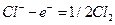
При этом через раствор от анода к катоду пройдет t+ моль катионов и от катода к аноду — t– моль анионов. Катионы перенесут t+ фарадеев электричества, а анионы — t– фарадеев. В сумме катионы и анионы перенесут t+ + t– = 1 фарадей электричества. В катодном отделении, в результате протекания реакции из раствора выделится 1 моль ионов водорода, а в анодном отделении из раствора выделится 1 моль анионов хлора. Материальный баланс катодного и анодного пространств тогда можно представить в следующем виде:
катодное пространство: 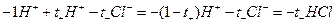
анодное пространство: 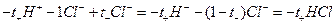
Из материального баланса следует, что при пропускании через раствор одного фарадея электричества в катодном пространстве содержание 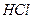
Если при пропускании через электролизер 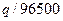
(q – количество электричества в кулонах) содержание 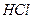
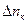
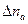
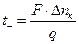
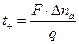
Числа переноса можно также определить, используя метод движущейся границы. Этот метод основан на измерении скорости движения ионов, которая определяется по скорости перемещения границы между двумя растворами при прохождении тока. В вертикальной трубке имеются два слоя растворов электролитов СА и МА, образующих четкую границу, которая при прохождении тока перемещается со скоростью, равной скорости движения ионов.
Числа переноса находят следующим образом. При прохождении через систему одного фарадея электричества (1F = 96500 кулонов) через каждый 1 см 2 сечения трубки должно пройти в направлении к катоду число моль-эквивалентов катионов, равное числу переноса tк. Если площадь поперечного сечения трубки равно s см 2 , а расстояние, пройденное границей за время пропускания q Кл, равно l см, то число переноса катиона равно
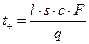
Так как q в Кл можно рассчитать, зная ток (в А) и время (в секундах) пропускания тока, то число переноса может быть вычислено по перемещению границы за время опыта.
Метод движущейся границы часто используется измерений чисел переноса вследствие его сравнительной простоты и точности получаемых результатов.
Источник