Окраска спор
Кислотоустойчивость является свойством, присущим главным образом патогенным для человека бактериям, например микобактериям, коринебактериям и актиномицетам. В то же время известно, что к роду Corynebacterium принадлежит несколько видов фитопатогенных бактерий. Поэтому выявление кислотоустойчивости у возбудителей бактериозов у растений представляет определенный интерес. Приводим один из его рецептов. Готовят мазок из культуры бактерий, высушивают и окрашивают при нагревании до появления слабых паров в течение 3–5 мин карболовым фуксином Циля. Затем промывают в водопроводной воде и обесцвечивают 95%-ным этиловым спиртом, содержащим 3%-ную по объему соляную кислоту до розового цвета. Снова промывают в водопроводной воде и докрашивают щелочным метиленовым синим Леффлера. Промывают в воде, высушивают и исследуют. Кислотоустойчивые бактерии – красные, все остальные – синие.
Споры являются защитным приспособлением бактерий при наступлении неблагоприятных условий существования. Они представляют собой круглые, овальные или элипсоидные образования, размещенные в центре, на конце или ближе к одному из концов клетки, изменяя иногда форму клетки. При наблюдении за бактериями в живом состоянии их споры можно различить по сильному преломлению света. В связи с особенностями физико-химического состава и наличием плотной малопроницаемой оболочки споры слабо окрашиваются обычными способами. Поэтому при их окраске применяют вещества, изменяющие структуру оболочки, после чего краска легче проникает и окрашивает их. Таким образом, все способы окраски спор построены на том принципе, что их сначала протравливают различными химическими веществами – аммиаком, перекисью водорода, едким натром, соляной, серной, салициловой, уксусной и хромовой кислотами, а затем окрашивают при нагревании с последующим обесцвечиванием и дополнительной окраской. Из многочисленных способов окраски спор мы приведем несколько, наиболее популярных, простых и дающих хорошие результаты.
Так как спороносные аэробные бактерии плохо или совсем не образуют спор на средах, богатых аминокислотами, в литературе приведен рецепт среды Тарр, при выращивании на которой получают положительные результаты. Среда эта следующего состава:
Источник
6.5. Окраска спор микробов
Споры имеют вид образований круглой или овальной формы, находящихся в теле микробной клетки. Различают три | вида расположения спор по отношению к длинной оси палочки: центральное – спора находится в центре тела микроба, субтерминальное – спора располагается ближе к одному из ее концов, терминальное – спора располагается на конце палочки. Диаметр споры может не превышать диаметр тела микробной клетки, вследствие чего форма палочки при спорообразовании не изменяется (бациллы). В других случаях диаметр споры больше поперечного размера микробной клетки и тело ее в месте образования споры утолщается (клостридии).
Форма, величина «расположение спор постоянны для каждого вида бацилл.
В отличие от вегетативной части клетки, споры содержат значительно меньше свободной воды и большое количество липидов и кальция. Плотная оболочка спор, непроницаемая для воды, окрашивается с большим трудом, поэтому при обычных методах окраски споры имеют вид неокрашенных пустот внутри клетки. Для окраски спор пользуются специальными методами с применением протрав (кислоты или щелочи). Протравы разрыхляют оболочку споры, облегчая проникновение в нее красителя. Окрасившиеся споры обладают кислотоустойчивостью, в отличие от вегетативного тела микробной клетки, обесцвечивающегося под действием кислоты. Поэтому принцип окраски спор и кислотоустойчивых бактерий одинаков: препарат окрашивают основным красителем, затем обесцвечивают кислотой и докрашивают дополнительно в какой-нибудь контрастный цвет.
6.5.1. Окраска спор методом Ожешко
- На высушенный нефиксированный препарат (мазок готовится толстым и на краю стекла) наливают несколько капель 0,5 % раствора хлористоводородной кислоты и подогревают 1–2 мин над пламенем горелки до закипания, после чего остатки кислоты сливают;
- остывший препарат промывают водой, подсушивают и фиксируют на пламени горелки;
- окрашивают карболовым фуксином Циля (рецепт 17) с подогреванием до появления паров;
- обесцвечивают 5 % раствором серной кислоты в течение нескольких секунд;
- промывают водой;
- докрашивают метиленовым синим Леффлера (синька Леффлера – рецепт 9) или 1 % водным раствором малахитового зеленого (рецепт 23) 3–5 мин.
Окрашенные споры имеют рубиново-красный цвет, вегетативные тела микробных клеток приобретают цвет дополнительной краски – голубой при применении метиленового синего или зеленый при использовании малахитового зеленого.
6.5.2. Окраска спор методом Пешкова
- На фиксированный мазок наливают синьку Леффлера (рецепт 9), дают краске закипеть. Окрашивание мазка происходит кипящей синькой в течение 20–30 с;
- препарат промывают водой;
- докрашивают 0,5 % водным раствором нейтральрот в течение 30–60 с (рецепт 25);
- промывают водой и высушивают.
Споры, окрашенные синькой Леффлера, имеют голубой цвет, вегетативные тела бактерий – красный цвет.
Источник
Способы окраски спор бактерий
Споры имеют вид образований округлой или овальной формы, находящихся в теле микробной клетки. Различают три вида расположения спор по отношению к длинной оси палочки: центральное — спора находится в центре тела микроба; субтерминальное — спора располагается ближе к одному из ее концов; терминальное — спора располагается на конце палочки. Диаметр споры может не превышать диаметра тела микробной клетки, и форма палочки при спорообразовании не изменяется (бациллы). В других случаях диаметр споры больше поперечного размера микробной клетки, и тело ее в месте образования споры утолщается (клостридии).
Форма, величина и расположение спор постоянны для каждого вида бацилл. В отличие от вегетативной части клетки, споры содержат значительно меньше свободной воды и большое количество липидов и кальция. Плотная оболочка спор, непроницаемая для воды, окрашивается с большим трудом, поэтому при обычных методах окраски споры имеют вид неокрашенных пустот внутри клетки. Для окраски спор пользуются специальными методами с применением протрав (кислоты или щелочи). Протравы разрыхляют оболочку споры, облегчая проникновение в нее красителя. Окрасившиеся споры обладают кислотоустойчивостью, в отличие от вегетативного тела микробной клетки, обесцвечивающегося под действием кислоты. Поэтому принцип окраски спор и кислотоустойчивых бактерий одинаков: препарат окрашивают основным красителем, затем обесцвечивают кислотой и докрашивают дополнительно в какой-нибудь контрастный цвет.
а) Окраска спор методом Ожешко:
• На высушенный нефиксированный препарат (мазок готовится толстым и на краю стекла) наливают несколько капель 0,5% раствора хлористоводородной кислоты (НСl) и подогревают 1-2 мин над пламенем горелки до закипания, после чего остатки кислоты сливают.
• Остывший препарат промывают водой, подсушивают и фиксируют над пламенем горелки.
• Окрашивают карболовым фуксином Циля с подогреванием до появления паров.
• Обесцвечивают 5% раствором серной кислоты в течение нескольких секунд.
• Промывают водой.
• Докрашивают метиленовым синим Леффлера или 1% водным раствором малахитового зеленого 3-5 мин.
Окрашенные споры имеют рубиново-красный цвет, вегетативные тела микробных клеток приобретают цвет дополнительного красителя — голубой при применении метиленового синего или зеленый при использовании малахитового зеленого.
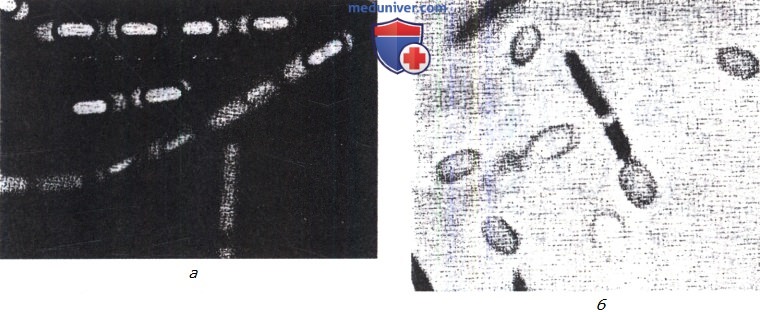
a — Bacillus cereus: удлиненные субтерминальные споры (окраска нигрозином);
б — Clostridium pectinovorum: большие терминальные споры внутри спорангиума и отдельные споры без спорангиума (окраска йодом на гранулезу).
б) Окраска спор методом Пешкова:
• На фиксированный мазок наливают метиленовый синий Леффлера, дают краске закипеть. Окрашивание мазка кипящим красителем производится в течение 20-30 с.
• Препарат промывают водой.
• Докрашивают 0,5% раствором нейтрального красного в течение 30-60 с.
• Промывают водой и высушивают.
Споры, окрашенные метиленовым синим Леффлера, имеют голубой цвет, вегетативные тела бактерий — красный.
в) Окраска спор методом Дорнера:
• Исследуемый мазок высушивают на воздухе.
• Фиксируют над пламенем горелки.
• Покрывают кусочком фильтровальной бумаги, пропитанной карболовым фуксином Циля, поддерживая влажное состояние фильтровальной бумаги добавлением красителя. Мазок подогревают над пламенем горелки 10 мин или помещают стекла на штатив, расположенный над емкостью с кипящей водой.
• Удаляют фильтровальную бумагу и наносят на мазок смесь Никифорова на 1 мин.
• Мазок промывают водопроводной водой, подсушивают фильтровальной бумагой.
• На предметное стекло с мазком наносят насыщенный раствор нигрозина (рецепт 31).
После окраски вегетативные тела остаются бесцветными, а споры приобретают красный цвет. Микробные тела находятся на черном фоне.
Редактор: Искандер Милевски. Дата публикации: 16.05.2019
Источник
Способы окраски спор бактерий
33. Простые и сложные методы окраски микроорганизмов. Способы окраски спор, жгутиков, капсул, включений.
Для окрашивания препаратов пользуются кислыми, щелочными и нейтральными анилиновыми красителями. Наиболее широкое применение нашли основной и кислый фуксин, метиленовый синий, генцианвиолет и везувин.
Простой способ окраски мазков производится водным фуксином Пфейффера и метиленовым синим Леффлера. Готовят водный фуксин из фенолового фуксина Циля, разводя его дистиллированной водой в соотношении 1:10. Состав РАСТВОРА ФУКСИНА ЦИЛЯ: основной фуксин – 1 г; спирт этиловый 96 % – 10 мл; фенол кристаллический – 5 г; глицерин – несколько капель; вода дистиллированная – 100 мл.
Метиленовый синий Леффлера готовят, прибавляя к 30 мл насыщенного раствора метиленового синего (10 г метиленового синего в 100 мл 96 % этилового спирта) 1 мл 1% NaOH или KOH и 100 мл дистиллированной воды.
После окрашивания красители сливают, препарат промывают водой и высушивают между листками фильтровальной бумаги. На сухой мазок наносят каплю масла и микроскопируют с использованием иммерсионного объектива оптического микроскопа. Способность микробов воспринимать красители называется тинкториальными свойствами.
При окраске щелочным метиленовым синим по Леффлеру (3–5 мин) гранулы волютина у дифтерийных коринебактерий приобретают темно–синий, а палочка – голубой цвет.
При сложных методах окраски мазков применяют два–три различных по цвету красителя, что позволяет дифференцировать микробы и выявить некоторые нюансы в деталях их строения. К таким методам относят окраску по Граму, Цилю–Нельсену, Нейссеру, Бурри–Гинсу, Романовскому–Гимзе и некоторые другие.
При окраске по НЕЙССЕРУ гранулы ВОЛЮТИНА у дифтерийных коринебактерий окрашиваются в сине–черный, а бактерия – в желтый цвет. Мазок окрашивают: 1) 1 мин уксуснокислым метиленовым синим (метиленовый синий – 0,1 г, спирт – 2 мл, ледяная уксусная кислота – 5 мл, дистиллированная вода – 100 мл); 2) сливают краситель и мазок промывают водой; 3) на 20– 30 с наносят раствор Люголя; 4) 1 –3 мин окрашивают везувином (прокипяченная и отфильтрованная взвесь 2 г везувина в смеси 60 мл спирта и 40 мл дистиллированной воды).
Количественное содержание ПЕПТИДОГЛИКАНА, содержащегося в # стенке, определяет характер окраски бактерий и других прокариот по ГРАМУ. Те из них, которые содержат в клеточной стенке большое его количество (около 90 % пептидогликана), окрашиваются по Граму в сине–фиолетовый цвет и их называют грамположительными, все другие, содержащие в оболочке 5–20 % пептидогликана, – в розовый цвет и их называют грамотрицательными. Толщина слоя пептидогликана в клеточной стенке грамположительных бактерий в несколько раз больше, чем у грамотрицательных. Техника окраски по Граму: 1. Фиксированный мазок 1–2 мин окрашивают раствором генцианвиолета (генцианвиолет – 1 г, этанол 96 % – 10 мл, фенол кристаллический – 2 г, вода дистиллированная – 100 мл; по методу Синева его покрывают пропитанной тем же красителем полоской фильтровальной бумаги, которую смачивают 2–3 каплями воды). 2. Слив генцианвиолет (сняв полоску бумаги Синева), мазок 1 мин обрабатывают раствором Люголя и, не промывая водой, сливают его. 3. Обесцвечивают спиртом в течение 0,5 мин, промывают водой. 4. Окрашивают 1–2 мин фуксином Пфейффера. 5. Мазок ополаскивают водой и высушивают.
Для выявления грамположительных КИСЛОТО– И СПИРТОУСТОЙЧИВЫХ микобактерий туберкулеза и лепры, которые из–за большого количества в клеточных оболочках жировосковых веществ, миколовой кислоты и других оксикислот непроницаемы для разведенных растворов красителей, используют окраску по методу ЦИЛЯ – НИЛЬСЕНА. Окрашивание их по этому способу достигается при помощи концентрированного фенолового фуксина Циля с подогреванием над пламенем горелки до закипания и отхождения паров. Окрашенные с применением термокислотной обработки микобактерии не обесцвечиваются слабыми растворами минеральных кислот и этилового спирта. Техника окраски. 1. Фиксированный мазок покрывают полоской фильтровальной бумаги, на которую наносят фуксин Циля, и несколько раз подогревают над пламенем горелки до появления паров, подливая краситель, далее бумагу снимают и промывают водой. 2. Препарат обрабатывают (обесцвечивают) 5 % раствором серной кислоты и промывают водой. 3. На мазок наливают водно–спиртовой раствор метиленового синего, спустя 3–5 мин промывают водой и высушивают. Кислотоустойчивые бактерии окрашиваются в интенсивно красный цвет, остальные виды микробов, обесцвечивающиеся в процессе обработки препарата кислотой, – в светло–синий.
При необходимости дифференциации возбудителей лепры от микобактерии туберкулеза используют окраску мазков по методу Семеновича–Марциновского – микобактерии лепры окрашиваются в красный цвет, а микобактерии туберкулеза остаются неокрашенными.
Для обнаружения КАПСУЛ бактерий, плохо воспринимающих красители, используют метод БУРРИ–ГИНСА: в каплю туши, разведенной в 10 раз водой, вносят исследуемые бактерии и равномерно распределяют их петлей по предметному стеклу; мазок высушивают, фиксируют (наносят 2–3 капли спирта и сжигают его на стекле), окрашивают в течение 3–5 мин фуксином Пфейффера, промывают водой, высушивают; на темном фоне препарата капсулы видны в виде светлых ореолов вокруг красных бактерий.
О наличии ЖГУТИКОВ чаще всего судят по направленному характеру движения бактерий в раздавленной и висячей каплях. Но можно использовать и некоторые методы окраски, например по МОРОЗОВУ: 1) обработка препарата кислотой, при этом оболочки и жгутики разрыхляются; 2) закрепление разрыхленных структур танином; 3) обработка азотнокислым серебром, оно окутывает каждый жгутик и саму # толстым слоем, давая различные оттенки от жёлтого до тёмно-коричневого.
СПОРЫ. Эндоспоры бактерий выдерживают длительное кипячение, действие горячего воздуха (140–150°С) и химических дезинфицирующих веществ, многие годы сохраняются в почве, на растительности и предметах. Попадая в организм человека и животных, споры патогенных бактерий прорастают в материнские клетки за несколько часов.
Водным фуксином, водно–спиртовым метиленовым синим и по Граму эндоспоры не окрашиваются, так как их плотная многослойная оболочка непроницаема для обычных красителей. В мазках из патологических материалов, культур бацилл и клостридии, окрашенных простыми красителями, споры выглядят в виде бесцветных телец внутри окрашенных в соответствующий цвет вегетативных клеток или вне их. Окрашивать их можно по методу Циля–Нельсена, используя для обесцвечивания мазков после обработки их фуксином Циля не 5%, а 1% серную кислоту. При этом эндоспоры, так же как микобактерии туберкулеза, красятся в розовый цвет и будут хорошо видны на синем фоне бактерий. Для окрашивания спор можно использовать метод по ОЖЕШКО: 1) протравка оболочки споры горячей кислотой; 2) окраска по Цилю–Нильсену.
При исследовании морфологии паразитов крови (спирохеты – бледная трепонема, простейшие – малярийный плазмодий), а т/же ФЭ, используют окраску по РОМАНОВСКОМУ–ГИМЗА. Краска состоит из смеси азура, эозина и метиленовой сини. Окрашивает ЦИТОПЛАЦМУ в голубой, а ЯДРА в красно–фиолетовый цвет. Этот метод позволяет обнаружить различные цитологические детали.
Мазок для люминесцентной микроскопии готовят обычным образом, фиксируют в ацетоне и наносят на него флюорохром на 20–30 мин. Сделанный препарат промывают проточной водой, покрывают покровным стеклом и микроскопируют.
Источник




