Методы разделения смесей и очистки веществ
Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ.
Методы разделения смесей и очистки веществ
1. Разделение жидкостей
Перегонка – разделение жидкостей, различающихся по температуре кипения.
 | Перегонку проводят в приборе, состоящем из колбы Вюрца (или круглодонной колбы с газоотводной трубкой), прямого холодильника, колбы-приемника, аллонжа, термометра и нагревательного прибора. Смесь жидкостей нагревают в перегонной колбе до температуры кипения каждого компонента, пары отводят в холодильник и собирают сконденсировавшуюся жидкость в приемник, отдельно каждый компонент смеси. |
Дистилляция – очистка воды от твердых примесей.
 | Загрязненную жидкость нагревают в перегонной колбе до температуры кипения, пары отводят в холодильник и собирают сконденсировавшуюся жидкость в приемник. |
2. Разделение жидкостей и твердых веществ
Фильтрование – метод разделения жидкостей и твердых веществ.
 | Фильтрованием отделяют нерастворимые твердые вещества от жидкости. |
Выпаривание – метод разделения жидкостей и твердых веществ.
 | Выпариванием отделяют воду от растворенных в ней веществ. |
Декантация – с ливание жидкости с отстоявшегося осадка. К ней целесообразно прибегать в тех случаях, когда в сравнительно большом количестве жидкости находится немного твердого вещества, которое легко оседает на дно.
3. Разделение смесей твердых веществ
| Отстаивание | Магнитная сепарация |
| Например, смесь хлорида натрия и карбоната кальция можно разделить растворением в воде и последующим отстаиванием | Например, смесь серы и железных опилок можно разделить с помощью магнита: |
Сублимация (возгонка) — очистка твердых веществ, способных при нагревании переходить непосредственно из твердой фазы в газообразную, минуя жидкую фазу. Образующийся газ конденсируется охлаждаемой частью прибора. Сублимацию обычно проводят при температуре, близкой к температуре плавления вещества. Возгонкой можно очистить йод, серу, хлорид аммония.
Перекристаллизация. При повышенной температуре готовят насыщенный раствор очищаемого вещества, затем для удаления нерастворимых примесей раствор фильтруют через воронку для горячего фильтрования и охлаждают до низкой температуры. При понижении температуры растворимость вещества понижается, и основная часть очищаемого вещества выпадает в осадок, растворимые примеси остаются в растворе.
Хроматография. Метод разделения и анализа смесей веществ, который основан на распределении веществ между двумя фазами – неподвижной (твердая фаза или жидкость, связанная на носителе) и подвижной (газовая или жидкая фаза, элюент).
Источник
Способы очистки твердых веществ
Тема. Очистка твердых веществ.
— познакомиться с основными методами очистки твердых веществ;
— очистить растворимую соль методом перекристаллизации.
— получить m г чистого K2Cr2O7, очистив дихромат аммония методом перекристаллизации.
Реактивы: дихромат калия K2Cr2O7, содержащий нерастворимые примеси и примеси растворимых хлоридов и сульфатов; раствор нитрата серебра AgNO3; раствор хлорида бария BaCl2; дистиллированная вода H2O.
Посуда и оборудование: химический стакан на 100 мл (2 шт.), мерный цилиндр на 50 мл, фарфоровая ступка с пестиком, стеклянная палочка, воронка для горячего фильтрования, химическая воронка, фильтровальная бумага, весы, термометр, электрическая плитка, асбестовая сетка, сушильный шкаф.
1. Теоретическая часть
Чаще всего для очистки твердых веществ используют два метода: очистка растворимых солей перекристаллизацией и очистка летучих веществ сублимацией.
Метод перекристаллизации основан на различной зависимости растворимости вещества и загрязняющих его примесей от температуры. Перекристаллизацию проводят следующим образом: при повышенной температуре (60 °С) готовят насыщенный раствор очищаемого вещества, полученный раствор фильтруют через воронку для горячего фильтрования для удаления нерастворимых примесей, затем раствор охлаждают. При понижении температуры растворимость вещества понижается и основная часть очищаемого вещества выпадает в осадок. Примеси остаются в растворе, поскольку полученный раствор относительно их остается ненасыщенным. Полученные кристаллы отфильтровывают. Метод позволяет очищать вещества, растворимые в воде, например: хлорид натрия, хлорид аммония, дихромат калия, сульфат меди и др.
Метод сублимации (возгонки) используется для очистки твердых веществ, способных при нагревании переходить из твердой фазы непосредственно в газовую, минуя жидкую фазу. Образующийся газ конденсируется в охлаждаемой части прибора. Возгонку проводят при температуре близкой к температуре плавления вещества. Возможна очистка только от примесей, не способных возгоняться. Метод позволяет очищать вещества, способные возгоняться, например: йод, сера, хлорид аммония и др.
2. Экспериментальная часть
Задача лабораторной работы: получить m г чистого дихромата калия методом перекристаллизации. Значение m указывается преподавателем каждому учащемуся. Перед выполнением лабораторной работы необходимо выполнить предварительные расчеты.
Предварительные расчеты (пример при m = 10 г):
Необходимо рассчитать количество соли (в г) и воды (в мл), которые потребуются для получения 10 г чистого вещества. Перекристаллизацию проводят при нагревании до 60 °С и охлаждении раствора до 20 °С.
1. Используя справочную литературу, по таблице растворимости солей при различных температурах определяем растворимость дихромата калия при 20 °С и при 60 °С. Растворимость при 20 °С составляет 11,1 г соли в 100 г раствора, при 60 °С – 31,2 г в 100 г раствора.
2. Вычислим количество соли, которое можно получить при охлаждении до 20 °С 100 г раствора, насыщенного при 60 °С: при 60 °С в насыщенном растворе содержится 31,2 г соли и 68,8 г воды (100 – 31,2), при охлаждении этого раствора до 20 °С количество воды останется неизменным – 68,8 г, а 31,2 г соли распределятся между раствором, насыщенным при 20 °С, и осадком. Определим количество соли, которое останется в растворе. При 20 °С насыщенный раствор массой 100 г содержит 11,1 г соли и 88,9 г воды. Составим пропорцию:
11,1 г соли растворятся в 88,9 г воды,
m г соли растворяется в 68,8 г воды, тогда

следовательно, в растворе останется:
Таким образом, при охлаждении до 20 °С 100 г раствора, насыщенного при 60 °С, содержащего 31,2 г соли и 68,8 г воды, образуется 22,6 г осадка (чистой соли).
3. Вычислим количество соли и воды, необходимых для получения 10 г чистой соли. Составим пропорции:
если взять 31,2 г соли, образуется 22,6 г осадка,
если взять m1 г соли, образуется 10 г осадка, тогда

если взять 68,8 г воды, образуется 22,6 г осадка,
если взять m2 г воды, образуется 10 г осадка, тогда

Вычислим объем воды. Плотность воды равна 1 г/мл, следовательно:

Таким образом, для получения 10 г чистой соли необходимо взять 13,8 г дихромата калия и 30,4 мл воды. К массе соли добавим 10 %, учитывая массу содержащихся примесей:
m (соли) = 13,8 + 0,1 · 13,8 = 15,2 (г).
Порядок выполнения работы
1. Наливаем в стакан отмеренное мерным цилиндром рассчитанное количество воды.
2. Взвешиваем на весах рассчитанное количество соли.
3. Растираем соль в фарфоровой ступке.
4. Помещаем растертую соль в стакан с водой и нагреваем раствор почти до кипения на электрической плитке с асбестовой сеткой, перемешивая стеклянной палочкой.
5. Полученный раствор отфильтровываем через складчатый фильтр, используя воронку для горячего фильтрования для удаления нерастворимых примесей.
6. Охлаждаем полученный раствор до 20 °С.
7. Выпавшие кристаллы отфильтровываем через предварительно взвешенный фильтр.
8. Несколько кристалликов полученной соли растворяем в 2 мл дистиллированной воды и добавляем 1–2 капли раствора нитрата серебра для определения наличия хлоридов.
9. Несколько кристалликов полученной соли растворяем в 2 мл дистиллированной воды и добавляем 1–2 капли раствора хлорида бария для определения наличия сульфатов.
10. Если образуются осадки хлорида серебра и/или сульфата бария, то проводим повторную перекристаллизацию, предварительно рассчитав количество воды, необходимое для приготовления насыщенного при 60 °С раствора, содержащего полученную массу соли.
11. Перекристаллизованный чистый дихромат калия на фильтре помещаем в фарфоровую чашку и высушиваем в сушильном шкафу при 60 °С до постоянной массы (взвешивание проводим каждые 15–20 минут, если после 2 взвешиваний масса не изменилась, то соль высушена).
12. Определяем массу полученной соли, отняв из массы соли с фильтром массу фильтра.
13. Рассчитываем практический выход:
Выход должен составлять не менее 80 %.
Делаем общий вывод по работе.
Отчет по лабораторной работе должен содержать:
1) дату выполнения работы;
4) список необходимых реактивов;
5) список необходимой посуды и оборудования;
6) предварительный расчет, в соответствии с заданием;
7) порядок выполнения работы с указанием всех результатов (массы исходной соли, объема взятой воды, температуры проведения опыта, массы фильтра, массы полученной соли, запись уравнений реакций, протекающих при определении хлоридов и сульфатов, практический выход);
Источник
4.1 Очистка твердых веществ
Очистка твердых веществ от примесей является частным случаем более общей задачи – разделения твердых смесей органических соединений. Применяются различные методы разделения и очистки твердых смесей, выбор метода определяется свойствами веществ, подвергаемых разделению или очистки, характером примесей, степенью требуемой чистоты, а также экономичностью метода.
Очистка и разделение твердых веществ могут осуществляться с помощью различных видов перегонки (простая перегонка, вакуум перегонка, перегонка с водяным паром), а также возгонки. Органические соединения, принадлежащие к различным классам, обладают разной растворимостью. Это свойство используется для очистки и разделения органических веществ путем кристаллизации, в частности дробной кристаллизации.
4.1.1 Кристаллизация
Кристаллизация – это процесс образования и роста кристаллов из раствора, расплава или газовой фазы. Кристаллизация или перекристаллизация представляет собой процесс, при котором твердое вещество растворяют при нагревании в определенном растворителе, отфильтровывают горячий раствор от нерастворимых примесей и затем путем охлаждения выкристаллизовывают основное вещество, выпавшие кристаллы отфильтровывают. Определение температуры плавления и контроль хроматографическими методами (например, ТСХ – тонкослойная хроматография – см. п.4.4.3) позволяет при этом легко оценить чистоту полученного вещества.
Для получения чистого вещества перекристаллизацию повторяют несколько раз до получения вещества с постоянной температурой плавления, т.е. не меняющейся при последующей кристаллизации.
В результате перекристаллизации, по сравнению с другими способами очистки твердых веществ, получается наиболее чистый продукт, но в то же время, она сопряжена с относительно большими потерями вещества в маточнике. Поэтому в тех случаях, когда перед химиком стоит задача получить наибольший выход продукта, следует использовать другие методы очистки — перегонку при обычном или пониженном давлении, перегонку с водяным паром и др . Иногда подобные перегонки дают возможность произвести предварительную очистку.
Основным оборудованием для проведения кристаллизации является: круглодонная колба; обратный холодильник; баня с соответствующим теплоносителем.
Метод перекристаллизации из раствора основан на том, что растворимость твердых соединений в горячих растворителях намного выше, чем в холодных, а так же на различии растворимости веществ в одном и том же растворителе. Поэтому, выбор растворителя имеет важное значение.
Растворитель, применяемый для очистки твердого вещества перекристаллизацией, должен удовлетворять следующим основным требованиям:
∙ хорошо растворять примеси . Очистка дает тем лучшие результаты, чем больше разница в растворимости очищаемого вещества и примесей;
∙ очищаемое вещество должно плохо растворятся в выбранном растворителе на холоду . В противном случае потери вещества в маточ-
ном растворе будут велики;
∙ растворимость очищаемого вещества должна резко возрастать
с повышением температуры;
∙ растворитель не должен реагировать с кристаллизуемым веще-
ством , должен способствовать образованию устойчивых кристаллов и легко удаляться с поверхности кристаллов при отмывании и высушивании;
∙ температура кипения растворителя должна быть ниже температуры плавления вещества , которое необходимо перекристаллизовать, как минимум на 30 ºС. При нарушении такого интервала температур вещество, как правило, выделяется в виде масла.
Температура для наилучшего образования зародышей кристаллов лежит приблизительно на 100 ºС выше, а для наилучшего роста кристаллов на 50 ºС ниже температуры плавления кристаллизующегося соединения.
В тех случаях, когда в литературе отсутствуют данные о растворимости, выбор растворителя производится опытным путем, при этом следует учитывать известную зависимость между строением растворяемого вещества и растворителя: «подобное растворяется в подобном». Например, углеводороды обычно хорошо растворяются в углеводородных растворителях (бензол, толуол, четыреххлористый углерод и т.д.), соединения, содержащие гидроксильные группы (низшие спирты, фенолы, карбоновые кислоты и другие вещества) легко растворяются в воде и спирте. В более общем виде, это правило выглядит так: полярные соединения растворимы в полярных растворителях, таких как вода, спирты, кетоны, кислоты, и значительно менее растворимы в неполярных растворителях, таких как бензол, четыреххлористый углерод и т.д.
Это правило верно только для веществ простого строения, для сложных соединений оно не всегда соблюдается. На растворимость вещества оказывает влияние в этих случаях наличие разных функциональных групп, их число, величина молекулярного веса и другие факторы. Окончательный выбор растворителя можно произвести только опытным путем.
Проведение подбора растворителя для перекристаллизации
Кончиком шпателя берут пробу вещества, помещают ее в пробирку и прибавляют некоторое количество растворителя. Если вещество растворяется уже на холоду, то данный растворитель непригоден для перекристаллизации. Если вещество на холоду растворяется плохо или совсем не растворяется, то пробирку нагревают до кипения на нагретой водяной бане (при температуре кипения растворителя меньше 100 ºС) или на электроплитке, если растворителем является вода. В случае необходимости добавляют в пробирку еще немного растворителя, чтобы добиться полного растворения вещества.
Если вещество кристаллизуется при охлаждении горячего насыщенного раствора, либо, наоборот, нерастворимо или мало растворимо даже при нагревании, то данный растворитель непригоден для целей перекристаллизации.
Если после охлаждения пробирки из раствора выпадут кристаллы, то растворитель пригоден для проведения кристаллизации. Более точным критерием пригодности растворителя служит температура плавления образовавшихся кристаллов. Если температура плавления кристаллизуемого вещества известна, то температура плавления выпавших из подбираемого растворителя кристаллов должна си ней совпадать. Если температура плавления вещества неизвестна, то критерием пригодности
растворителя служит постоянство температур плавления кристаллов при повторных кристаллизациях.
В качестве растворителей при кристаллизации наиболее часто применяются вода, этиловый и метиловый спирты, ацетон, петролейный эфир, хлороформ, ледяная уксусная кислота, этилацетат, толуол, ксилол.
При использовании легколетучих растворителей (диэтиловый эфир, спирт, ацетон и др.), растворение следует вести очень осторожно . Находящиеся поблизости нагревательные приборы или источники открытого огня должны быть потушены и выключены.
В тех случаях, когда не удается подобрать индивидуальный растворитель для перекристаллизации, применяют смеси, состоящие из двух, а иногда и трех растворителей. Для этого вещество растворяют в том растворителе, в котором оно растворяется очень легко, и к полученному раствору по каплям добавляют горячий растворитель, плохо растворяющий данное вещество, до тех пор, пока не образуется устойчивое помутнение. Эту смесь нагревают до получения прозрачного раствора и оставляют для кристаллизации. Растворители, применяемые совместно, должны смешиваться друг с другом во всех отношениях. В большинстве случаев применяют следующие смеси: спирт–вода, спирт– бензол, спирт–ледяная уксусная кислота, ацетон–вода, эфир–ацетон– бензол, хлороформ–петролейный эфир и т.д.
После проведения кристаллизации кристаллы отфильтровывают, сушат и взвешивают. Низкий выход очищаемого вещества указывает на то, что используемый растворитель не был идеальным или его было взято слишком много. В таких случаях из фильтрата (маточного раствора) можно дополнительно выделить кристаллы после удаления избытка растворителя на роторном испарителе и охлаждении оставшегося раствора. Как правило, эти последующие порции вещества менее чистые, чем выделенные ранее.
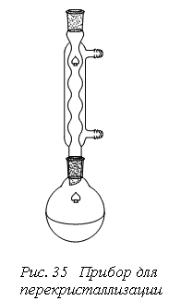
Для проведения перекристаллизации в колбу, снабженную обратным холодильником помещают небольшое количество рабочего вещества (рис. 35). Во избежание перегрева жидкости и толчков при кипячении раствора, в колбу перед нагреванием вносят «кипелки».
После этого в колбу вливают растворитель в несколько меньшем объеме, чем это необходимо для полного растворения вещества, и нагревают смесь до кипения. Нагревание ведут на водяной бане, за исключением тех случаев, когда работают с высококипящими растворителями. Затем через обратный холодильник осторожно добавляют такое количество растворителя, которое необходимо для полного растворения всего вещества при кипячении. Для обесцвечивания раствора от окрашенных примесей (если это необходимо) к реакционной смеси добавляют активированный уголь в количестве 1-2 % от количества очищаемого вещества. Раствор кипятят в течение нескольких минут с активированным углем до обесцвечивания, а затем еще горячий раствор фильтруют от угля.
После того как все механические примеси будут удалены фильтрованием, горячий прозрачный раствор либо оставляют в колбе для медленного охлаждения, либо быстро охлаждают, поместив колбу в холодную воду со льдом или снег. При быстром охлаждении получаются мелкие кристаллы, а при медленном – крупные .
Некоторые вещества очень трудно кристаллизуются даже при охлаждении. Это явление чаще всего связано с очень медленным ростом кристаллов или очень медленным образованием центров кристаллизации.
При этом используют два приема :
1. Введение «затравки». Этот приём заключается в том, что в раствор вносят кристаллы того же вещества (затравку), т.е. искусственно создают центры кристаллизации. Если чистого вещества нет, можно смочить раствором стеклянную палочку и резко охладить её, поместив в пустую охлаждаемую снаружи пробирку. В тонкой плёнке жидкости на поверхности стеклянной палочки образуются кристаллы.
2. Трение стеклянной палочкой о стенки сосуда. Для этого берут неоплавленную стеклянную палочку, вносят её в раствор и осторожно потирают о стенки сосуда. При этом образуется мелкая стеклянная пыль, отдельные пылинки могут оказаться подходящими центрами кристаллизации. Кристаллизация всегда начинается от стенок и от поверхности к центру, на твёрдых поверхностях или на границе раздела фаз. Электрическое и магнитное поля, ультразвук, иногда сильное охлаждение (например, в жидком азоте) – все это способствуют процессу кристаллизации.
Кристаллизация считается законченной, когда дальнейшее выпадение кристаллов не наблюдается. Образовавшиеся кристаллы отделяют от маточного раствора фильтрованием под вакуумом. На воронке Бюхнера полученные кристаллы дважды промывают соответствующим хо-
Источник