- 7.3.2. Очистка растворов
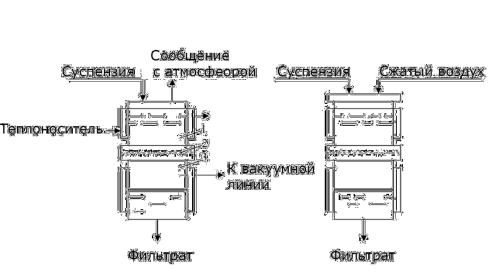
- 7.3.3. Устройство и принцип действия аппаратов для фильтрования
- Медицинские растворы заводского производства. Интенсификация процесса растворения. Способы очистки
- Общая характеристика медицинских растворов. Изучение правил выбора растворителя, способов очистки. Контроль качества раствора натрия бромида 6,0, магния сульфата 6,0, глюкозы 25,0, воды очищенной до 100,0 мл. Оценка физиологического состава новокаина.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- Медицинские растворы заводского производства. Интенсификация процесса растворения. Способы очистки
- О главление
- Введение
- Глава 1. Общая характеристика медицинских растворов 1.1 Характеристика и классификация растворов 1.2 Интенсификация процесса растворения 1.3 Способы очистки Глава 2. Э кспериментальная часть 2.1 Контроль качества раствора натрия бромида 6,0, магния сульфата 6,0, глюкозы 25,0, воды очищенной до 100,0 мл 2.2 Контроль качества раствора новокаина (физиологический) состав: Новокаина 0,5, раствора кислоты хлороводородной 0,1 моль/л 0,4 мл, натрия хлорида 0,81, воды для инъекций до 100,0 мл Выводы Список использованной литературы Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами: — благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями; — жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения; — в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.); — данные лекарственные формы просты и удобны для применения; — в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике; — при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме; — мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств. Вместе с тем, жидкие лекарства имеют ряд недостатков: — они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны; — растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток; — ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке; — жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями. Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно. Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ. Целью и задачами данной работы является изучение медицинского раствора заводского производства. Глава 1 . Общая характеристика медицинских растворов Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах. Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта. Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы. Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор. Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др. При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов. Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами. Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода). Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной. Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений. С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно. Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается. Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества: 1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя. 2. Легкорастворимые — от 1 до 10 частей растворителя. 3. Растворимые — от 10 до 20 частей растворителя. 4. Труднорастворимые — от 30 до 100 частей растворителя. 5. Малорастворимые — от 100 до 1000 частей растворителя. 6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя. 7. Практически нерастворимые — более чем 10 000 частей растворителя. Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция). Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси. Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы. — Водные. Solutiones aquosae seu Liquores. — Спиртовые. Solutiones spirituosae. — Глицериновые. Solutiones glycerinatae. — Масляные. Solutiones oleosae seu olea medicata. По агрегатному состоянию растворимых в них лекарственных веществ: — Растворы твердых веществ. — Растворы жидких веществ. — Растворы с газообразными лекарственными средствами. 1.2 Интенсификация процесса растворения 1.3 Способы очистки Фильтрование — процесс разделения гетерогенных систем с твердой дисперсной фазой при помощи пористой перегородки, которая пропускает жидкость (фильтрат) и задерживает взвешенные твердые частицы (осадок). Процесс этот осуществляется не только за счет задерживания частиц, крупнее диаметра капилляров перегородки, но и за счет адсорбции частиц пористой перегородкой, и за счет слоя образовавшегося осадка ( шламовый тип фильтрования). Движение жидкости через пористую фильтрующую перегородку имеет, в основном, ламинарный характер. Если допустить, что капилляры перегородки имеют круглое сечение и одинаковую длину, то зависимость объема фильтрата от различных факторов подчиняется закону Пуазеля: F- поверхность фильтра, мІ; z- число капилляров на 1 мІ; r- средний радиус капилляров, м; ДP- разность давлений по обе стороны фильтрующей перегородки (или перепад давлении на концах капилляров), н/мІ; ф- длительность фильтрования, сек; ?- абсолютная вязкость жидкой фазы в н/с·мІ; l-средняя длина капилляров, мІ; б- поправочный коэффициент на кривизну капилляров; Q- объем фильтрата, мі. Иначе, объем профильтрованной жидкости прямо пропорционален поверхности фильтра (F), пористости (r,z), перепаду давлений (ДР), длительности фильтрования (ф) и обратно пропорционален вязкости жидкости, толщине фильтрующей перегородки и кривизны капилляров. Из уравнения Пуазеля выводится уравнение скорости фильтрования (V), которая определяется количеством жидкости, прошедшей через единицу поверхности за единицу времени. После преобразования уравнения Пуазеля оно приобретает вид: V = ДP/Rосадка + Rперегородки где R — сопротивление движению жидкости. Из этого уравнения следует ряд практических рекомендаций для рационального проведения процесса фильтрования. А именно, для увеличения разности давлений над и под перегородкой создают либо повышенное давление над фильтрующей перегородкой, либо разрежение под ней. Отделение твердых частиц от жидкости при помощи фильтровальной перегородки является сложным процессом. Для такого отделения нет необходимости применять перегородку с порами, средний размер которых меньше среднего размера твердых частиц. Установлено, что твердые частицы успешно задерживаются порами большего размера, чем средний размер задерживаемых частиц. Твердые частицы, увлекаемые потоком жидкости к фильтровальной перегородке, попадают в различные условия. Наиболее простой случай, когда частица задерживается на поверхности перегородки, имея размер больше, чем начальное сечение пор. Если размер частицы меньше размера капилляра в самом узком сечение, то: — частица может пройти через перегородку вместе с фильтратом; — частица может задержаться внутри перегородки в результате адсорбции на стенках поры; — частица может задержаться за счет механического торможения на месте извилины поры. Мутность фильтра в начале фильтрования объясняется прониканием твердых частиц через поры фильтровальной перегородки. Фильтрат становится прозрачным, когда перегородка приобретает достаточную задерживающую способность. Таким образом, фильтрование происходит по двум механизмам: — за счет образования осадка, так как твердые частицы почти не проникают внутрь пор и остаются на поверхности перегородки (шламовый тип фильтрования); — за счет закупоривания пор (закупорочный тип фильтрования); при этом осадок почти не образуется, так как частицы задерживаются внутри пор. На практике эти два типа фильтрования сочетаются (смешанный тип фильтрования). Факторы, влияющие на объем фильтрата и, следовательно, на скорость фильтрования разделяются на: Гидродинамические факторы — это пористость фильтрующей перегородки, площадь её поверхности, разность давлений по обе стороны перегородки и другие факторы, учитывающиеся в уравнение Пуазеля. Физико-химические факторы — это степень коагуляции или пептизации взвешенных частиц; содержание в твердой фазе смолистых, коллоидных примесей; влияние двойного электрического слоя, возникающего на границе твердой и жидкой фаз; наличие сольватной оболочки вокруг твердых частиц и т.д. Влияние физико-химических факторов, тесно связанных с поверхностными явлениями на границе раздела фаз, становится заметно при небольших размерах твердых частиц, что как раз и наблюдается в фармацевтических растворах, подлежащих фильтрованию. В зависимости от размера удаляемых частиц и цели фильтрования различают следующие методы фильтрования: 1. Грубая фильтрация — для отделения частиц размером 50 мкм и более; 2. Тонкая фильтрация — обеспечивает удаление частиц размером 1-50 мкм. 3. Стерильная фильтрация (микрофильтрация) применяется ля удаления частиц и микробов размеров 5-0,05 мкм. В этой разновидности иногда выделяют ультрафильтрацию для удаления пирогенов и других частиц размером 0,1-0,001 мкм. Речь о стерильной фильтрации пойдет в теме: «Инъекционные лекарственные формы». Все аппараты для фильтрования в промышленности называются фильтрами; основная рабочая часть их — фильтровальные перегородки. Фильтры, работающие под разрежением — нутч-фильтры. Нутч — фильтры удобны в тех случаях, когда необходимо получить чистые промытые осадки. Нецелесообразно применять эти фильтры для жидкостей со слизистыми осадками, эфирные и спиртовые извлечения и растворы, так как эфир и этанол при разрежении быстрее испаряются, отсасываются в вакуумную линию и попадают в атмосферу. Фильтры, работающие под избыточным давлением — друк-фильтры. Перепад давлений значительно больше, чем в нутч-фильтрах и может составлять от 2 до 12 атм. Эти фильтры простые по устройству, высоко производительны, позволяют фильтровать вязкие, легколетучие и с большим удельным сопротивлением осадка жидкости. Однако для выгрузки осадка необходимо снимать верхнюю часть фильтра и собирать его вручную. Рамный фильтр — пресс состоит из ряда чередующихся пустотелых рам и плит, имеющих с обеих сторон рифления и желоба. Каждые рама и плита разделены фильтровальной тканью. Число рам и плит подбирают, исходя из производительности, количества и назначения осадка, в пределах 10-60 шт. Фильтрование проводят под давлением 12 атм. Фильтр-прессы обладают высокой производительностью, в них получают хорошо промытые осадки и осветленный фильтрат, имеют все преимущества друк-фильтров. Однако для фильтрования следует применять очень прочные материалы. Фильтр-«Грибок» может работать и под вакуумом и при избыточном давлении. Фильтровальная установка состоит из емкости для фильтруемой жидкости; фильтра «Грибок» в виде воронки, на которую закрепляется фильтрующая ткань (вата, марля, бумага, бельтинг и др.); ресивера, сборника фильтрата, вакуумного насоса. Таким образом, фильтрование является важным в технологическом смысле процессом. Оно используется или самостоятельно, или может быть неотъемлемой частью схемы производства такой фармацевтической продукции как растворы, экстракционные препараты, очищенные осадки и др. Качество указанной продукции зависит от правильно подобранных аппаратов для фильтрования, фильтровальных материалов, скорости фильтрования, соотношения твердой и жидкой фаз, структуры твердой фазы и ее поверхностных свойств. Источник
- 1.1 Характеристика и классификация растворов
- 1.2 Интенсификация процесса растворения
- 1.3 Способы очистки
- Глава 2. Э кспериментальная часть 2.1 Контроль качества раствора натрия бромида 6,0, магния сульфата 6,0, глюкозы 25,0, воды очищенной до 100,0 мл 2.2 Контроль качества раствора новокаина (физиологический) состав: Новокаина 0,5, раствора кислоты хлороводородной 0,1 моль/л 0,4 мл, натрия хлорида 0,81, воды для инъекций до 100,0 мл Выводы Список использованной литературы Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами: — благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями; — жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения; — в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.); — данные лекарственные формы просты и удобны для применения; — в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике; — при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме; — мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств. Вместе с тем, жидкие лекарства имеют ряд недостатков: — они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны; — растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток; — ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке; — жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями. Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно. Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ. Целью и задачами данной работы является изучение медицинского раствора заводского производства. Глава 1 . Общая характеристика медицинских растворов Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах. Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта. Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы. Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор. Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др. При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов. Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами. Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода). Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной. Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений. С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно. Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается. Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества: 1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя. 2. Легкорастворимые — от 1 до 10 частей растворителя. 3. Растворимые — от 10 до 20 частей растворителя. 4. Труднорастворимые — от 30 до 100 частей растворителя. 5. Малорастворимые — от 100 до 1000 частей растворителя. 6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя. 7. Практически нерастворимые — более чем 10 000 частей растворителя. Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция). Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси. Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы. — Водные. Solutiones aquosae seu Liquores. — Спиртовые. Solutiones spirituosae. — Глицериновые. Solutiones glycerinatae. — Масляные. Solutiones oleosae seu olea medicata. По агрегатному состоянию растворимых в них лекарственных веществ: — Растворы твердых веществ. — Растворы жидких веществ. — Растворы с газообразными лекарственными средствами. 1.2 Интенсификация процесса растворения 1.3 Способы очистки Фильтрование — процесс разделения гетерогенных систем с твердой дисперсной фазой при помощи пористой перегородки, которая пропускает жидкость (фильтрат) и задерживает взвешенные твердые частицы (осадок). Процесс этот осуществляется не только за счет задерживания частиц, крупнее диаметра капилляров перегородки, но и за счет адсорбции частиц пористой перегородкой, и за счет слоя образовавшегося осадка ( шламовый тип фильтрования). Движение жидкости через пористую фильтрующую перегородку имеет, в основном, ламинарный характер. Если допустить, что капилляры перегородки имеют круглое сечение и одинаковую длину, то зависимость объема фильтрата от различных факторов подчиняется закону Пуазеля: F- поверхность фильтра, мІ; z- число капилляров на 1 мІ; r- средний радиус капилляров, м; ДP- разность давлений по обе стороны фильтрующей перегородки (или перепад давлении на концах капилляров), н/мІ; ф- длительность фильтрования, сек; ?- абсолютная вязкость жидкой фазы в н/с·мІ; l-средняя длина капилляров, мІ; б- поправочный коэффициент на кривизну капилляров; Q- объем фильтрата, мі. Иначе, объем профильтрованной жидкости прямо пропорционален поверхности фильтра (F), пористости (r,z), перепаду давлений (ДР), длительности фильтрования (ф) и обратно пропорционален вязкости жидкости, толщине фильтрующей перегородки и кривизны капилляров. Из уравнения Пуазеля выводится уравнение скорости фильтрования (V), которая определяется количеством жидкости, прошедшей через единицу поверхности за единицу времени. После преобразования уравнения Пуазеля оно приобретает вид: V = ДP/Rосадка + Rперегородки где R — сопротивление движению жидкости. Из этого уравнения следует ряд практических рекомендаций для рационального проведения процесса фильтрования. А именно, для увеличения разности давлений над и под перегородкой создают либо повышенное давление над фильтрующей перегородкой, либо разрежение под ней. Отделение твердых частиц от жидкости при помощи фильтровальной перегородки является сложным процессом. Для такого отделения нет необходимости применять перегородку с порами, средний размер которых меньше среднего размера твердых частиц. Установлено, что твердые частицы успешно задерживаются порами большего размера, чем средний размер задерживаемых частиц. Твердые частицы, увлекаемые потоком жидкости к фильтровальной перегородке, попадают в различные условия. Наиболее простой случай, когда частица задерживается на поверхности перегородки, имея размер больше, чем начальное сечение пор. Если размер частицы меньше размера капилляра в самом узком сечение, то: — частица может пройти через перегородку вместе с фильтратом; — частица может задержаться внутри перегородки в результате адсорбции на стенках поры; — частица может задержаться за счет механического торможения на месте извилины поры. Мутность фильтра в начале фильтрования объясняется прониканием твердых частиц через поры фильтровальной перегородки. Фильтрат становится прозрачным, когда перегородка приобретает достаточную задерживающую способность. Таким образом, фильтрование происходит по двум механизмам: — за счет образования осадка, так как твердые частицы почти не проникают внутрь пор и остаются на поверхности перегородки (шламовый тип фильтрования); — за счет закупоривания пор (закупорочный тип фильтрования); при этом осадок почти не образуется, так как частицы задерживаются внутри пор. На практике эти два типа фильтрования сочетаются (смешанный тип фильтрования). Факторы, влияющие на объем фильтрата и, следовательно, на скорость фильтрования разделяются на: Гидродинамические факторы — это пористость фильтрующей перегородки, площадь её поверхности, разность давлений по обе стороны перегородки и другие факторы, учитывающиеся в уравнение Пуазеля. Физико-химические факторы — это степень коагуляции или пептизации взвешенных частиц; содержание в твердой фазе смолистых, коллоидных примесей; влияние двойного электрического слоя, возникающего на границе твердой и жидкой фаз; наличие сольватной оболочки вокруг твердых частиц и т.д. Влияние физико-химических факторов, тесно связанных с поверхностными явлениями на границе раздела фаз, становится заметно при небольших размерах твердых частиц, что как раз и наблюдается в фармацевтических растворах, подлежащих фильтрованию. В зависимости от размера удаляемых частиц и цели фильтрования различают следующие методы фильтрования: 1. Грубая фильтрация — для отделения частиц размером 50 мкм и более; 2. Тонкая фильтрация — обеспечивает удаление частиц размером 1-50 мкм. 3. Стерильная фильтрация (микрофильтрация) применяется ля удаления частиц и микробов размеров 5-0,05 мкм. В этой разновидности иногда выделяют ультрафильтрацию для удаления пирогенов и других частиц размером 0,1-0,001 мкм. Речь о стерильной фильтрации пойдет в теме: «Инъекционные лекарственные формы». Все аппараты для фильтрования в промышленности называются фильтрами; основная рабочая часть их — фильтровальные перегородки. Фильтры, работающие под разрежением — нутч-фильтры. Нутч — фильтры удобны в тех случаях, когда необходимо получить чистые промытые осадки. Нецелесообразно применять эти фильтры для жидкостей со слизистыми осадками, эфирные и спиртовые извлечения и растворы, так как эфир и этанол при разрежении быстрее испаряются, отсасываются в вакуумную линию и попадают в атмосферу. Фильтры, работающие под избыточным давлением — друк-фильтры. Перепад давлений значительно больше, чем в нутч-фильтрах и может составлять от 2 до 12 атм. Эти фильтры простые по устройству, высоко производительны, позволяют фильтровать вязкие, легколетучие и с большим удельным сопротивлением осадка жидкости. Однако для выгрузки осадка необходимо снимать верхнюю часть фильтра и собирать его вручную. Рамный фильтр — пресс состоит из ряда чередующихся пустотелых рам и плит, имеющих с обеих сторон рифления и желоба. Каждые рама и плита разделены фильтровальной тканью. Число рам и плит подбирают, исходя из производительности, количества и назначения осадка, в пределах 10-60 шт. Фильтрование проводят под давлением 12 атм. Фильтр-прессы обладают высокой производительностью, в них получают хорошо промытые осадки и осветленный фильтрат, имеют все преимущества друк-фильтров. Однако для фильтрования следует применять очень прочные материалы. Фильтр-«Грибок» может работать и под вакуумом и при избыточном давлении. Фильтровальная установка состоит из емкости для фильтруемой жидкости; фильтра «Грибок» в виде воронки, на которую закрепляется фильтрующая ткань (вата, марля, бумага, бельтинг и др.); ресивера, сборника фильтрата, вакуумного насоса. Таким образом, фильтрование является важным в технологическом смысле процессом. Оно используется или самостоятельно, или может быть неотъемлемой частью схемы производства такой фармацевтической продукции как растворы, экстракционные препараты, очищенные осадки и др. Качество указанной продукции зависит от правильно подобранных аппаратов для фильтрования, фильтровальных материалов, скорости фильтрования, соотношения твердой и жидкой фаз, структуры твердой фазы и ее поверхностных свойств. Источник
- 2.1 Контроль качества раствора натрия бромида 6,0, магния сульфата 6,0, глюкозы 25,0, воды очищенной до 100,0 мл 2.2 Контроль качества раствора новокаина (физиологический) состав: Новокаина 0,5, раствора кислоты хлороводородной 0,1 моль/л 0,4 мл, натрия хлорида 0,81, воды для инъекций до 100,0 мл Выводы Список использованной литературы Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами: — благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями; — жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения; — в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.); — данные лекарственные формы просты и удобны для применения; — в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике; — при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме; — мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств. Вместе с тем, жидкие лекарства имеют ряд недостатков: — они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны; — растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток; — ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке; — жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями. Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно. Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ. Целью и задачами данной работы является изучение медицинского раствора заводского производства. Глава 1 . Общая характеристика медицинских растворов Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах. Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта. Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы. Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор. Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др. При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов. Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами. Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода). Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной. Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений. С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно. Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается. Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества: 1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя. 2. Легкорастворимые — от 1 до 10 частей растворителя. 3. Растворимые — от 10 до 20 частей растворителя. 4. Труднорастворимые — от 30 до 100 частей растворителя. 5. Малорастворимые — от 100 до 1000 частей растворителя. 6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя. 7. Практически нерастворимые — более чем 10 000 частей растворителя. Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция). Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси. Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы. — Водные. Solutiones aquosae seu Liquores. — Спиртовые. Solutiones spirituosae. — Глицериновые. Solutiones glycerinatae. — Масляные. Solutiones oleosae seu olea medicata. По агрегатному состоянию растворимых в них лекарственных веществ: — Растворы твердых веществ. — Растворы жидких веществ. — Растворы с газообразными лекарственными средствами. 1.2 Интенсификация процесса растворения 1.3 Способы очистки Фильтрование — процесс разделения гетерогенных систем с твердой дисперсной фазой при помощи пористой перегородки, которая пропускает жидкость (фильтрат) и задерживает взвешенные твердые частицы (осадок). Процесс этот осуществляется не только за счет задерживания частиц, крупнее диаметра капилляров перегородки, но и за счет адсорбции частиц пористой перегородкой, и за счет слоя образовавшегося осадка ( шламовый тип фильтрования). Движение жидкости через пористую фильтрующую перегородку имеет, в основном, ламинарный характер. Если допустить, что капилляры перегородки имеют круглое сечение и одинаковую длину, то зависимость объема фильтрата от различных факторов подчиняется закону Пуазеля: F- поверхность фильтра, мІ; z- число капилляров на 1 мІ; r- средний радиус капилляров, м; ДP- разность давлений по обе стороны фильтрующей перегородки (или перепад давлении на концах капилляров), н/мІ; ф- длительность фильтрования, сек; ?- абсолютная вязкость жидкой фазы в н/с·мІ; l-средняя длина капилляров, мІ; б- поправочный коэффициент на кривизну капилляров; Q- объем фильтрата, мі. Иначе, объем профильтрованной жидкости прямо пропорционален поверхности фильтра (F), пористости (r,z), перепаду давлений (ДР), длительности фильтрования (ф) и обратно пропорционален вязкости жидкости, толщине фильтрующей перегородки и кривизны капилляров. Из уравнения Пуазеля выводится уравнение скорости фильтрования (V), которая определяется количеством жидкости, прошедшей через единицу поверхности за единицу времени. После преобразования уравнения Пуазеля оно приобретает вид: V = ДP/Rосадка + Rперегородки где R — сопротивление движению жидкости. Из этого уравнения следует ряд практических рекомендаций для рационального проведения процесса фильтрования. А именно, для увеличения разности давлений над и под перегородкой создают либо повышенное давление над фильтрующей перегородкой, либо разрежение под ней. Отделение твердых частиц от жидкости при помощи фильтровальной перегородки является сложным процессом. Для такого отделения нет необходимости применять перегородку с порами, средний размер которых меньше среднего размера твердых частиц. Установлено, что твердые частицы успешно задерживаются порами большего размера, чем средний размер задерживаемых частиц. Твердые частицы, увлекаемые потоком жидкости к фильтровальной перегородке, попадают в различные условия. Наиболее простой случай, когда частица задерживается на поверхности перегородки, имея размер больше, чем начальное сечение пор. Если размер частицы меньше размера капилляра в самом узком сечение, то: — частица может пройти через перегородку вместе с фильтратом; — частица может задержаться внутри перегородки в результате адсорбции на стенках поры; — частица может задержаться за счет механического торможения на месте извилины поры. Мутность фильтра в начале фильтрования объясняется прониканием твердых частиц через поры фильтровальной перегородки. Фильтрат становится прозрачным, когда перегородка приобретает достаточную задерживающую способность. Таким образом, фильтрование происходит по двум механизмам: — за счет образования осадка, так как твердые частицы почти не проникают внутрь пор и остаются на поверхности перегородки (шламовый тип фильтрования); — за счет закупоривания пор (закупорочный тип фильтрования); при этом осадок почти не образуется, так как частицы задерживаются внутри пор. На практике эти два типа фильтрования сочетаются (смешанный тип фильтрования). Факторы, влияющие на объем фильтрата и, следовательно, на скорость фильтрования разделяются на: Гидродинамические факторы — это пористость фильтрующей перегородки, площадь её поверхности, разность давлений по обе стороны перегородки и другие факторы, учитывающиеся в уравнение Пуазеля. Физико-химические факторы — это степень коагуляции или пептизации взвешенных частиц; содержание в твердой фазе смолистых, коллоидных примесей; влияние двойного электрического слоя, возникающего на границе твердой и жидкой фаз; наличие сольватной оболочки вокруг твердых частиц и т.д. Влияние физико-химических факторов, тесно связанных с поверхностными явлениями на границе раздела фаз, становится заметно при небольших размерах твердых частиц, что как раз и наблюдается в фармацевтических растворах, подлежащих фильтрованию. В зависимости от размера удаляемых частиц и цели фильтрования различают следующие методы фильтрования: 1. Грубая фильтрация — для отделения частиц размером 50 мкм и более; 2. Тонкая фильтрация — обеспечивает удаление частиц размером 1-50 мкм. 3. Стерильная фильтрация (микрофильтрация) применяется ля удаления частиц и микробов размеров 5-0,05 мкм. В этой разновидности иногда выделяют ультрафильтрацию для удаления пирогенов и других частиц размером 0,1-0,001 мкм. Речь о стерильной фильтрации пойдет в теме: «Инъекционные лекарственные формы». Все аппараты для фильтрования в промышленности называются фильтрами; основная рабочая часть их — фильтровальные перегородки. Фильтры, работающие под разрежением — нутч-фильтры. Нутч — фильтры удобны в тех случаях, когда необходимо получить чистые промытые осадки. Нецелесообразно применять эти фильтры для жидкостей со слизистыми осадками, эфирные и спиртовые извлечения и растворы, так как эфир и этанол при разрежении быстрее испаряются, отсасываются в вакуумную линию и попадают в атмосферу. Фильтры, работающие под избыточным давлением — друк-фильтры. Перепад давлений значительно больше, чем в нутч-фильтрах и может составлять от 2 до 12 атм. Эти фильтры простые по устройству, высоко производительны, позволяют фильтровать вязкие, легколетучие и с большим удельным сопротивлением осадка жидкости. Однако для выгрузки осадка необходимо снимать верхнюю часть фильтра и собирать его вручную. Рамный фильтр — пресс состоит из ряда чередующихся пустотелых рам и плит, имеющих с обеих сторон рифления и желоба. Каждые рама и плита разделены фильтровальной тканью. Число рам и плит подбирают, исходя из производительности, количества и назначения осадка, в пределах 10-60 шт. Фильтрование проводят под давлением 12 атм. Фильтр-прессы обладают высокой производительностью, в них получают хорошо промытые осадки и осветленный фильтрат, имеют все преимущества друк-фильтров. Однако для фильтрования следует применять очень прочные материалы. Фильтр-«Грибок» может работать и под вакуумом и при избыточном давлении. Фильтровальная установка состоит из емкости для фильтруемой жидкости; фильтра «Грибок» в виде воронки, на которую закрепляется фильтрующая ткань (вата, марля, бумага, бельтинг и др.); ресивера, сборника фильтрата, вакуумного насоса. Таким образом, фильтрование является важным в технологическом смысле процессом. Оно используется или самостоятельно, или может быть неотъемлемой частью схемы производства такой фармацевтической продукции как растворы, экстракционные препараты, очищенные осадки и др. Качество указанной продукции зависит от правильно подобранных аппаратов для фильтрования, фильтровальных материалов, скорости фильтрования, соотношения твердой и жидкой фаз, структуры твердой фазы и ее поверхностных свойств. Источник
- 2.2 Контроль качества раствора новокаина (физиологический) состав: Новокаина 0,5, раствора кислоты хлороводородной 0,1 моль/л 0,4 мл, натрия хлорида 0,81, воды для инъекций до 100,0 мл
- Выводы
- Список использованной литературы Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами: — благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями; — жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения; — в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.); — данные лекарственные формы просты и удобны для применения; — в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике; — при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме; — мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств. Вместе с тем, жидкие лекарства имеют ряд недостатков: — они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны; — растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток; — ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке; — жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями. Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно. Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ. Целью и задачами данной работы является изучение медицинского раствора заводского производства. Глава 1 . Общая характеристика медицинских растворов Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах. Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта. Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы. Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор. Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др. При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов. Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами. Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода). Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной. Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений. С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно. Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается. Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества: 1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя. 2. Легкорастворимые — от 1 до 10 частей растворителя. 3. Растворимые — от 10 до 20 частей растворителя. 4. Труднорастворимые — от 30 до 100 частей растворителя. 5. Малорастворимые — от 100 до 1000 частей растворителя. 6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя. 7. Практически нерастворимые — более чем 10 000 частей растворителя. Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция). Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси. Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы. — Водные. Solutiones aquosae seu Liquores. — Спиртовые. Solutiones spirituosae. — Глицериновые. Solutiones glycerinatae. — Масляные. Solutiones oleosae seu olea medicata. По агрегатному состоянию растворимых в них лекарственных веществ: — Растворы твердых веществ. — Растворы жидких веществ. — Растворы с газообразными лекарственными средствами. 1.2 Интенсификация процесса растворения 1.3 Способы очистки Фильтрование — процесс разделения гетерогенных систем с твердой дисперсной фазой при помощи пористой перегородки, которая пропускает жидкость (фильтрат) и задерживает взвешенные твердые частицы (осадок). Процесс этот осуществляется не только за счет задерживания частиц, крупнее диаметра капилляров перегородки, но и за счет адсорбции частиц пористой перегородкой, и за счет слоя образовавшегося осадка ( шламовый тип фильтрования). Движение жидкости через пористую фильтрующую перегородку имеет, в основном, ламинарный характер. Если допустить, что капилляры перегородки имеют круглое сечение и одинаковую длину, то зависимость объема фильтрата от различных факторов подчиняется закону Пуазеля: F- поверхность фильтра, мІ; z- число капилляров на 1 мІ; r- средний радиус капилляров, м; ДP- разность давлений по обе стороны фильтрующей перегородки (или перепад давлении на концах капилляров), н/мІ; ф- длительность фильтрования, сек; ?- абсолютная вязкость жидкой фазы в н/с·мІ; l-средняя длина капилляров, мІ; б- поправочный коэффициент на кривизну капилляров; Q- объем фильтрата, мі. Иначе, объем профильтрованной жидкости прямо пропорционален поверхности фильтра (F), пористости (r,z), перепаду давлений (ДР), длительности фильтрования (ф) и обратно пропорционален вязкости жидкости, толщине фильтрующей перегородки и кривизны капилляров. Из уравнения Пуазеля выводится уравнение скорости фильтрования (V), которая определяется количеством жидкости, прошедшей через единицу поверхности за единицу времени. После преобразования уравнения Пуазеля оно приобретает вид: V = ДP/Rосадка + Rперегородки где R — сопротивление движению жидкости. Из этого уравнения следует ряд практических рекомендаций для рационального проведения процесса фильтрования. А именно, для увеличения разности давлений над и под перегородкой создают либо повышенное давление над фильтрующей перегородкой, либо разрежение под ней. Отделение твердых частиц от жидкости при помощи фильтровальной перегородки является сложным процессом. Для такого отделения нет необходимости применять перегородку с порами, средний размер которых меньше среднего размера твердых частиц. Установлено, что твердые частицы успешно задерживаются порами большего размера, чем средний размер задерживаемых частиц. Твердые частицы, увлекаемые потоком жидкости к фильтровальной перегородке, попадают в различные условия. Наиболее простой случай, когда частица задерживается на поверхности перегородки, имея размер больше, чем начальное сечение пор. Если размер частицы меньше размера капилляра в самом узком сечение, то: — частица может пройти через перегородку вместе с фильтратом; — частица может задержаться внутри перегородки в результате адсорбции на стенках поры; — частица может задержаться за счет механического торможения на месте извилины поры. Мутность фильтра в начале фильтрования объясняется прониканием твердых частиц через поры фильтровальной перегородки. Фильтрат становится прозрачным, когда перегородка приобретает достаточную задерживающую способность. Таким образом, фильтрование происходит по двум механизмам: — за счет образования осадка, так как твердые частицы почти не проникают внутрь пор и остаются на поверхности перегородки (шламовый тип фильтрования); — за счет закупоривания пор (закупорочный тип фильтрования); при этом осадок почти не образуется, так как частицы задерживаются внутри пор. На практике эти два типа фильтрования сочетаются (смешанный тип фильтрования). Факторы, влияющие на объем фильтрата и, следовательно, на скорость фильтрования разделяются на: Гидродинамические факторы — это пористость фильтрующей перегородки, площадь её поверхности, разность давлений по обе стороны перегородки и другие факторы, учитывающиеся в уравнение Пуазеля. Физико-химические факторы — это степень коагуляции или пептизации взвешенных частиц; содержание в твердой фазе смолистых, коллоидных примесей; влияние двойного электрического слоя, возникающего на границе твердой и жидкой фаз; наличие сольватной оболочки вокруг твердых частиц и т.д. Влияние физико-химических факторов, тесно связанных с поверхностными явлениями на границе раздела фаз, становится заметно при небольших размерах твердых частиц, что как раз и наблюдается в фармацевтических растворах, подлежащих фильтрованию. В зависимости от размера удаляемых частиц и цели фильтрования различают следующие методы фильтрования: 1. Грубая фильтрация — для отделения частиц размером 50 мкм и более; 2. Тонкая фильтрация — обеспечивает удаление частиц размером 1-50 мкм. 3. Стерильная фильтрация (микрофильтрация) применяется ля удаления частиц и микробов размеров 5-0,05 мкм. В этой разновидности иногда выделяют ультрафильтрацию для удаления пирогенов и других частиц размером 0,1-0,001 мкм. Речь о стерильной фильтрации пойдет в теме: «Инъекционные лекарственные формы». Все аппараты для фильтрования в промышленности называются фильтрами; основная рабочая часть их — фильтровальные перегородки. Фильтры, работающие под разрежением — нутч-фильтры. Нутч — фильтры удобны в тех случаях, когда необходимо получить чистые промытые осадки. Нецелесообразно применять эти фильтры для жидкостей со слизистыми осадками, эфирные и спиртовые извлечения и растворы, так как эфир и этанол при разрежении быстрее испаряются, отсасываются в вакуумную линию и попадают в атмосферу. Фильтры, работающие под избыточным давлением — друк-фильтры. Перепад давлений значительно больше, чем в нутч-фильтрах и может составлять от 2 до 12 атм. Эти фильтры простые по устройству, высоко производительны, позволяют фильтровать вязкие, легколетучие и с большим удельным сопротивлением осадка жидкости. Однако для выгрузки осадка необходимо снимать верхнюю часть фильтра и собирать его вручную. Рамный фильтр — пресс состоит из ряда чередующихся пустотелых рам и плит, имеющих с обеих сторон рифления и желоба. Каждые рама и плита разделены фильтровальной тканью. Число рам и плит подбирают, исходя из производительности, количества и назначения осадка, в пределах 10-60 шт. Фильтрование проводят под давлением 12 атм. Фильтр-прессы обладают высокой производительностью, в них получают хорошо промытые осадки и осветленный фильтрат, имеют все преимущества друк-фильтров. Однако для фильтрования следует применять очень прочные материалы. Фильтр-«Грибок» может работать и под вакуумом и при избыточном давлении. Фильтровальная установка состоит из емкости для фильтруемой жидкости; фильтра «Грибок» в виде воронки, на которую закрепляется фильтрующая ткань (вата, марля, бумага, бельтинг и др.); ресивера, сборника фильтрата, вакуумного насоса. Таким образом, фильтрование является важным в технологическом смысле процессом. Оно используется или самостоятельно, или может быть неотъемлемой частью схемы производства такой фармацевтической продукции как растворы, экстракционные препараты, очищенные осадки и др. Качество указанной продукции зависит от правильно подобранных аппаратов для фильтрования, фильтровальных материалов, скорости фильтрования, соотношения твердой и жидкой фаз, структуры твердой фазы и ее поверхностных свойств. Источник
- Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами:
- — благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями;
- — жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения;
- — в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.);
- — данные лекарственные формы просты и удобны для применения;
- — в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике;
- — при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме;
- — мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств.
- Вместе с тем, жидкие лекарства имеют ряд недостатков:
- — они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны;
- — растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток;
- — ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке;
- — жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями.
- Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно.
- Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ.
- Целью и задачами данной работы является изучение медицинского раствора заводского производства.
- Глава 1 . Общая характеристика медицинских растворов
- Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах.
- Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта.
- Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы.
- Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор.
- Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др.
- При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов.
- Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами.
- Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода).
- Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной.
- Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений.
- С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно.
- Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается.
- Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества:
- 1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя.
- 2. Легкорастворимые — от 1 до 10 частей растворителя.
- 3. Растворимые — от 10 до 20 частей растворителя.
- 4. Труднорастворимые — от 30 до 100 частей растворителя.
- 5. Малорастворимые — от 100 до 1000 частей растворителя.
- 6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя.
- 7. Практически нерастворимые — более чем 10 000 частей растворителя.
- Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция).
- Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси.
- Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы.
- — Водные. Solutiones aquosae seu Liquores.
- — Спиртовые. Solutiones spirituosae.
- — Глицериновые. Solutiones glycerinatae.
- — Масляные. Solutiones oleosae seu olea medicata.
- По агрегатному состоянию растворимых в них лекарственных веществ:
- — Растворы твердых веществ.
- — Растворы жидких веществ.
- — Растворы с газообразными лекарственными средствами.
- 1.2 Интенсификация процесса растворения
- 1.3 Способы очистки
7.3.2. Очистка растворов
Очистка гомогенных систем от механических примесей обычно осуществляется фильтрованием с помощью пористых перегородок, пропускающих жидкость и задерживающих твердые частицы. Движущей силой процесса фильтрования является разность давлений по обе стороны фильтровальной перегородки, которая соответствует сопротивлению, встречаемому потоком фильтрата при его прохождении через образующийся слой осадка и фильтровальную перегородку. Эта разность давлений может создаваться различными способами:
─ массой столба жидкости;
─ нагнетанием жидкостными насосами;
─ избыточным давлением сжатого газа;
─ вакуумированием пpостpанства под фильтрующей пеpегоpодкой;
─ при помощи центробежной силы.
Если допустить, что давление жидкости в порах перегородки является ламинарным и что жидкость проходит через большое число капилляров одинакового сечения и длины, то зависимость между отдельными факторами, влияющими на процесс фильтрования, может быть выражена уравнением Пуазейля:
где V – объем вытекающей жидкости, м 3 ; F – поверхность фильтра, м 2 ;
z – число капилляров на 1 м 2 ;
ФАРМАЦЕВТИЧЕСКИЕ РАСТВОРЫ. КАПЛИ. СИРОПЫ
r – средний радиус капилляров, м;
∆ P – разность давлений по обе стороны фильтрующей пеpегоpодки,
τ – время фильтрования, с;
η – абсолютная вязкость фильтрата, H с/м 2 ; l – средняя длина капилляров, м.
Из уравнения Пуазейля легко вывести скорость фильтрования. Знаменатель правой части уравнения выражает сопротивление, оказываемое фильтром прохождению жидкости, которое является суммой сопротивления осадка и фильтрующего материала. Обычно сопротивление последнего невелико по сравнению с сопротивлением осадка и им можно пренебречь. Таким образом, скорость фильтрования , т.е. количество фильтрата на единицу площади в единицу времени, прямо пропорционально разности давления и обратно пропорционально сопротивлению осадка.
Среди множества факторов, влияющих на процесс фильтрования, можно выделить следующие: свойства фильтровальной перегородки (площадь поверхности, сжимаемость, количество и длина капилляров и др.);разность давления по обе стороны фильтра; характеристики твердых компонентов фильтруемой системы (концентрация и размер частиц, их сжимаемость и т.д.); сопротивление фильтрующей перегородки прохождению фильтрата; сопротивление осадка на фильтре прохождению фильтрата; вязкость фильтрата; температура.
Важнейшей частью любого фильтра является фильтровальная перегородка, которая должна задерживать твердые частицы и легко отделяться от них, обладать достаточной механической прочностью, низким гидравлическим сопротивлением и химической стойкостью. Она не должна изменять физико-химические свойства фильтрата, обеспечивать возможность регенерации, быть доступной и дешевой.
Выбор фильтрующих пеpегоpодок обуславливается физико-химическими свойствами фильтруемой взвеси (pаствоpяющая способность жидкой фазы, летучесть, вязкость, pH среды, и др.), концентрацией и дисперсностью твердой фазы, требованиями к качеству фильтрата, масштабами производства и т.д.
В зависимости от дисперсной твердой фазы, химической агрессивности и вязкости жидкой среды применяются фильтровальные перегородки из металлических, асбестовых, стеклянных, хлопчатобумажных, шерстяных и полимерных
ФАРМАЦЕВТИЧЕСКИЕ РАСТВОРЫ. КАПЛИ. СИРОПЫ
волокон и сеток, а также из нетканых материалов. Длительным сроком службы отличаются пористые керамические, металлические и металлокерамические плитки, получаемые спеканием калиброванных частиц между собой или в присутствии связующих веществ. Существенным недостатком этих перегородок является трудность удаления мелких частиц, проникших в поры.
По структуре все фильтрующие материалы можно разделить на: тканые (натурального и синтетического происхождения) и нетканые .
Тканые материалы , в свою очередь, подразделяются на:
1. Натуральные хлопчатобумажные (бельтинг, полотно, холст, саржа, марля и т.д.) с размером пор от 2,9 до 55 мкм.
2. Натуральные шерстяные (различные виды сукна).
3. Натуральные шелковые ткани.
4. Синтетические ткани из полихлорвинилового, полиамидного, лавсанового и тефлонового волокна.
5. Ткани из неорганических волокон.
К нетканым фильтрующим материалам относят:
1. Фильтровальную бумагу марки АФБ-1 с размерами пор 8-12 мкм, АФБ- 5 с порами 5-7 мкм, БФМ – с порами 5-10 мкм.
2. В эту группу входят также фильтры из перхлорвинила ФПП-20С, из фторсодержащих волокон Ф-42, пористая нержавеющая сталь марки ПHС-5 в виде ленты с порами 7-13 мкм, фильтрующая нержавеющая сталь марки ФНС с размерами пор 3-8 мкм.
3. Намывные или наносные слои (зернистые порошки кизельгура, фильтроперлита, глины белой, угля активированного, целлюлозы, кристаллы сульфата кальция и т.д.).
Фильтровальные материалы перед употреблением должны быть обязательно промыты до полного удаления растворимых веществ, твердых частиц или волокон.
Большую роль в процессе фильтрации играют природа и структура осадка
и фильтровальной перегородки. От этих факторов зависит их порозность, способность сохранять форму и размер пор в процессе фильтрования. Под действием перепада давлений осадки, особенно состоящие из очень мелких частиц, становятся сжимаемыми. Процесс еще больше осложняется при большой степени полидисперсности твердой фазы вследствие отложения мелких частиц в просве-
ФАРМАЦЕВТИЧЕСКИЕ РАСТВОРЫ. КАПЛИ. СИРОПЫ
тах между более крупными. Заметим, что несжимаемыми являются осадки монодисперсные и состоящие из не очень мелких частиц. Большинство реальных осадков обладает свойством сжимаемости, степень которой увеличивается с уменьшением размера частиц. Сжимаемой может оказаться и фильтровальная пеpегоpодка. В связи с этим при теоретическом анализе различают процессы фильтрования при наличии несжимаемых и сжимаемых осадков и перегородок.
В случае тонкодисперсных суспензий, а также легко дефоpмиpующихся твердых частиц закупорку пор фильтровальной пеpегоpодки и самого осадка часто можно пpедотвpатить путем добавления вспомогательных веществ (в количестве 0,1-0,5, а иногда и до 2%) или определенного расположения слоя последних на пеpегоpодке. Эти вещества (диатомит, перлит, асбест, древесный уголь, силикагель, кизельгур, глина белая, порошок целлюлозы и др.) образуют как бы каркас, препятствующий закупориванию пор. Если добавляемые вещества обладают адсорбционными свойствами (например, силикагель, активированный уголь), то они часто способны задерживать твердые частицы размером до 0,01 мкм. Используемые вещества должны быть, разумеется, химически инертны и неpаствоpимы в жидкой фазе, имея при этом узкий фракционный состав (частицы близких pазмеpов).
7.3.3. Устройство и принцип действия аппаратов для фильтрования
Напомним, что перепад давлений по обе стороны фильтровальной перегородки может быть создан массой столба жидкости, вакуумированием, избыточным давлением газа и нагнетанием жидкостными насосами. Аппараты для фильтрования, где перепад давлений создается действием центробежной силы, называются фильтрующими центрифугами.
Существуют множество конструкций фильтров и попыток их классификации по разным признакам. Мы ограничимся рассмотрением наиболее распространенных фильтров, подразделив их на аппараты периодического и непрерывного действия.
Простейшим аппаратом периодического действия является нутч-фильтр , используемый обычно в производстве малой мощности. Он представляет собой вертикальный цилиндрический корпус, разделенный фильтровальной перегородкой на две неравные камеры. Исходный раствор загружается в верхнюю, а фильтрат собирается в нижней камере. Необходимый перепад давлений создает-
ФАРМАЦЕВТИЧЕСКИЕ РАСТВОРЫ. КАПЛИ. СИРОПЫ
ся вакуумированием нижней камеры (верхняя при этом сообщается с атмосферой). После промывки осадок выгружается, и цикл повторяется (рис.7.10 а ).
Нутч-фильтры удобны в тех случаях, когда необходимо получить осадки, свободные от примесей. Жидкости со слизистым осадком фильтруются очень плохо. Также не следует фильтровать эфирные и спиртовые извлечения и растворы, поскольку эфир и спирт при большом разряжении быстро испаряется, и пары их будут отсасываться насосом и выбрасываться в воздух.
К числу распространенных фильтров периодического действия, работающих под давлением, относят друк-фильтры. Они представляют собой нутчи, верхняя половина которых закрыта и герметична, поэтому в ней можно создавать давление, необходимое для ускорения фильтрации. Нижняя часть друкфильтра негерметична. Необходимое давление создается при помощи сжатого воздуха. Друк-фильтры можно применять в тех случаях, когда работают со спиртовыми, эфирными и другими органическими растворителями, имеющими низкую температуру кипения. Через друк-фильтры можно фильтровать вязкие жидкости (рис 7.10 б ).
Рис. 7.10. Устройство аппаратов для фильтрования:
а – нутч-фильтр; б – друк-фильтр
Фильтр-пресс – аппараты с большой фильтрующей способностью, обладающие высокой производительностью. Фильтр-пресс дает возможность получать не только хорошо осветленные жидкости, но и промытые осадки. Они с о- стоят из ряда чередующихся пустотелых чугунных рам и сплошных рифленных плит с желобами. Между плитами и рамами прокладывают фильтровальные тка-
ФАРМАЦЕВТИЧЕСКИЕ РАСТВОРЫ. КАПЛИ. СИРОПЫ
невые перегородки (бельтинг), после чего весь пакет стягивается гидравлическим механизмом. Фильтруемая жидкость, нагнетаемая насосом, поступает в камеры фильтр-пресса, откуда фильтрат, пройдя через обе фильтрующие перегородки каждой камеры, стекает по желобам к выходным каналам, а осадок накапливается внутри камер. После удаления фильтрата осуществляют промывку осадка промывной жидкостью, которая освобождает и фильтрующие перегородки, стекая по желобам противоположной плиты. Плиты и рамы, изготовляемые из чугуна, стали и керамики, при необходимости снабжают специальными каналами для теплоносителей и хладоагентов. Поверхность фильтрования у фильтpпpессов достигает 140 м 2 , рабочее давление 1,5 МПа, иногда до 1,6 МПа.
Рис. 7.11. Схема работы фильтр-пресса
К числу аппаратов периодического действия относятся также патронные фильтры. Они состоят из элементов в виде закрытых снизу труб с продольными ребрами и отверстиями в стенках. На эти трубы нанизаны пористые кольца из керамики, спрессованного диатомита или стекла. Пучок таких патронов помещается в закрытый цилиндрический корпус, где они плотно вставляются в гнезда решетки с внутренними параллельными каналами, которые служат для отвода фильтрата, проникающего через пористые фильтровальные элементы. Фильтруемая жидкость нагнетается в пространство между патронами под давлением до 0,8 мПа. По рабочему циклу и способу удаления осадка патронные фильтры аналогичны листовым. Поверхность фильтрования достигает 50 м 2 , пористость патрона 40%, его длина до 2 м.
Источник
Медицинские растворы заводского производства. Интенсификация процесса растворения. Способы очистки
Общая характеристика медицинских растворов. Изучение правил выбора растворителя, способов очистки. Контроль качества раствора натрия бромида 6,0, магния сульфата 6,0, глюкозы 25,0, воды очищенной до 100,0 мл. Оценка физиологического состава новокаина.
| Рубрика | Медицина |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 28.09.2015 |
| Размер файла | 67,7 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Медицинские растворы заводского производства. Интенсификация процесса растворения. Способы очистки
О главление
Введение
Глава 1. Общая характеристика медицинских растворов
1.1 Характеристика и классификация растворов
1.2 Интенсификация процесса растворения
1.3 Способы очистки
Глава 2. Э кспериментальная часть
2.1 Контроль качества раствора натрия бромида 6,0, магния сульфата 6,0, глюкозы 25,0, воды очищенной до 100,0 мл
2.2 Контроль качества раствора новокаина (физиологический) состав: Новокаина 0,5, раствора кислоты хлороводородной 0,1 моль/л 0,4 мл, натрия хлорида 0,81, воды для инъекций до 100,0 мл
Выводы
Список использованной литературы
Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами:
— благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями;
— жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения;
— в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.);
— данные лекарственные формы просты и удобны для применения;
— в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике;
— при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме;
— мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств.
Вместе с тем, жидкие лекарства имеют ряд недостатков:
— они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны;
— растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток;
— ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке;
— жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями.
Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно.
Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ.
Целью и задачами данной работы является изучение медицинского раствора заводского производства.
Глава 1 . Общая характеристика медицинских растворов
Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах.
Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта.
Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор.
Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др.
При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов.
Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами.
Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода).
Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной.
Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений.
С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно.
Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается.
Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества:
1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя.
2. Легкорастворимые — от 1 до 10 частей растворителя.
3. Растворимые — от 10 до 20 частей растворителя.
4. Труднорастворимые — от 30 до 100 частей растворителя.
5. Малорастворимые — от 100 до 1000 частей растворителя.
6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя.
7. Практически нерастворимые — более чем 10 000 частей растворителя.
Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция).
Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси.
Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы.
— Водные. Solutiones aquosae seu Liquores.
— Спиртовые. Solutiones spirituosae.
— Глицериновые. Solutiones glycerinatae.
— Масляные. Solutiones oleosae seu olea medicata.
По агрегатному состоянию растворимых в них лекарственных веществ:
— Растворы твердых веществ.
— Растворы жидких веществ.
— Растворы с газообразными лекарственными средствами.
1.2 Интенсификация процесса растворения
1.3 Способы очистки
2.1 Контроль качества раствора натрия бромида 6,0, магния сульфата 6,0, глюкозы 25,0, воды очищенной до 100,0 мл
2.2 Контроль качества раствора новокаина (физиологический) состав: Новокаина 0,5, раствора кислоты хлороводородной 0,1 моль/л 0,4 мл, натрия хлорида 0,81, воды для инъекций до 100,0 мл
Выводы
Список использованной литературы
Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами:
— благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями;
— жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения;
— в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.);
— данные лекарственные формы просты и удобны для применения;
— в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике;
— при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме;
— мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств.
Вместе с тем, жидкие лекарства имеют ряд недостатков:
— они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны;
— растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток;
— ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке;
— жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями.
Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно.
Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ.
Целью и задачами данной работы является изучение медицинского раствора заводского производства.
Глава 1 . Общая характеристика медицинских растворов
Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах.
Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта.
Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор.
Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др.
При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов.
Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами.
Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода).
Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной.
Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений.
С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно.
Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается.
Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества:
1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя.
2. Легкорастворимые — от 1 до 10 частей растворителя.
3. Растворимые — от 10 до 20 частей растворителя.
4. Труднорастворимые — от 30 до 100 частей растворителя.
5. Малорастворимые — от 100 до 1000 частей растворителя.
6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя.
7. Практически нерастворимые — более чем 10 000 частей растворителя.
Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция).
Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси.
Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы.
— Водные. Solutiones aquosae seu Liquores.
— Спиртовые. Solutiones spirituosae.
— Глицериновые. Solutiones glycerinatae.
— Масляные. Solutiones oleosae seu olea medicata.
По агрегатному состоянию растворимых в них лекарственных веществ:
— Растворы твердых веществ.
— Растворы жидких веществ.
— Растворы с газообразными лекарственными средствами.
1.2 Интенсификация процесса растворения
1.3 Способы очистки
Широкое применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными формами:
— благодаря применению определённых технологических приёмов (растворение, пептизация, суспендирование или эмульгирование) лекарственное вещество, находящееся в любом агрегатном состоянии, может быть доведено до оптимальной степени дисперсности частиц, растворено или равномерно распределено в растворителе, что имеет большое значение для оказания лечебного действия лекарственного вещества на организм и подтверждено биофармацевтическими исследованиями;
— жидкие лекарственные формы, отличаются большим разнообразием состава и способов применения;
— в составе ЖЛФ возможно снижение раздражающего действия некоторых лекарственных веществ (бромидов, йодидов и т.д.);
— данные лекарственные формы просты и удобны для применения;
— в ЖЛФ возможна маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно в детской практике;
— при приёме внутрь они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки, таблетки и др.), действие которых проявляется после растворения их в организме;
— мягчительное и обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в виде жидких лекарств.
Вместе с тем, жидкие лекарства имеют ряд недостатков:
— они менее стабильны при хранении, так как в растворенном виде вещества более реакционноспособны;
— растворы быстрее подвергаются микробиологической порче, соответственно у них ограниченный срок хранения — не более 3-х суток;
— ЖЛФ требуют достаточно большого времени и специальной посуды для приготовления, неудобны при транспортировке;
— жидкие лекарства уступают по точности дозирования другим лекарственным формам, так как дозируются ложками, каплями.
Таким образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при создании новых лекарственных препаратов, поэтому изучение данной темы весьма целесообразно.
Кроме того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет сократить количество экстемпоральных лекарственных препаратов и увеличить количество готовых жидких лекарств, поэтому остается весьма актуальным изучение технологии ЖЛФ.
Целью и задачами данной работы является изучение медицинского раствора заводского производства.
Глава 1 . Общая характеристика медицинских растворов
Медицинские растворы отличаются большим разнообразием свойств, состава, способов получения и назначения. Отдельные растворы, изготовление которых предусматривает проведение химических реакций, получают на химико-фармацевтических заводах.
Растворы имеют ряд преимуществ перед другими лекарственными формами, так как значительно быстрее всасываются в желудочно-кишечном тракте. Недостаток растворов — их большой объем, возможные гидролитические и микробиологические процессы, которые вызывают быстрое разрушение готового продукта.
Знания технологии растворов важны и при изготовлении почти всех других лекарственных форм, где растворы являются полупродуктами или вспомогательными компонентами при изготовлении конкретной лекарственной формы.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью состава, а от механических смесей — однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Важнейшая особенность процесса растворения — его самопроизвольность (спонтанность). Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система — раствор.
Растворители могут быть полярными и неполярными веществами. К первым относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Неполярными растворителями являются жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например углеводороды, галоидоалкилы и др.
При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные, как правило, соотношения между составом и свойствами растворов.
Чаще всего руководствуются старинным правилом: «Подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодны те растворители, которые структурно сходны и, следовательно, обладают близкими или аналогичными химическими свойствами.
Растворимость жидкостей в жидкостях колеблется в широких пределах. Известны жидкости, неограниченно растворяющиеся друг в друге (спирт и вода), т. е, жидкости, сходные по типу межмолекулярного воздействия. Имеются жидкости, ограниченно растворимые друг в друге (эфир и вода), и, наконец, жидкости, практически нерастворимые друг в друге (бензол и вода).
Ограниченная растворимость наблюдается в смесях ряда полярных и неполярных жидкостей, поляризуемость молекул которых, а следовательно, и энергия межмолекулярных дисперсионных взаимодействий, резко различаются. При отсутствии химических взаимодействий растворимость максимальна в тех растворителях, межмолекулярное поле которых по интенсивности близко к молекулярному полю растворенного вещества. Для полярных жидких веществ интенсивность поля частиц пропорциональна диэлектрической постоянной.
Диэлектрическая постоянная воды равна 80,4 (при 20°С). Следовательно, вещества, имеющие высокие диэлектрические постоянные, будут в большей или меньшей степени растворимы в воде. Например, хорошо смешивается с водой глицерин (диэлектрическая постоянная 56,2), этиловый спирт (26) и т.д. Наоборот, нерастворимы в воде петролейный эфир (1,8), четыреххлористый углерод (2,24) и т.д. Однако это правило не всегда действительно, особенно в применении к органическим соединениям. В этих случаях на растворимость веществ оказывают влияние различные конкурирующие функциональные группы, их число, относительная молекулярная масса, размер и формы молекулы и другие факторы. Например, дихлорэтан, диэлектрическая постоянная которого равна 10,4, практически нерастворим в воде, тогда как диэтиловый эфир, имеющий диэлектрическую постоянную 4,3, растворим в воде при 20°С в количестве 6,6%. По-видимому, объяснение этому нужно искать в способности эфирного атома кислорода образовывать с молекулами воды нестойкие комплексы типа оксониевых соединений.
С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются друг с другом (фенол и вода при критической температуре 68,8°С и более высокой растворяются друг в друге в любых пропорциях). При изменении давления взаимная растворимость меняется незначительно.
Растворимость газов в жидкостях принято выражать коэффициентом поглощения, который указывает, сколько объемов данного газа, приведенных к нормальным условиям (температура 0°С, давление 1 атм), растворяется в одном объеме жидкости при данной температуре и парциальном давлении газа 1 атм. Растворимость газа в жидкостях зависит от природы жидкостей и газа, давления и температуры. Зависимость растворимости газа от давления выражается законом Генри, согласно которому растворимость газа в жидкости прямо пропорциональна его давлению над раствором при неизменной температуре, однако при высоких давлениях, особенно для газов, химически взаимодействующих с растворителем, наблюдается отклонение от закона Генри. С повышением же температуры растворимость газа в жидкости уменьшается.
Любая жидкость обладает ограниченной растворяющей способностью. Это означает, что данное количество растворителя может растворить лекарственное вещество в количествах, не превышающих определенного предела. Растворимостью, вещества называется его способность образовывать с другими веществами растворы. Сведения о растворимости лекарственных веществ приведены в фармакопейных статьях. Для удобства в ГФ XI указывается количество частей растворителя, необходимое для растворения 1 части лекарственного вещества при 20°С. По степени растворимости различают вещества:
1. Очень легко растворимые, требующие для своего растворения не более 1 части растворителя.
2. Легкорастворимые — от 1 до 10 частей растворителя.
3. Растворимые — от 10 до 20 частей растворителя.
4. Труднорастворимые — от 30 до 100 частей растворителя.
5. Малорастворимые — от 100 до 1000 частей растворителя.
6. Очень мало растворимые (почти нерастворимые) — от 1000 до 10 000 частей растворителя.
7. Практически нерастворимые — более чем 10 000 частей растворителя.
Растворимость данного лекарственного вещества в воде (и в другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость их с увеличением температуры повышается. Однако бывают исключения (например, соли кальция).
Некоторые лекарственные вещества могут растворяться медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси.
Растворы, применяемые в фармации, отличаются большим разнообразием. В зависимости от применяемого растворителя все многообразие растворов можно подразделить на следующие группы.
— Водные. Solutiones aquosae seu Liquores.
— Спиртовые. Solutiones spirituosae.
— Глицериновые. Solutiones glycerinatae.
— Масляные. Solutiones oleosae seu olea medicata.
По агрегатному состоянию растворимых в них лекарственных веществ:
— Растворы твердых веществ.
— Растворы жидких веществ.
— Растворы с газообразными лекарственными средствами.
1.2 Интенсификация процесса растворения
1.3 Способы очистки
Фильтрование — процесс разделения гетерогенных систем с твердой дисперсной фазой при помощи пористой перегородки, которая пропускает жидкость (фильтрат) и задерживает взвешенные твердые частицы (осадок). Процесс этот осуществляется не только за счет задерживания частиц, крупнее диаметра капилляров перегородки, но и за счет адсорбции частиц пористой перегородкой, и за счет слоя образовавшегося осадка ( шламовый тип фильтрования).
Движение жидкости через пористую фильтрующую перегородку имеет, в основном, ламинарный характер.
Если допустить, что капилляры перегородки имеют круглое сечение и одинаковую длину, то зависимость объема фильтрата от различных факторов подчиняется закону Пуазеля:
F- поверхность фильтра, мІ;
z- число капилляров на 1 мІ;
r- средний радиус капилляров, м;
ДP- разность давлений по обе стороны фильтрующей перегородки (или перепад давлении на концах капилляров), н/мІ;
ф- длительность фильтрования, сек;
?- абсолютная вязкость жидкой фазы в н/с·мІ;
l-средняя длина капилляров, мІ;
б- поправочный коэффициент на кривизну капилляров;
Q- объем фильтрата, мі.
Иначе, объем профильтрованной жидкости прямо пропорционален поверхности фильтра (F), пористости (r,z), перепаду давлений (ДР), длительности фильтрования (ф) и обратно пропорционален вязкости жидкости, толщине фильтрующей перегородки и кривизны капилляров. Из уравнения Пуазеля выводится уравнение скорости фильтрования (V), которая определяется количеством жидкости, прошедшей через единицу поверхности за единицу времени.
После преобразования уравнения Пуазеля оно приобретает вид:
V = ДP/Rосадка + Rперегородки
где R — сопротивление движению жидкости. Из этого уравнения следует ряд практических рекомендаций для рационального проведения процесса фильтрования. А именно, для увеличения разности давлений над и под перегородкой создают либо повышенное давление над фильтрующей перегородкой, либо разрежение под ней.
Отделение твердых частиц от жидкости при помощи фильтровальной перегородки является сложным процессом. Для такого отделения нет необходимости применять перегородку с порами, средний размер которых меньше среднего размера твердых частиц.
Установлено, что твердые частицы успешно задерживаются порами большего размера, чем средний размер задерживаемых частиц. Твердые частицы, увлекаемые потоком жидкости к фильтровальной перегородке, попадают в различные условия.
Наиболее простой случай, когда частица задерживается на поверхности перегородки, имея размер больше, чем начальное сечение пор. Если размер частицы меньше размера капилляра в самом узком сечение, то:
— частица может пройти через перегородку вместе с фильтратом;
— частица может задержаться внутри перегородки в результате адсорбции на стенках поры;
— частица может задержаться за счет механического торможения на месте извилины поры.
Мутность фильтра в начале фильтрования объясняется прониканием твердых частиц через поры фильтровальной перегородки. Фильтрат становится прозрачным, когда перегородка приобретает достаточную задерживающую способность.
Таким образом, фильтрование происходит по двум механизмам:
— за счет образования осадка, так как твердые частицы почти не проникают внутрь пор и остаются на поверхности перегородки (шламовый тип фильтрования);
— за счет закупоривания пор (закупорочный тип фильтрования); при этом осадок почти не образуется, так как частицы задерживаются внутри пор.
На практике эти два типа фильтрования сочетаются (смешанный тип фильтрования).
Факторы, влияющие на объем фильтрата и, следовательно, на скорость фильтрования разделяются на:
Гидродинамические факторы — это пористость фильтрующей перегородки, площадь её поверхности, разность давлений по обе стороны перегородки и другие факторы, учитывающиеся в уравнение Пуазеля.
Физико-химические факторы — это степень коагуляции или пептизации взвешенных частиц; содержание в твердой фазе смолистых, коллоидных примесей; влияние двойного электрического слоя, возникающего на границе твердой и жидкой фаз; наличие сольватной оболочки вокруг твердых частиц и т.д. Влияние физико-химических факторов, тесно связанных с поверхностными явлениями на границе раздела фаз, становится заметно при небольших размерах твердых частиц, что как раз и наблюдается в фармацевтических растворах, подлежащих фильтрованию.
В зависимости от размера удаляемых частиц и цели фильтрования различают следующие методы фильтрования:
1. Грубая фильтрация — для отделения частиц размером 50 мкм и более;
2. Тонкая фильтрация — обеспечивает удаление частиц размером 1-50 мкм.
3. Стерильная фильтрация (микрофильтрация) применяется ля удаления частиц и микробов размеров 5-0,05 мкм. В этой разновидности иногда выделяют ультрафильтрацию для удаления пирогенов и других частиц размером 0,1-0,001 мкм. Речь о стерильной фильтрации пойдет в теме: «Инъекционные лекарственные формы».
Все аппараты для фильтрования в промышленности называются фильтрами; основная рабочая часть их — фильтровальные перегородки.
Фильтры, работающие под разрежением — нутч-фильтры.
Нутч — фильтры удобны в тех случаях, когда необходимо получить чистые промытые осадки. Нецелесообразно применять эти фильтры для жидкостей со слизистыми осадками, эфирные и спиртовые извлечения и растворы, так как эфир и этанол при разрежении быстрее испаряются, отсасываются в вакуумную линию и попадают в атмосферу.
Фильтры, работающие под избыточным давлением — друк-фильтры. Перепад давлений значительно больше, чем в нутч-фильтрах и может составлять от 2 до 12 атм. Эти фильтры простые по устройству, высоко производительны, позволяют фильтровать вязкие, легколетучие и с большим удельным сопротивлением осадка жидкости. Однако для выгрузки осадка необходимо снимать верхнюю часть фильтра и собирать его вручную.
Рамный фильтр — пресс состоит из ряда чередующихся пустотелых рам и плит, имеющих с обеих сторон рифления и желоба. Каждые рама и плита разделены фильтровальной тканью. Число рам и плит подбирают, исходя из производительности, количества и назначения осадка, в пределах 10-60 шт. Фильтрование проводят под давлением 12 атм. Фильтр-прессы обладают высокой производительностью, в них получают хорошо промытые осадки и осветленный фильтрат, имеют все преимущества друк-фильтров. Однако для фильтрования следует применять очень прочные материалы.
Фильтр-«Грибок» может работать и под вакуумом и при избыточном давлении. Фильтровальная установка состоит из емкости для фильтруемой жидкости; фильтра «Грибок» в виде воронки, на которую закрепляется фильтрующая ткань (вата, марля, бумага, бельтинг и др.); ресивера, сборника фильтрата, вакуумного насоса.
Таким образом, фильтрование является важным в технологическом смысле процессом. Оно используется или самостоятельно, или может быть неотъемлемой частью схемы производства такой фармацевтической продукции как растворы, экстракционные препараты, очищенные осадки и др. Качество указанной продукции зависит от правильно подобранных аппаратов для фильтрования, фильтровальных материалов, скорости фильтрования, соотношения твердой и жидкой фаз, структуры твердой фазы и ее поверхностных свойств.
Источник