- Очистка от оксидов азота
- Методы очистки от оксидов азота
- №1: абсорбция
- №2: регулирование процесса горения
- №3: адсорбция (хемосорбционные процессы)
- №4: каталитическое восстановление
- №5: карбамидный метод
- Где применяется фильтрация газов?
- Лекция №5. Физико-химические основы очистки и обезвреживания дымовых газов от оксидов азота
- Очистка газов от оксидов азота
- Загрязнение воздушного бассейна промышленными отходами и неблагоприятные последствия этого ставят проблему сохранения чистоты окружающей среды в число одной из важнейших. Какие технические решения для очистки газов от оксидов азота существуют сегодня?
Очистка от оксидов азота
При нормальном температурном режиме оксид азота не имеет цвета, но обладает приятным сладким запахом. Источники образования этого газа – продукты, являющиеся результатом процесса сжигания топлива в печах, а также остатки, выделяемые при работе двигателей внутреннего сгорания. На долю последнего приходится около 95% всех газообразных выбросов в атмосферу. Поэтому актуальность фильтрации веществ от окиси азота очевидна.
Методы очистки от оксидов азота
Сегодня наибольшей популярностью пользуются 5 способов фильтрации газообразных веществ. Далее в статье будет подробно рассмотрен каждый из них.
№1: абсорбция
Очистительный процесс состоит из этапа взаимодействия вещества с водой и стадии нейтрализации щелочными кислотами. Преимущество такого метода заключается в том, что по итогу его применения образуются вещества, пригодные для дальнейшего использования в сельском хозяйстве, разных отраслях тяжелой/легкой промышленности. Недостаток абсорбционного способа – это необходимость многократного разбавления водой по причине превышения концентрации азота предельно-допустимого значения.
№2: регулирование процесса горения
Метод проводиться в местах, где режим температуры составляет от 850 до 1100 градусов. Уровень результативности очистки от оксидов азота составляет 70%. Фильтрация газовых выбросов происходит в две стадии:
- Технологические меры.
- Второй этап – эксплуатация установок, встроенных в котлы/печи.
Для высокой результативности процесса фильтрации на второй стадии необходимо:
- уменьшать избыток воздуха;
- снижать температуру подогрева кислорода;
- поддерживать циркуляцию дымовых газов;
- обеспечивать двухстадийное сжигание расходуемого горючего;
- использовать воду вместо пара (в объеме до 10% от общей массы вещества).
Особенностью регуляционного метода является незначительное влияние разновидности топлива на проведение химической реакции. Однако на практике подтверждается прямая зависимость скорости, результативности фильтрации от режима в зоне горения.
№3: адсорбция (хемосорбционные процессы)
Главным реагентом в такой химреакции выступает активированный уголь. Сорбентом могут также служить:
Одним из условий реакции является соблюдение температурного режима в пределах от 80 до 130 градусов. Результативность такого способа чистки составляет до 90%.
Недостатком адсорбции признана цена применяемых сорбентов. Однако в некоторых странах мира для очистки дымовых газов используются альтернативные, более дешевые реагенты (угли, коксолигнин).
В последние годы в отрасли промышленности самым перспективным способом стало применение селективных сорбентов в жидком состоянии. Более бюджетным вариантом реагента является смесь торфа, обработанного аммиаком, с известью. При взаимодействии с окисью азота уровень результативности реакции равен 99%.
Перспективными методами считаются также электронно-лучевая и озонная чистка. Их преимущество – рекуперативность, т.е. возможность в итоге реакции получить ценные побочные продукты, например, сульфат, нитрат аммония. Такие способы фильтрации практикуют в США и Японии, так как предприятия данных стран оснащены специальными высокомощными озонаторами. Рациональность их применения доказана результативностью очистительного процесса – 95%.
№4: каталитическое восстановление
Очистка от оксидов азота данным методом основывается на реакции, результатом которой является образование молекулярного азота. Восстановительными средствами выступают:
Исходя из диапазона температур (400 – 800 градусов), а также категории используемых катализаторов, метод разложения оксида азота классифицируется на три группы:
- высокотемпературную;
- селективную;
- гетерогенную.
Эффективность метода зависит от степени природной активности используемого катализатора. В качестве него могут выступать металлы платиновой группы, сплавы на основе родия/палладия. Исходя из высокой цены на данные компоненты, процесс фильтрации посредством восстановления считается дорогостоящим удовольствием для многих предприятий.
В России используются более дешевые катализаторы на основе меди, хрома, никеля. В этой стране применение данного способа фильтрации проводится на специальных установок – насыпных катализаторах, именуемых «АПК-2». Режим их работы можно регулировать в зависимости от концентрации оксида.
№5: карбамидный метод
Такой способ позволяет очищать газовые выбросы от оксидов азота на 95%. Особенность карбамидного метода заключается в отсутствии зависимости реакции от концентрации оксида. Преимуществом способа также является то, что нет необходимости проводить предварительную подготовку газа. Карбамидный метод очистки от оксидов азота неплохо зарекомендовал себя в различных производствах. Такая фильтрация также проводиться на станциях теплоэнергетики (только с использованием технологии сжигания топлива).
Где применяется фильтрация газов?
Сегодня очистка от оксидов азота используется во многих отраслях жизнедеятельности человека:
- медицина: изготовление медикаментов, при процедуре введения наркоза;
- тяжелая промышленность: окись азота используется для производства взрывчатых смесей;
- пищевая сфера: производство добавок, а также заморозка пищевых фабрикатов, заготовок;
- эксплуатация транспортных средств: окись азота необходима для вспрыскивания во впускные коллекторы двигателей;
- ракетное строительство: для получения вещества пропеллента, выступающего в роли окислителя двигателей, топлива для монокомпонентых ракетных моторов.
Исходя из цели фильтрации, необходимости применения конечных продуктов реакции, используется один либо комбинация вышеописанных способов. Данные методы позволяют очистить газообразные вещества от окисей азота с концентрацией от 100 до 1000 мг/м 3 .
Источник
Лекция №5. Физико-химические основы очистки и обезвреживания дымовых газов от оксидов азота
Физико-химические основы очистки и обезвреживания дымовых газов от оксидов азота
Основными источниками оксидов азота являются газы, образующиеся на стационарных установках при сжигании топлива, выхлопные газы двигателей внутреннего сгорания, отходящие газы производства азотной кислоты, получение катализаторов, газы, образующиеся при травлении металлов. На долю процессов сжигания органического топлива на стационарных установках и в двигателях внутреннего сгорания приходится 5% от всех выбросов.
Одна из основных трудностей улавливания оксидов азота из отходящих газов, также как оксидов серы, — их малая концентрация при огромных объемах выбрасываемых газов.
Способов очистки газов разного состава от оксидов азота достаточно много, но их делят на 2 большие группы:
1. Сорбционные методы – абсорбционные и адсорбционные;
2. Каталитические: с окислением до диоксида и с восстановлением оксидов до молекулярного азота.
Все эти методы могут осуществляться как в мокром (с поглощением растворами), так и в сухом (поглощение оксидов азота сухими сорбентами или протекание реакции в газовой фазе) исполнении. Методы очистки в каждой из этих групп имеют плюсы и минусы, существенно отличаются по экономическим показателям и эффективности очистки. Часто в промышленности используются комплексные методы очистки дымовых газов от оксидов азота и оксидов серы.
Адсорбция происходит в результате взаимодействия поверхностных сил притяжения адсорбируемой молекулы, часто сопровождается хемосорбцией и капиллярной конденсацией. С ростом температуры адсорбция уменьшается. Вещества с низкой температурой кипения адсорбируются хуже, чем с высокой. Интенсивность адсорбции увеличивается с ростом молекулярной массы. На интенсивность также влияет пористость сорбента. Оптимальная пористость находится в пределах 0,4 – 0,8 нм. Чем меньше концентрация оксидов азота в дымовых газах, тем выше время пребывания их в адсорбере. При концентрации оксидов азота на входе 0,2% степень поглощения достигается 95 – 98%.
В качестве адсорбентов применяют приготовленные из каменноугольного кокса активированные угли, древесный уголь, активированный полукокс бурых углей и торфа. Десорберы – вода, пар. Продукт десорбции – азотная кислота и концентрированные оксиды азота.
Хороший эффект дает применение молекулярных сит, то есть минералы с нитратами калия, натрия в структуре с пористостью, соизмеримой с размерами молекул (цеолиты), и их десорбция осуществляется продувкой горячим воздухом. В результате получается высококонцентрированный оксид азота, из которого получают 60%-ную азотную кислоту.
Главный минус адсорбционных методов – большие капитальные затраты, габаритность и трудность сбыта получаемых продуктов.
Оксиды азота растворяются в воде:
Вывод: NO c H2O не реагирует
Для полного поглощения оксидов азота надо окислить NO до NO2. В качестве окислителя используется пероксид водорода – Н2О2. При этом степень превращения оксидов азота в азотную кислоту составляет 0,03%. Более эффективной очисткой будет контакт при использовании растворов щелочей:
Для абсорбции оксидов азота можно применять гидрооксиды кальция и магния и ряд других щелочных соединений (карбонады). При использовании раствора тиосульфата натрия и сульфата железа образуется комплексное соединение, выпадающее в осадок. В промышленных условиях оксиды азота абсорбируют в скрубберах Вентури, промывных башнях, в насадочных и тарельчатых абсорберах. Недостатки: большие капитальные затраты, появления новых отходов, не находящих сбыта, не допустимых к сбрасыванию в водоемы.
Более перспективны абсорбционные способы с последующей десорбцией оксидов азота в концентрированном виде, пригодном для переработки в азотную кислоту товарной значимости.
Абсорбенты, применяемые для очистки отходящих газов
Вода, водные растворы и суспензии NaOH, Na2CO3, NaHCO3, MgHCO3, BaHCO3, NH4HCO3
Растворы FeCl2, FeSO4, Na2S2O3, NaHCO3, Na2SO3, NaHSO3
Вода, водные растворы Na2SO3(15-25%), NH4OH(5-15%), Ca(OH)2 и Na2CO3(15-20%), NaOH(15-25%), ZnSO3, K2CO3, суспензии CaO, MgO, CaCO3, ZnO, золы и ксиледин с водой 1:1, диметилаланин
Водные растворы Na2CO3+Na3AsO4; Ar2O3+NH3+(NH4)3ArO3; моноэтаноламин, K3PO4, карбонат кальция – Ca(CO3)2, натриевая соль, антрахинон дисульфокислоты
Жидкий азот, медно-аммиачные растворы
Водные растворы Na2CO3, CaCO3, NaOH, Ca(OH)2, КОН, эталоамины
Растворы щелочей натрия, калия, кальция, карбонаты натрия, калия, кальция, магния, тиосульфат натрия – Na2S2O3, тетрахлорметан
Водные растворы NaOH, Ca(OH)2, КОН
Na2CO3, NaOH, Ca(OH)2
При температуре больше 620°C все высшие оксиды азота диссоциируют до NO, а при 900° — 1000°C возможна диссоциация NO:
но реакция идет медленно, поэтому для ускорения процессов применяют катализаторы, в качестве которых используют оксиды металлов: кобальта, меди, никеля, железа, хрома, цинка.
Катализаторы очень быстро дезактивируются из-за адсорбции или кислорода, который содержится в дымовых газах. Поэтому более перспективными являются процессы восстановления оксидов азота на катализаторах. Восстановители – водород, метан, аммиак, угарный газ, твердый углерод.
В катализаторе образуется смеси нитрозных газов и горячих газов при недостатке кислорода. При этом протекают реакции:
В качестве катализаторов используются платина, родий, палладий, рутений, а также кобальт, никель, железо, молибден, хром, цинк и их оксиды. Для экономии используется двухступенчатое селективное каталитическое восстановления оксидов азота. На первой ступени в качестве катализатора применяется оксиде неблагородного металла. На второй – платина и палладий. В качестве восстановителя применяется аммиак:
Скорость обеспечивается при температурах °C. Возможно применение природного газа в сочетании с соответствующим катализатором.
Этот метод разработан в РХТУ имени Менделеева, позволяет очищать дымовые газы от оксидов азота на 95% и практически полностью удаляет оксиды азота из них. Процесс не требует предварительной подготовки газов и в результате образуются нетоксичные продукты: молекулярный азот, углекислый газ, вода, (NH4)2SO4. рН растворов колеблется в пределах от 5 до 9, поэтому не наблюдается коррозии аппаратуры. Эффективность метода практически не зависит от колебания входных концентраций оксидов азота и серы. В общем виде процесс можно описать уравнениями:
Источник
Очистка газов от оксидов азота
Загрязнение воздушного бассейна промышленными отходами и неблагоприятные последствия этого ставят проблему сохранения чистоты окружающей среды в число одной из важнейших. Какие технические решения для очистки газов от оксидов азота существуют сегодня?

Одними из наиболее опасных загрязнителей атмосферы являются оксиды азота (NOx). Наибольшая их концентрация в газовых выбросах наблюдается в отходящих газах производств слабой азотной кислоты и печей риформинга агрегатов аммиака. Применительно к агрегатам производства азотной кислоты типа УКЛ-7 и АК-72 реализована высокотемпературная очистка с использованием палладийсодержащего катализатора АПК-2 и природного газа в качестве восстановителя. Известно, что катализаторы на основе благородных металлов, таких как палладий и платина, обладают уникальными каталитическими свойствами и, прежде всего, высокой активностью и полифункциональностью, однако имеют чрезвычайно высокую стоимость, а при их эксплуатации происходит безвозвратная потеря благородных металлов.
По мнению специалистов весьма перспективны технические решения, базирующиеся на использовании Ni-Cu и Ni-Cu-Co систем для процесса восстановления NOx природным газом, отличающиеся фазовым составом, способом приготовления и геометрической формой.
Катализаторы готовят методом пропитки пористых носителей водными растворами нитратов Ni, Cu, Co, Mn и Al [1, 2].
Блочные носители ячеистой структуры получают методом дублирования структуры пенополиуретана (ППУ) со средним диаметром ячейки (dя) 3,9; 3,0; 2,1; 1,2; 0,7 мм. В соответствии с данным методом на поверхность ППУ наносят керамический шликер (суспензию) и полученную заготовку подвергают термообработке. В качестве дисперсионной среды шликера используют 5 %-ный водный раствор поливинилового спирта (ПВС). Для обеспечения устойчивости шликера и хорошего спекания носителей при обжиге предпочтительны порошки со средним диаметром частиц 2,5–3,0 мкм. Оптимальное соотношение твердое/жидкое (т/ж) в шликере составляет 2,4/1.
Данные, полученные методом комплексного термического анализа исходного ППУ, раствора ПВС, а также ППУ, пропитанного шликером, показали, что процесс разложения органических компонентов практически полностью завершается при 640 °С.
Для увеличения механической прочности (Рмех) носителя, получаемого обжигом глинозема при 1500 °С, широко используют сложную спекающую добавку на основе системы оксидов Si, Mn и Cr в суммарном количестве 5,6 % от общей массы керамического порошка.
Пропитку блоков ППУ шликером в большинстве случаев осуществляют до плотности заготовки 0,40–0,42 г/см 3 . Данная величина подобрана экспериментально, поскольку она позволяет получать носители с четкой структурой, без закупоривания ячеек. После обжига при 1500 °С фазовый состав носителя представлен α-Al2O3, а также незначительными количествами α-SiO2, 3Al2O3·2SiO2, MnO×Al2O3. При изменении температуры прокаливания от 1200 до 1500 °С усадка заготовок на ППУ с dя= 3,0 мм увеличивается с 11,7 до 18,5 %. Плотность всех образцов после обжига при 1500 °С варьирует в интервале 0,43±0,06 г/см 3 . С увеличением dя ППУ от 0,7 до 3,9 мм Рмех носителя уменьшается с 2,1–2,3 МПа до 0,7–0,9 МПа, а водопоглощение (W) падает с 40–44 до 23–25 %.
Резкое возрастание значений Рмех (рис. 1) наблюдается в интервале температур 1400–1500 °С. При этом W ячеистых носителей находится на достаточно высоком уровне 26–30 %.
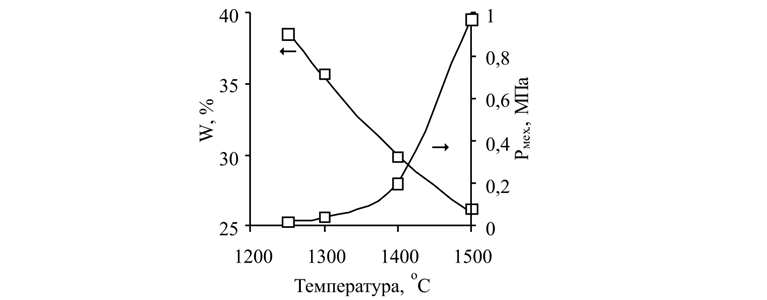
Рис. 1. Зависимость водопоглощения и механической прочности блочных ячеистых носителей от температуры (dя ППУ – 3,0 мм)
Удельная геометрическая поверхность (Sгеом) носителей (табл. 1), рассчитанная с учетом усадки образцов в соответствии с методикой, в которой используется кубическая модель ячеистых материалов, резко убывает с увеличением dя, а значения их порозности находятся в пределах 0,80–0,83 %, что хорошо согласуется с экспериментальными данными.
Таблица 1. Расчетные значения Sгеом образцов блочных ячеистых носителей.
dя исходного ППУ, мм
dя готового блочного носителя, мм
Уменьшение dя готового носителя приводит к резкому возрастанию газодинамического сопротивления. Так, с изменением dя от 3,5 до 0,5 мм при скорости течения газа 0,5 м/с перепад давления увеличивается с 520 до 3360 Па/м.
В силу изложенного для изготовления носителей выбран ППУ со средним диаметром ячейки 3,0 мм.
Для приготовления катализаторов очистки отходящих газов были использованы носители катализаторов конверсии природного газа водяным паром марок НИАП-18 * и НИАП-03-01 * * . Носители НИАП-18 и НИАП-03-01 изготавливают методом таблетирования и шликерного литья соответственно, с последующим обжигом при 1450–1500 °С. Фазовый состав носителя НИАП-18 представлен α-Al2O3 и алюминатами кальция (CaO·6Al2O3, CaO·2Al2O3), а носителя НИАП-03-01 – только α-Al2O3. Результаты исследований основных свойств всех использованных носителей представлены в табл. 2.
Таблица 2. Основные характеристики используемых носителей.
цилиндр с 7 отверстиями и выпуклыми торцами
Насыпная плотность, кг/л
поверхность слоя, м 2 /м 3
Порозность слоя, м 3 /м 3
Механическая прочность, Н/гран.
* средний диаметр ячейки 2,6 мм; ** кажущаяся плотность блока; *** порозность блока
Более низкие значения прочности блочных ячеистых носителей обусловлены их макроструктурой, когда вся нагрузка на грань блока приходится на тонкие перемычки между ячейками. В то же время, по показателям порозности и насыпной плотности блочный носитель значительно превосходит остальные исследованные образцы.
Наибольший перепад давления на единицу высоты слоя (рис. 2) имеет носитель НИАП-18, наименьший – блочный ячеистый.
С целью получения катализаторов с массовым соотношением NiO/CuO = 2,3–3,0, при котором достигается максимум активности, были проведены исследования и определены содержания Ni и Cu, вводимых в носители при одинаковых условиях пропитки растворами нитратов Ni и Cu равной концентра ции.
Обнаружено, что при равном количестве пропиток содержание Ni в катализаторах выше концентрации Cu в 1,1–1,2 раза независимо от типа носителя. Повышение суммарной концентрации активных компонентов (СNiO+CuO) в пропиточном растворе способствует росту их содержания в готовых катализаторах. Наибольшее содержание активных компонентов достигается в образцах полученных пропиткой в растворе с СNiO+CuO = 250 г/л. Используемый пропиточный раствор дополнительно содержал нитрат алюминия в соотношении (NiO+CuO)/Al2O3 = 7. Дальнейшее увеличение концентрации активных компонентов нежелательно в связи с возможностью кристаллизации солей и выпадения осадка при пониженных температурах.
1/AppData/Local/Temp/msohtmlclip1/01/clip_image002.gif»/>
1/AppData/Local/Temp/msohtmlclip1/01/clip_image002.gif»/>

Рис. 2. Зависимость перепада давления на единицу высоты слоя носителей от скорости газового потока: 1 – НИАП-18; 2 – НИАП-03-01; 3 – блочный ячеистый.
Увеличение температуры (tпр) и времени (tпр) пропитки приводит к некоторому росту концентрации NiO и CuO и снижению значений Рмех катализаторов. Так, например, с ростом tпр с 20 до 80 °С суммарное содержание NiO и CuO в носителе НИАП-18 увеличивается с 5,7 до 6,1 %, а увеличение tпр с одной до 120 минут приводит к повышению концентрации с 4,5 до 6,2 %. Несколько меньшее влияние tпр и tпр наблюдается для блочного ячеистого носителя и носителя НИАП-03-01, что обусловливается геометрической формой данных носителей.
При увеличении tпр с 20 до 80 °С прочность образцов на носителе НИАП-18 падает с 380 до 350 Н/гран., на носителе НИАП-03-01 с 580 до 540 Н/гран., а для образцов на ячеистом носителе с 185 до 155 Н/гран. Подобный характер наблюдается и для зависимости Рмех от tпр. Такое изменение Рмех происходит, по-видимому, вследствие воздействия агрессивной среды, которой является пропиточный раствор.
Полученные данные позволили установить оптимальные условия пропитки (tпр = 50 °С, tпр = 1 час), позволяющие получать катализаторы с достаточным содержанием активных компонентов и Рмех. Продолжительность процесса выбрана также из соображения необходимости обеспечения максимальной однородности распределения активных компонентов при пропитке больших объемов носителей в промышленных условиях.
Температура прокаливания пропитанных носителей (400 °С) была выбрана путем анализа дериватограмм исходных гидратов нитратов Ni, Cu и Al, а также одно- и двухкомпонентных композиций этих солей, нанесенных на носители. Характер разложения нитратов Ni и Cu в двухкомпонентных каталитических системах практически не отличается от разложения этих нитратов в однокомпонентных системах.
С увеличением числа пропиток (nпр) возрастает суммарная концентрация NiO и CuO и Рмех (рис.3).
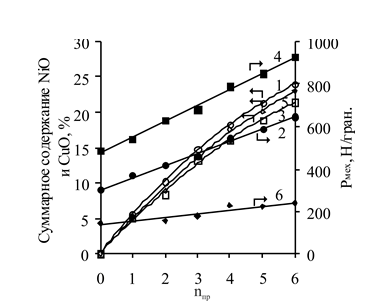
Рис. 3. Зависимость суммарного содержания активных компонентов в катализаторе и его механической прочности от числа пропиток nпр (температура 50 °С, продолжительность 60 мин) носителей: 1, 2 – НИАП-18; 3, 4 – НИАП-03-01; 5, 6 – блочный ячеистый.
Суммарное содержание NiO и CuO после шести пропиток достигает 23,0 % в блочном ячеистом носителе, 21,5 % в НИАП-03-01 и 24,0 % в НИАП-18. Подобная разница обусловлена различием значений W носителей. Рост Рмех с увеличением nпр можно объяснить с точки зрения физико-химической теории дисперсных пористых тел П.А. Ребиндера, согласно которой каркас носителя выполняет роль кристаллической фазы, а оксиды Cu и Ni, находящиеся в порах носителя – дисперсной фазы, противостоящей упругим деформациям. В соответствии с этим, чем больше активного компонента будет введено в носитель, тем большей величины может достигнуть Рмех катализатора.
Для выявления сущности процессов, протекающих при формировании катализаторов, были исследованы образцы №№ 1–6 (табл. 3).
Образцы № 5 получали последовательной пропиткой носителей в растворах нитратов Al, Ni и Cu с промежуточным прокаливанием. В качестве объекта сравнения была исследована механическая смесь носителя НИАП-03-01 и оксидов Ni, Cu и Al (№ 6).
Проведенные исследования позволили установить, что изменение условий приготовления катализаторов (tпр, tпр, nпр, СNiO+CuO) не оказывает влияния на рентгенографические характеристики активной фазы катализаторов. Размер кристаллитов NiO и CuO в образцах № 1 и 2 находится на уровне 260––310 Å. Размер кристаллитов NiO в образцах № 3 и 5 несколько ниже, чем в образце №4, не содержащем Al. На дифрактограммах систем № 3 и № 4 дифракционные линии CuO отсутствуют. В образцах № 1 и № 5 значение параметра кристаллической решетки (а0) NiO близко к табличному значению (a0NiO = 4,177 Å). Такие же показатели наблюдались и для никелевых систем с добавкой алюминия. В то же время, для образцов № 3 и № 4 значение параметра а0 (4,188––4,194 Å) сильно отличается от табличного параметра кристаллической решетки NiO. Искажение а0 свидетельствует о внедрении CuO в кристаллическую решетку NiO, в результате чего образуется оксидный NiO-CuO твердый раствор.
Таблица 3. Основные характеристики разработанных катализаторов.
Насыпная плотность, г/см 3
Процесс восстановления никелевых систем начинается при температуре 280––300 °С и достигает максимальной скорости при температуре 340––390 °С. В случае нанесенного оксида меди он протекает в более низкотемпературной области (180––300 °С). Температуры максимумов эффектов восстановления NiO и CuO уменьшаются в ряду систем на носителях НИАП-18 > НИАП-03-01 > блочный носитель.
Восстановление систем № 3 и № 4 характеризуется наличием одного ярко выраженного максимума на кривых ТПВ, для Ni-Cu-Al систем при 180–210 °С, а для Ni-Cu 210–240 °С. В то же время, кривые восстановления образцов № 5 и № 6 имеют два ярко выраженных максимума в интервале температур 170–210 °С и 300–340 °С. Первый температурный интервал характерен для восстановления CuO, второй – NiO. Такое различие в характере восстановления систем подтверждает наличие оксидного NiО-CuО твердого раствора в образцах № 3 и № 4, в которых после восстановления зафиксирована фаза Ni с сильно искаженным параметром кристаллической решетки (а0=3,541–3,546 Å), который занимает промежуточное положение между а0Ni= 3,524 Å и а0Cu= 3,615 Å. Эти данные свидетельствуют о переходе оксидного NiO-CuO твердого раствора в процессе восстановления в Ni-Cu твердый раствор. Размер кристаллитов для систем № 3, полученных с введением в пропиточный раствор нитрата Al, составляет 170–210 Å, а для систем № 4 – 230–330 Å.
Исследования каталитической активности систем № 1 показали, что даже при 800 °С степень превращения NOx не превышает 20–30 %. Температура достижения 50%-ной степени превращения NOx (t50) на образцах № 2 очень высока и находится на уровне 730–750 °С. В интервале температур 660–750 °С активность образцов № 3–6 практически одинакова (рис. 4).
Остаточное содержание NOx в очищенном газе составляет 0,002–0,003 %. Данные показатели находятся примерно на одном уровне с показателями, достигаемыми на катализаторе АПК-2. Введение никеля в медную систему привело к тому, что t50 для систем № 4 (рис. 4а, кривые 4–6) снизилась до 620–630 °С. Этот факт свидетельствует о синергетическом эффекте при совместном присутствии Ni и Cu в катализаторах. Для образцов № 3 (рис. 4а, кривые 1–3) и № 5 (рис. 4а, кривые 7–9), t50 находится примерно на одном уровне и составляет 595–610 °С, что несколько выше этой величины для АПК-2, определенной в аналогичных условиях (510 °С).
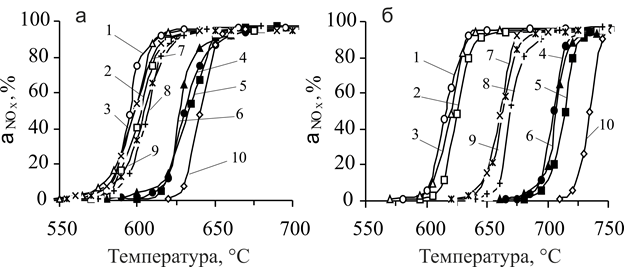
Рис.4 Зависимость степени превращения NOx от температуры на исходных образцах катализаторов (а) и образцах, подвергнутых выдержке в реакционной смеси при 800 °С в течение 2 часов (б).
Образцы № 3 на носителях: 1 – ○ НИАП-18, 2 – □ НИАП-03-01, 3 – r блочный ячеистый;
образцы № 4 на носителях: 4 – ● НИАП-18, 5 – ■ НИАП-03-01, 6 – p блочный ячеистый;
образцы № 5 на носителях: 7 – ´ НИАП-18, 8 – + НИАП-03-01, 9 – Ж блочный ячеистый;
10 – ¯ механическая смесь.
Термообработка в токе реакционной смеси при 800 °С с выдержкой при данной температуре в течение 2 часов (рис. 4б) приводит к тому, что t50 для образцов № 4 повысилась на 75–85 °С, для № 5 – на 60–70 °С, а для механической смеси на 100 °С. Наименьшее повышение t50 (15–20 °С) наблюдается для систем № 3. Термостабильность данных катализаторов объясняется как стабилизирующим действием оксида Al, так и устойчивостью Ni-Cu твердого раствора к рекристаллизации, о чем свидетельствует величина дисперсности активных компонентов (LNiO—CuO = 270–290 Å). В образцах № 5 не происходит образование Ni-Cu твердого раствора, что приводит к большему снижению активности после перегрева. Повторение циклов нагрева катализаторов в реакционной смеси при 800 °С, а также увеличение времени их выдержки в данных условиях не приводит к дальнейшему падению активности. В дальнейших исследованиях использовали метод приготовления катализаторов, заключающийся в пропитке носителей по водопоглощению водным раствором смеси нитратных солей Ni, Cu и Al.
Влияние суммарной концентрации NiO и CuO в катализаторах на их каталитическую активность (рис. 5) позволяют рекомендовать для практического использования катализаторы с содержанием активных компонентов в пределах 12–16 %. В условиях лабораторных испытаний активность катализаторов практически не зависит от свойств носителей.
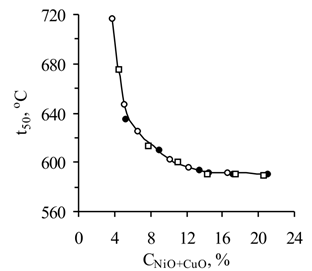
Рис. 5 . Зависимость t50 от суммарного содержания активных компонентов в носителях: ● – НИАП-18; ○ – НИАП-03-01; □ – блочный ячеистый.
Увеличение объемной скорости газового потока и исходной концентрации NOx приводит к смещению температур осуществления процесса в более высокотемпературную область (рис. 6). Кажущаяся энергия активации восстановления NOx, рассчитанная по экспериментальным данным, для катализаторов на всех носителях находится примерно на одном уровне и составляет 155±5 кДж/моль.
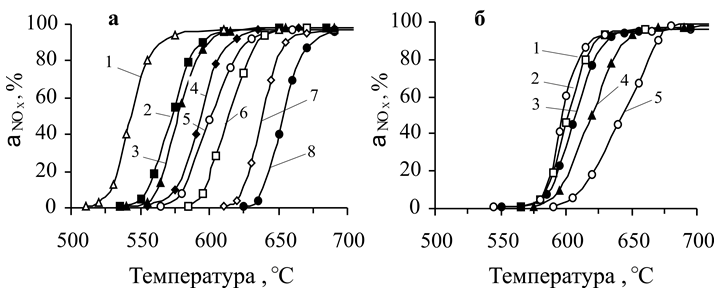
Рис. 6. Зависимость степени превращения оксидов азота на никельмедь- алюминиевом катализаторе на носителе НИАП-03-01 от температуры процесса: а) при различных объемных скоростях (ч -1 ): 1 – 3000; 2 – 5000; 3 – 7000; 4 – 10000; 5 – 15000; 6 – 20000; 7 – 30000; 8 – 50000.
б) при различных начальных концентрациях NOx (% об.): 1-0,05; 2- 0,11; 3- 0,20; 4- 0,38; 5-0,82.
Экспериментальные данные, полученные в ходе исследований, были использованы для отработки промышленной технологии производства катализаторов, получивших наименования НИАП-15-12 (носитель НИАП-03-01), НИАП-15-13 (НИАП-18), и разработки технических условий (ТУ 113-03-00209510-98-2003).
На оборудовании катализаторного производства Новомосковского института азотной промышленности изготовлены опытно-промышленные, а также промышленные партии катализаторов НИАП-15-12 и НИАП-15-13 в количестве двух и четырех тонн соответственно, которые в январе 2004 г. были загружены в реакторы каталитической очистки двух агрегатов УКЛ-7-76 производства слабой азотной кислоты ООО “Менделеевсказот”. В качестве лобового слоя, снижающего температуру “зажигания” процесса, использовали отработанный катализатор АПК-2 в количестве 15–18 % от общей массы загрузки реактора каталитической очистки. При нагрузках агрегатов по аммиаку 4900 – 6000 нм 3 /ч, исходной концентрации NOx в отходящих газах 0,08–0,11 % об. и соотношении CH4/O2 0,5–0,6 обеспечивалась очистка от NOx до остаточной концентрации 0,002–0,003 % об. при регламентной норме не более 0,005 % об.. Содержание СO в очищенных газах не превышало 0,04 % об. при норме не более 0,15 % об.. После нескольких лет эксплуатации разработанных катализаторов изменений в показателях очистки не наблюдалось.
Добавки Co и Mn в Ni-Cu каталитическую систему осуществляются с целью снижения температуры процесса восстановления NOx.
При выборе концентраций компонентов, входящих в состав пропиточного раствора, установлено, что при идентичных условиях пропитки (tпр, tпр, nпр, С) однокомпонентными растворами нитратов никеля, меди, кобальта и марганца cодержание в носителях активных компонентов убывает в ряду Co > Mn > Ni > Cu.
Исследования фазового состава Mn- и Co-содержащих Ni-Cu катализаторов показали, что в отличие от Ni-Cu и Ni-Cu-Mn систем, в которых активные компоненты присутствуют только в виде фазы NiO с искаженным параметром решетки, на дифрактограммах Ni-Cu-Co катализаторов зафиксирована фаза NiO с искаженным параметром решетки, а также линии CuO небольшой интенсивности.
Максимумы на кривых ТПВ для Ni-Cu-Mn систем лежат в интервале температур 190–240 °С, который также характерен и для Ni-Cu систем. Несколько более сложный характер восстановления Ni-Cu-Co систем обусловлен, по-видимому, тем, что Co3O4 частично вытесняет CuO из твердого раствора NiO-CuO и восстановление свободного CuO до Cu и твердого раствора NiO-CuO-CoO до твердого раствора Ni-Cu-Co протекает раздельно. В Ni-Cu-Mn системах продуктом восстановления является твердый раствор Ni-Cu, а MnO2 восстанавливается до MnO. Дисперсность твердых растворов в многокомпонентных системах находится практически на одном уровне 150–190 Å.
При температурах более 640 °С активность Ni-Cu-Co и Ni-Cu-Mn катализаторов находится практически на одном уровне. Остаточное содержание NOx в очищенном газе при этом составляет 0,002–0,003 % об.. Максимальную активность при пониженных температурах имеют Ni-Cu-Co образцы. Для данных катализаторов t50 составляет 580–585 °С. Активность Ni-Cu и Ni-Cu-Mn систем практически одинакова (t50 = 595–605 °C). Таким образом, добавка Co позволяет увеличить активность исследуемых Ni-Cu катализаторов. В то же время Mn в данных условиях не оказывает влияния на каталитическую активность.
Оптимизацию химического состава Ni-Cu-Co катализаторов проводят по показателю t50 с использованием симплекс-решетчатого метода математического планирования эксперимента.
В качестве аппроксимирующей модели был выбран полином третьего порядка, адекватность которой проверялась по критерию Стьюдента t. Для всех контрольных точек и точек матрицы планирования значения t-критерия для уровня значимости р = 0,025 не превышает 2,26, что не превосходит соответствующего критического значения t0,025; 16 = 2,52.
По полученным данным была построена диаграмма “состав-t50” (рис. 7), которая свидетельствует о том, что зависимость t50 от состава каталитической системы носит экстремальный характер.
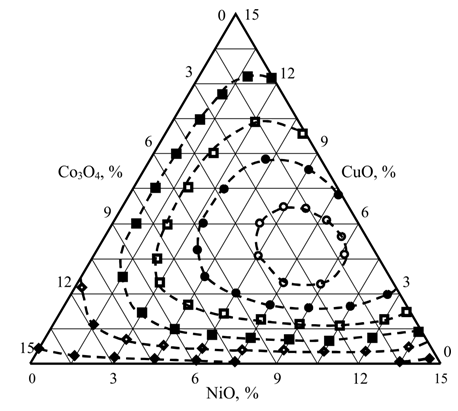
Изолинии значений температур достижения 50 %-ной степени превращения оксидов азота: ○ t50 = 580 °С; ● t50 = 620 °С; □ t50 = 660 °С; ■ t50 = 700 °С; ¯ t50 = 740 °С; ® t50 = 780 °С.
Наименьшая активность характерна для однокомпонентных Ni и Co систем. Увеличение активности катализаторов наблюдается при перемещении в область уменьшения концентрации Co3O4 до 1,0–4,0 % и соотношении NiO/CuO от 0,6 до 1,5 %. Высокую активность (t50= 595–600 °С) имеют также двухкомпонентные Ni-Cu системы с соотношением компонентов NiO/CuO = 2,0–2,8. Область оптимальных составов каталитической системы, для которой t50 имеет минимальное значение (570–580 °С), характеризуется следующими концентрациями компонентов (% мас.): NiO – 6,0–9,0; CuO – 3,5–6,5; Co3O4 – 1,5–4,0.
Таким образом, введение оксида Co в Ni-Cu систему в соответствии с оптимальным соотношением компонентов позволило снизить t50 на 25–30 °С по сравнению с Ni-Cu катализаторами.
Ni-Cu-Co катализаторы на носителях НИАП-03-01 и НИАП-18 получили наименования НИАП-15-12К и НИАП-15-13К соответственно (извещение №1 к ТУ 113-03-00209510-98-2003). Их высокая активность была подтверждена экспериментально в лабораторных и промышленных условиях.
С целью очистки дымовых газов аммиачного производства от оксидов азота авторами [3–6] разработан оригинальный способ, схема которого представлена на рис. 8.
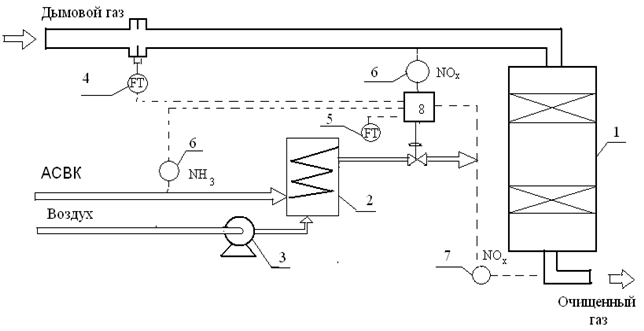
Рис. 8. Принципиальная схема очистки дымовых газов от оксидов азота: 1 – реактор; 2 – теплообменник; 3 – воздуходувка; 4 – датчик расхода дымового газа; 5 – датчик расхода АСВК; 6 – газоанализатор содержания аммиака; 7 – газоанализатор содержания оксидов азота; 8 – блок управления.
Поток очищаемых газов смешивается с воздухом и аммиаксодержащим восстановительным компонентом (АСВК), в качестве которого используют танковые газы производства аммиака, а селективное каталитическое восстановление осуществляют в реакторе при температуре 250 – 450 °С на катализаторе блочного типа.
В отличие от известных методов очистки дымовых газов от оксидов азота предусмотрено их смешения с воздухом и аммиаксодержащим восстановительным компонентом, в качестве которого взяты танковые газы производства аммиака состава, % об.:
а селективное каталитическое восстановление оксидов азота дымовых газов проводят в реакторе при температуре 250–350 °С на вольфрамо-ванадиевом оксидном катализаторе.
Эффективность удаления NOх на данном катализаторе может достигать 90 % и более с проскоком аммиака ниже 50 ppm, в то время как некаталитические методы обеспечивают гораздо меньшую степень очистки, а проскок аммиака с трудом может быть отрегулирован на приемлемом уровне.
Важно отметить, что в случае предлагаемого способа очистки наряду с аммиаком оксиды азота взаимодействуют и с другими компонентами восстановительной системы, в частности с водородом и метаном.
При этом протекают каталитические химические реакции, конечными продуктами которых являются азот, вода и двуокись углерода.
Также найдено, что при полном окислении аммиака, метана и водорода потенциальный рост температуры в зоне реакции составляет 5–10 °С.
В соответствии с приведенной схемой дымовые газы с трубчатых печей, содержащие
и имеющие температуру 290–300 °С, смешиваются с воздухом и подогретым до этой же температуры АСВК вышеуказанного состава и направляются в реактор селективного каталитического восстановления. Выбранная температура является оптимальной, так как при ее снижении возможно образование смеси нитрита и нитрата аммония, а в случае более высокой – снизится селективность работы катализатора.
Необходимое массовое соотношение между оксидами азота в дымовых газах и аммиаком в аммиаксодержащем восстановительном компоненте регулируется датчиками расхода, а также газоанализаторами содержания аммиака и оксидов азота, выведенными на блок управления установки. Объем реакторного блока и масса катализатора рассчитываются, исходя из количества очищаемых дымовых газов. Расход воздуха преимущественно зависит от содержания монооксида азота в дымовых газах и достигается с помощью воздуходувки.
К достоинствам предлагаемого способа следует отнести тот факт, что степень очистки нитрозных газов регулируется скоростью их подачи в зону реакции и объемным соотношением дымовые газы: аммиаксодержащий восстановительный компонент.
1. Дульнев А.В., Ефремов В.Н., Обысов М.А. и др. Исследование Ni-Cu катализаторов нанесенного типа, полученных с применением керамических носителей// Журнал прикладной химии. – 2004. – Т. 77, № 9. – С. 1501–1509.
2. Дульнев А.В., Ефремов В.Н., Обысов М.А. и др. Нанесенные никель-медные катализаторы очистки газовых выбросов производств азотной кислоты от оксидов азота // Катализ в промышленности. – 2005. № 3. – С. 26–32.
3. Пат. РФ № 2296000, МПК В 01 D 53/56, В 01 D 53/86, В 01 J 23/16. Способ очистки дымовых газов от оксидов азота. /Афанасьев С.В., Махлай В.Н., Буданов Ю.Н. и др.
4. Афанасьев С.В., Трифонов К.И. Физико-химические процессы в техносфере. Учебник./ Самара. Изд-во Сам. научн. центра РАН. – 2014 – 195 с.
5. Афанасьев С.В., Шевченко Ю.Н. Аппараты для нейтрализации газовых выбросов, содержащих формальдегид и оксиды азота / Материалы межд. научно-практ. конф. «Нефтегазопереработка-2017». Уфа, 23 мая 2017 г. ГУП Институт нефтепереработки РБ – 2017. – С. 93–94.
6. Афанасьев С.В., Сергеев С.П. Катализаторы и аппараты для нейтрализации формальдегидсодержащих газовых выбросов. Тезисы докл. Всеросс. Научн. конф. «Переработка углеводородного сырья. Комплексные решения (Левинтерские чтения). 03–05 ноября 2016 г./ Самара. СамГТУ. – 2016. – С.19–20.
Источник

















