- 9. Общие способы получения средних солей
- Теория:
- Урок №49. Соли. Классификация. Номенклатура. Способы получения солей
- Конспект урока по химии на тему «Соли: классификация, номенклатура, способы получения» (8 класс)
- Способы образования солей химия 8 класс
- ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ И ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
- ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ
- ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
- ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
- Образец выполнения задания ОГЭ
9. Общие способы получения средних солей
Теория:
1. Соли образуются при взаимодействии металлов с неметаллами.
Например, при взаимодействии железа с хлором образуется хлорид железа(\(III\)):
2 Fe + 3 Cl 2 ⟶ t ° 2 Fe Cl 3 .
Нитрат магния можно получить в реакции взаимодействия магния с нитратом серебра:
Mg + 2 Ag NO 3 → M g NO 3 2 + 2 Ag ↓ .
4. Соли образуются при взаимодействии основных, кислотных или амфотерных оксидов с оксидами, принадлежащими к другой группе оксидов.
Например, при взаимодействии основного оксида кальция с кислотным оксидом углерода(\(IV\)) образуется карбонат кальция:
CaO + CO 2 → Ca CO 3 .
При нагревании смеси основного оксида магния с амфотерным оксидом алюминия образуется алюминат магния:
MgO + Al 2 O 3 ⟶ t ° Mg AlO 2 2 .
5. Соли образуются при взаимодействии основных и амфотерных оксидов с кислотами.
Например, сульфат меди(\(II\)) можно получить, используя оксид меди(\(II\)) и серную кислоту:
CuO + H 2 SO 4 → Cu SO 4 + H 2 O .
Хлорид цинка можно получить, используя оксид цинка и соляную кислоту:
ZnO + 2 HCl → Zn Cl 2 + H 2 O .
6. Соли образуются при взаимодействии кислотных и амфотерных оксидов с основаниями.
Например, при пропускании оксида углерода(\(IV\)) через раствор гидроксида кальция образуется осадок карбоната кальция (известковая вода мутнеет):
Ca OH 2 + CO 2 → Ca CO 3 ↓ + H 2 O .
При взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуется сульфит натрия:
2 NaOH + SO 2 → Na 2 SO 3 + H 2 O .
7. Соли образуются при взаимодействии кислот с основаниями или с амфотерными гидроксидами.
Например, сульфат меди(\(II\)) можно получить, используя гидроксид меди(\(II\)) и серную кислоту:
Cu OH 2 + H 2 SO 4 → Cu SO 4 + 2 H 2 O .
Нитрат алюминия образуется в результате взаимодействия гидроксида алюминия с азотной кислотой:
Al OH 3 + 3 H NO 3 → Al NO 3 3 + 3 H 2 O .
8. Соли можно получить, используя химическую реакцию обмена, протекающую между кислотой и другой солью.
Например, при взаимодействии сульфида железа(\(II\)) с серной кислотой образуется сульфат железа(\(II\)):
FeS + H 2 SO 4 → Fe SO 4 + H 2 S ↑ .
Хлорид кальция образуется при взаимодействии соляной кислоты (водного раствора хлороводорода) с карбонатом кальция:
CaCO 3 + 2 HCl → CaCl 2 + H 2 O + CO 2 ↑ .
9. Соли образуются при взаимодействии щелочей с растворимыми в воде солями.
Например, нитрат натрия образуется в результате химической реакции, протекающей между гидроксидом натрия и нитратом меди(\(II\)):
2 NaOH + Cu NO 3 2 → 2 Na NO 3 + Cu OH 2 ↓ .
Сульфат калия образуется в реакции обмена, протекающей между гидроксидом калия и сульфатом железа(\(II\)):
2 KOH + Fe SO 4 → K 2 SO 4 + Fe OH 2 ↓ .
10. Соли образуются в реакциях обмена, протекающих между другими солями.
Например, чтобы получить бромид серебра, можно в качестве исходных веществ использовать нитрат серебра и бромид калия:
Ag NO 3 + KBr → AgBr ↓ + KNO 3 .
Источник
Урок №49. Соли. Классификация. Номенклатура. Способы получения солей
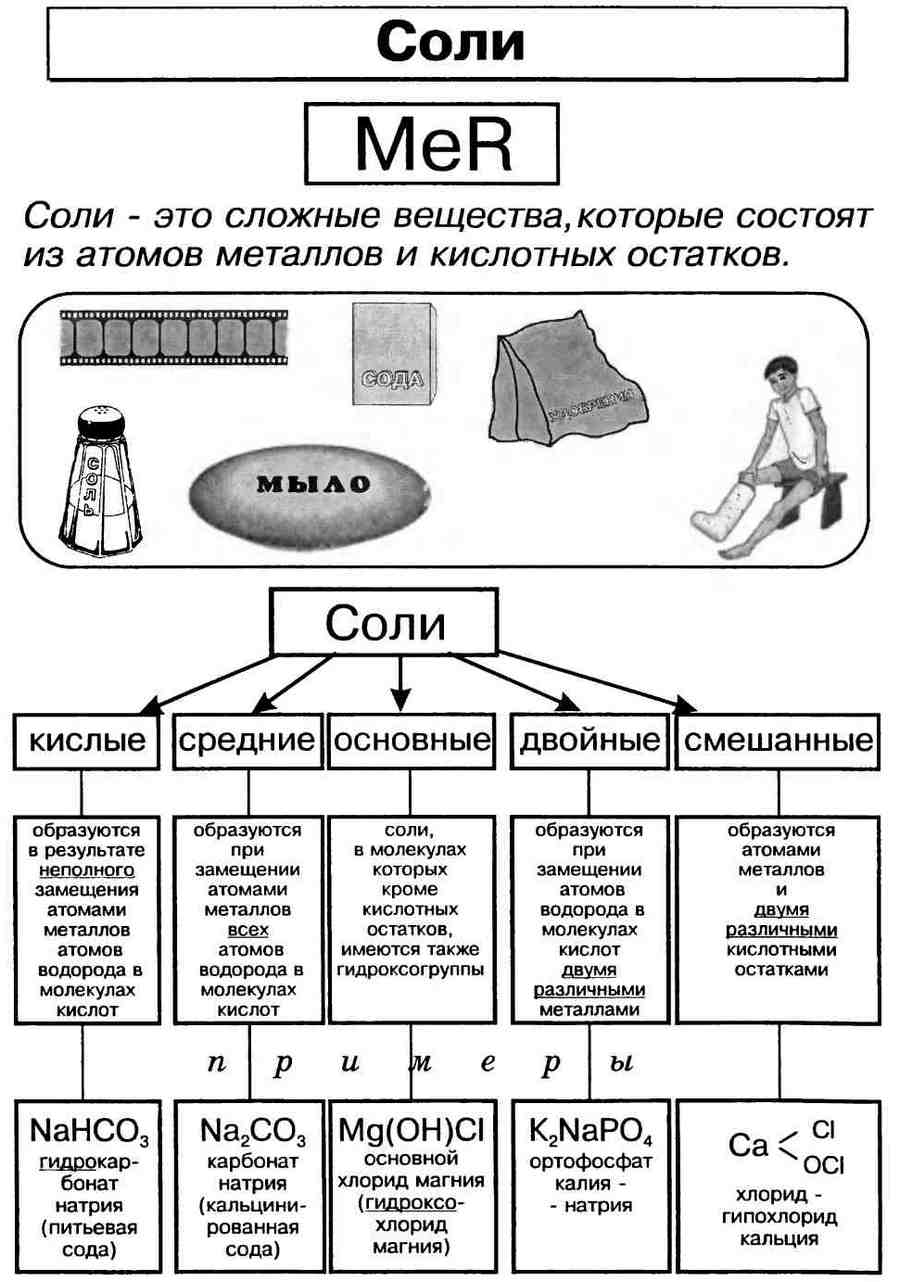
Соли — сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков .
Чаще всего мы будем работать со средними солями:
Названия солей
для средней соли —
название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Na 2 SO 4 — сульфат натрия,
CuSO 4 — сульфат меди (II)
для кислой соли –
«гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
NaHSO 4 – гидросульфат натрия;
NaH 2 PO 4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl — гидроксохлорид магния
ПОЛУЧЕНИЕ СОЛЕЙ
1. Из металлов:
металл + неметалл = соль
металл (металлы до Н 2 ) + кислота (р-р) = соль + Н 2
Zn +2 HCl = ZnCl 2 + H 2
металл 1 + соль 1 = металл 2 + соль 2
Примечание: (металл 2 стоит в ряду активности правее)
Fe + CuCl 2 = FeCl 2 + Cu
2.Из оксидов:
кислотный оксид + щелочь = соль + вода
SO 3 + 2 NaOH = Na 2 SO 4 + H 2 O
основный оксид + кислота = соль + вода
CuO + H 2 SO 4 = CuSO 4 + H 2 O
основный оксид + кислотный оксид = соль
Na 2 O + CO 2 = Na 2 CO 3
3. Реакция нейтрализации:
кислота + основание = соль + вода
HCl + NaOH = NaCl + H 2 O
4. Из солей:
соль 1 + соль 2 = соль 3 + соль 4 ↓
NaCl + AgNO 3 = NaNO 3 +AgCl ↓
соль 1 + щелочь = нерастворимое основание + соль 2
CuSO 4 + 2NaOH = Cu(OH) 2 ↓+ Na 2 SO 4
соль 1 + кислота 1 = кислота 2 + соль 2
2NaCl + H 2 SO 4 = 2HCl + Na 2 SO 4
Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода.
ТРЕНАЖЁРЫ
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Дайте названия следующим солям:
№2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
№3. Как двумя способами из оксида кальция можно получить:
Источник
Конспект урока по химии на тему «Соли: классификация, номенклатура, способы получения» (8 класс)
8 класс _________________Дата
Тема урока: Соли: классификация, номенклатура, способы получения
Тип урока: комбинированный урок
Цель урока: углубление и систематизация знаний учащихся о солях.
— изучить состав, строение, классификацию солей;
— познакомиться с физическими свойствами солей (кратко);
-рассмотреть способы получения солей.
— развивать познавательный интерес, умение сравнивать, анализировать, обобщать, делать выводы;
— продолжить формирование умений формулировать определения.
воспитывать личностные качества, обеспечивающие успешность исполнительной деятельности (дисциплинированность, ответственность), творческой деятельности (активность, увлечённость, наблюдательность, сообразительность, способность к самооценке).
Планируемые результаты обучения:
Предметные — Знать состав солей, их классификацию, номенклатуру и способы получения, уметь записывать уравнения соответствующих реакций. Уметь составлять формулы солей по валентности металла и кислотного остатка.
Метапредметные — Развивать умения соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, самостоятельно планировать пути достижения целей, осознанно выбирать наиболее эффективные способы решения учебных и познавательных задач.
Личностные — Формировать ответственное отношение к учению
Оборудование и материалы: Периодическая система химических элементов Д.И. Менделеева, таблица растворимости солей, кислот и оснований, ряд электронапряжения металлов
1) Какие вещества называются кислотами?
2) Приведите примеры известных нам кислот.
3) Какие вещества называют индикаторами и какие функции они выполняют? Приведите примеры индикаторов.
Дома вы выполняли диф.задание. Задание на отметки «3,4» я проверю после того как вы сдадите мне тетради на проверку. А для того чтобы получить отметку «5» нужно было подготовить доклады на тему «Области применения кислот». Вызывает к доске учеников, подготовивших доклады по этой теме.
Учитель проводит индивидуальный опрос нескольких учащихся по формулам и названиям кислот.
Предполагаемые ответы учеников:
1) Кислота – сложное вещество, состоящее из атомов водорода и кислотного остатка.
2) Серная, соляная, азотная, фосфорная и др.
3) Вещества, которые под действием растворов щелочей и кислот изменяют свой цвет (Лакмус, фенолфталеин, метилоранж). С помощью таких индикаторов можно обнаружить какая среда образовалась в растворе – кислая, щелочная или нейтральная.
Ученики, подготовившие доклады выступают у доски. Остальные ученики слушают докладчиков, задают вопросы. Отвечают на вопросы учителя.
Несколько учеников сдают мини-зачет по формулам и названиям кислот. Остальные ученики сдадут зачет на последующих занятиях.
Человека окружает огромное количество химических веществ.
1) На какие две группы все химические вещества делятся по составу?
2) Вспомните, какие вещества называются простыми?
3) Приведите примеры таких веществ?
4) А какие вещества называются сложными?

Записывает на доске примеры сложных веществ ( Na 2 SO 4, BaCl , KNO 3).
Просит посмотреть на доску и предположить, о каком именно классе неорганических соединений мы будем сегодня говорить?
Предполагаемые ответы: 1) на простые и сложные
2) Простыми называются вещества, которые образованны атомами одного химического элемента
3) O2, H2, Fe, Cu, Al и т . д .
4) Сложными называются вещества, которые образованы атомами разных химических элементов.
Предполагаемый ответ: о солях.
Записывают в тетрадь тему урока.
Изложение нового материала
Посмотрите на записанные на доске формулы солей. Что между всеми ними общего? Верно, все они содержат атомы металлов и кислотные остатки.
Соли – это сложные вещества, которые состоят из атомов металла и кислотных остатков.
Составление формул солей
Если мы внимательно подойдем к рассмотрению этого определения, то заметим, что по своему составу соли чем-то похожи на кислоты, только с той разницей, что кислоты состоят из атомов водорода, а соли содержат ионы металла. Из этого следует, что соли являются продуктами замещения атомов водорода в кислоте на ионы металла. Так, к примеру, если взять известную каждому поваренную соль NaC l , то ее можно рассматривать как продукт замещения водорода в соляной кислоте НС l на ион натрия.
Формулы солей составляются по валентности. Валентность кислотных остатков определяется числом атомов водорода в соответствующей кислоте.
Нарисуем таблицу, в которой отразим названия кислот и соответствующие им названия солей.
С точки зрения растворимости в воде, их можно поделить на такие группы, как:
С другими классификациями солей ученики знакомятся самостоятельно, работая с учебником.
Стр. 107 учебника
Все они содержат атомы металлов и кислотные остатки.
Ученики слушают учителя, отвечают на вопросы делают записи в тетрадях.
Источник
Способы образования солей химия 8 класс
ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ
И ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка. Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
При обычных условиях все соли – твёрдые вещества. Многие соли не имеют цвета, но некоторые ионы придают солям характерную окраску:
Растворимость солей различна. Практически все нитраты, соли натрия, калия, рубидия, цезия и аммония NH4 + растворимы. Среди сульфидов и фосфатов растворимы только фосфаты и сульфиды щелочных металлов.
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ
- Соли взаимодействуют с металлами. Более активные металлы (более активные восстановители) вытесняют менее активные из растворов их солей:
В этом примере ионы меди Cu 2+ являются окислителем, а цинк – восстановителем.
Активность металла определяется его положением в электрохимическом ряду напряжений металлов:
Li, Cs, К, Ва, Са, Na, Mg, Al, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Ag, Pt, Au.
Щелочные (Li, Na, K, Rb, Cs) и щёлочноземельные металлы (Ca, Sr, Ва) реагируют с растворами солей иначе. Сначала щелочной или щёлочноземельный металл реагирует с водой раствора соли:
2Na + 2H2O = 2NaOH + H2↑
Образовавшаяся щёлочь реагирует с раствором соли:
Так как в ходе первой реакции выделяется достаточное количество тепла, гидроксид меди (II) разлагается (свойство нерастворимых гидроксидов):
Cu(OH)2 = CuO + H2O
Поэтому вместо меди в такой реакции образуется смесь её оксида и гидроксида.
- Растворы солей реагируют со щелочами (см. конспект по химии «Неорганические основания»).
- Соли реагируют с кислотами (см. конспект по химии «Неорганические кислоты»).
- Растворы солей реагируют друг с другом, если в результате реакции выпадает осадок (образуется нерастворимая соль):
- Некоторые соли разлагаются при нагревании. Как правило, при нагревании разлагаются соли летучих кислот. Например, карбонаты (кроме карбонатов щелочных металлов) разлагаются с образованием углекислого газа и оксида металла:
Разложение нитратов при нагревании рассмотрено в конспекте «Нитраты».
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
- Реакция взаимодействия оснований с кислотами:
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
- Реакция основного оксида и кислоты:
MgO + H2SO4 = MgSO4 + H2O
- Реакция основания с кислотным оксидом:
- Реакция основного и кислотного оксида друг с другом:
MgO + SO3 = MgSO4
- Реакция металла с неметаллом (получение солей бескислородных кислот):
- Получение одних солей из других:
а) по реакции замещения:
б) по реакции обмена (см. взаимодействие солей друг с другом):
MgI2 + HgSO4 = MgSO4 + HgI2↓
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
- Неполная нейтрализация двухосновных, трёхосновных, многоосновных кислот основаниями:
2NaOH + H3РO4 = Na2HPO4 + 2H2O
(в результате неполной нейтрализации образовался гидрофосфат натрия);
NaOH + H3РO4 = NaH2PO4 + H2O
(в результате неполной нейтрализации образуется дигидрофосфат натрия).
- Неполная нейтрализация кислотных оксидов, соответствующих двухосновным, трёхосновным, многоосновным кислотам, основаниями (так можно получить только соли кислородсодержащих кислот):
4NaOH + Р2O5 = 2Na2HPO4 + H2O
(в результате неполной нейтрализации образовался дигидрофосфат натрия);
2NaOH + Р2O5 + H2O = 2NaH2PO4
(в результате неполной нейтрализации образовался гидрофосфат натрия).
- Взаимодействие средних солей с соответствующими кислотами:
Na2SO4 + H2SO4 = 2NaHSO4
NaCl (тв.) + H2SO4 (конц.) = NaHSO4 + HCl↑
- Взаимодействие средних солей с оксидами, соответствующими многоосновным кислотам, в водных растворах:
СаСO3 + СO2 + H2O = Са(НСО3)2
(в данном примере взвесь СаСO3 постепенно исчезает, так как образуется хорошо растворимый гидрокарбонат кальция).
Кислые соли, как правило, растворимы лучше соответствующих им средних. Так, например, гидрокарбонат кальция Са(НСО3)2 растворим в воде, в то время как карбонат кальция практически нерастворим.
- Кислые соли нестабильных кислот разлагаются при нагревании с образованием средних солей:
- Кислую соль можно перевести в среднюю, обработав её эквивалентным количеством щёлочи:
- Кислые соли вступают в такие же реакции, как и средние, например в обменные реакции солей друг с другом:
Образец выполнения задания ОГЭ
Задание. И сульфат меди (II), и нитрат серебра взаимодействуют
- 1) с хлоридом калия
- 2) с соляной кислотой
- 3) с оксидом магния
- 4) с железом
Решение. Хлорид калия, сульфат меди (II), нитрат серебра – соли. Растворимые соли взаимодействуют друг с другом, если в результате реакции один из продуктов реакции выпадает в осадок (т. е. образуется малорастворимое в воде вещество). В случае взаимодействия нитрата серебра с хлоридом калия действительно образуется осадок (белый творожистый осадок хлорида серебра):
Но сульфат меди (II) с хлоридом калия не взаимодействует, в данном случае связывания ионов в растворе не происходит. Таким образом, вариант 1 не подходит.
Соляная кислота – сильный электролит. Сильные кислоты взаимодействуют с солями слабых кислот, вытесняя их из солей. Но сульфат меди (II) – соль сильной серной кислоты, а нитрат серебра – соль сильной азотной кислоты. Серная кислота может вытеснить азотную и соляную кислоты из кристаллических солей (не в растворах), так как HNO3 и НCl – летучие кислоты, а серная – нелетучая. Соляная кислота вытеснить серную или азотную не может. Поэтому вариант 2 не подходит.
С оксидами соли взаимодействуют в редких случаях. Например, карбонаты при сплавлении взаимодействуют с оксидом кремния (IV). Средние соли при взаимодействии в растворе с кислотными оксидами соответствующих кислот превращаются в кислые соли (если такие для данных кислот существуют). В данном примере оксид магния не взаимодействует ни с сульфатом меди (II), ни с нитратом серебра. Ответ 3 не подходит.
Обе соли взаимодействуют с железом. Железо находится в электрохимическом ряду напряжений металлов до меди и до серебра:
Правильный ответ – 4 (с железом).
Конспект урока по химии в 8 классе «Соли: классификация, свойства, получение». Выберите дальнейшее действие:
Источник