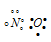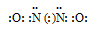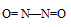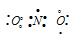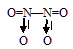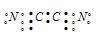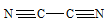Описание с позиций метода валенттных связей (ВС) электронное строение молекул и ионов
Задача 236.
Описать с позиций метода ВС электронное строение молекулы BF3 и иона BF4 — .
Решение:
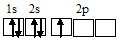
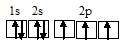
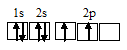
Электронная конфигурация валентного слоя атома бора 1s 2 2s 2 2p 1 . Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
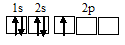
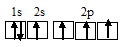
При возбуждении атом бора переходит в состояние 1s 2 2s 1 2p 2 , а электронное строение его валентного слоя соответствует схеме:
Три неспаренных электрона возбуждённого атома могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами фтора (1s 2 2s 2 2р 5 ), имеющими по одному неспаренному электрону, с образованием молекулы BF3.
Для образования иона BF4 — должен присоединиться один ион (1s 2 2s 2 2р 6 ), все валентные электроны которого спарены. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов из фторид-иона и одной валентной p-орбитали атома бора.
Задача 237.
Сравнить способы образования ковалентных связей в молекулах CH4, NH3 и в ионе NH4 + . Могут ли существовать ионы CH5 + и NH4 2+ ?
Решение:
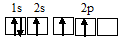
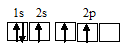
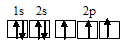
Электронная конфигурация атома углерода 1s 2 2s 2 2р 2 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
При возбуждении атом углерода переходит в состояние 1s 2 2s 1 2р 3 , а электронное строение его валентных орбиталей соответствует схеме:
Четыре неспаренных электрона возбуждённого атома углерода могут участвовать в образовании четырёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному, с образованием молекулы CH4.
Электронная конфигурация атома азота 1s 2 2s 2 2р 3 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Три неспаренных электрона невозбуждённого атома азота могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному электрону, с образованием молекулы NH3.
Для образования иона NH4 + к молекуле NH3 должен присоединиться один ион H + (1s 0 ), имеющим одну свободную s-орбиталь. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов атома азота и одной вакантной s-орбитали атома водорода.
Углерод (1s 2 2s 2 2р 2 ) может образовать соединение CH4, но при этом валентные возможности углерода будут исчерпаны (нет неспаренных электронов, неподелённых пар электронов и валентных орбиталей на валентном энергетическом уровне), ион CH5 + образоваться не может.
Азот (1s 2 2s 2 2р 3 ) может образовать соединение NH3 (за счёт трёх неспаренных 2р-электронов) и ион NH4 + (за счёт донорно-акцепторного механизма между молекулой NH3 и ионом H +) , но при этом валентные возможности азота будут исчерпаны (нет неподелённых пар электронов, свободных валентных орбиталей и неспаренных электронов на валентном уровне), ион NH5 2+ образоваться не может.
Задача 238.
Какой атом или ион служит донором электронной пары при образовании иона BH4 — ?
Решение:
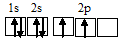
Электронная конфигурация атома бора 1s 2 2s 2 2р 1 . Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
При возбуждении атом бора переходит в состояние 1s 2 2s 1 2p 2 , а электронное строение его валентного слоя соответствует схеме:
Три неспаренных электрона возбуждённого атома бора могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному электрону, с образованием молекулы BH3.
Для образования иона BH4 — к молекуле BH3 должен присоединиться ион H — (1s 2 ), имеющий на валентном уровне свободную пару электронов. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов иона и свободной (вакантной) 2р-орбитали.
Задача 239.
Объяснить с позиций метода ВС способность оксидов NО и NО2 образовывать димерные молекулы.
Решение:
На внешнем электронном слое атома азота содержится два спаренных 2s-электрона и три неспаренных 2р-электрона (2s 2 2р 3 ). Атом кислорода на внешнем слое содержит пару 2s-электронов и четыре 2р-электрона, из которых два неспаренных (2s 2 2р 4 ).
а) В молекуле NO связь осуществляется по обычному ковалентному механизму за счёт двух неспаренных электронов атома азота и двух неспаренных электронов атома кислорода, с образованием двух ковалентных связей в молекуле. Электронная схема молекулы NO имеет вид:
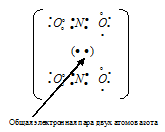
Таким образом, в молекуле NO атом азота содержит один неспаренный 2р-электрон. Поэтому между двумя молекулами N2О2 может образоваться ковалентная связь по обычному механизму. Валентная схема молекулы N2О2 имеет вид:
В димере N2О2 атомы азота и имеют восьмиэлектронную устойчивую конфигурацию. Структурная формула имеет вид:
б) В молекуле NO2 атом азота соединён двумя ковалентными связями с одним атомом кислорода, находящимся в невозбуждённом состоянии, связь образуется за счёт двух неспаренных электронов атома азота и двух неспаренных электронов атома кислорода. Второй атом кислорода соединяется с атомом азота по донорно-акцепторному механизму за счёт пары электронов атома азота и свободной валентной 2р-орбитали атома кислорода. Молекула NO2 содержит один неспаренный электрон у атома азота.
Две молекулы NO2 могут соединиться друг с другом, образовав димер N2O4. Связь между двумя молекулами NO2 образуется по обычному ковалентному механизму за счёт неспаренных электронов атомов азота. Валентная схема димера N2O4 имеет вид:
Задача 240.
Объяснить с позиций метода ВС возможность образования молекулы С2N2.
Решение:
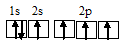
Электронная конфигурация атома углерода 1s 2 2s 2 2р 2. Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
При возбуждении атом углерода переходит в состояние 1s 2 2s 1 2р 3 , а электронное строение его валентных орбиталей соответствует схеме:
Электронная конфигурация атома азота 1s 2 2s 2 2р 3 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Для образования молекулы C2N2 к каждому атому углерода присоединяется по одному атому азота. Связи между атомами углерода и азота образуются за счёт трёх неспаренных электронов углерода и трёх неспаренных электронов азота. Оставшийся неспаренный электрон одного атома углерода образует ковалентную связь по обычному механизму с неспаренным электроном другого атома углерода. Таким образом, в молекуле C2N2 два атома углерода образуют ковалентную связь между собой и по три ковалентные связи с атомом азота по обычному механизму. Валентная схема молекулы C2N2 будет иметь вид:
Таким образом, молекула C2N2 реально существует.
Источник
Химические связи
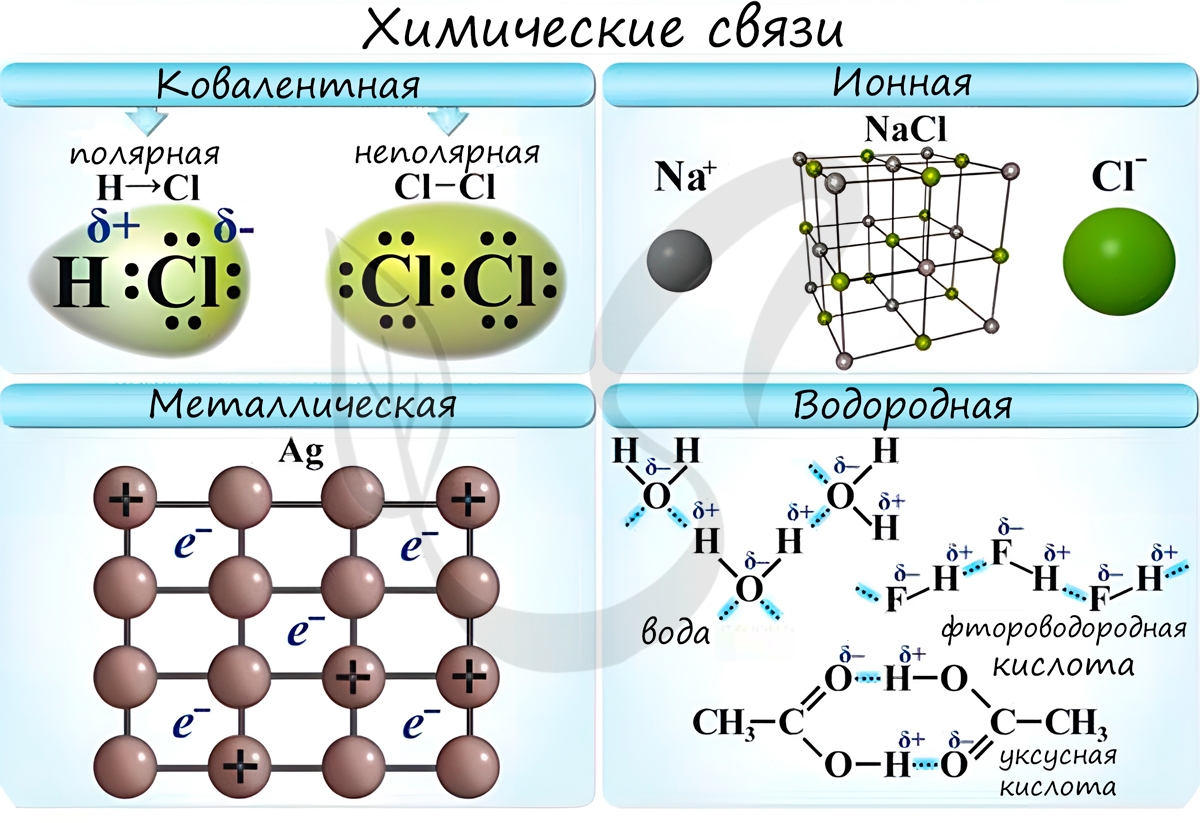
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
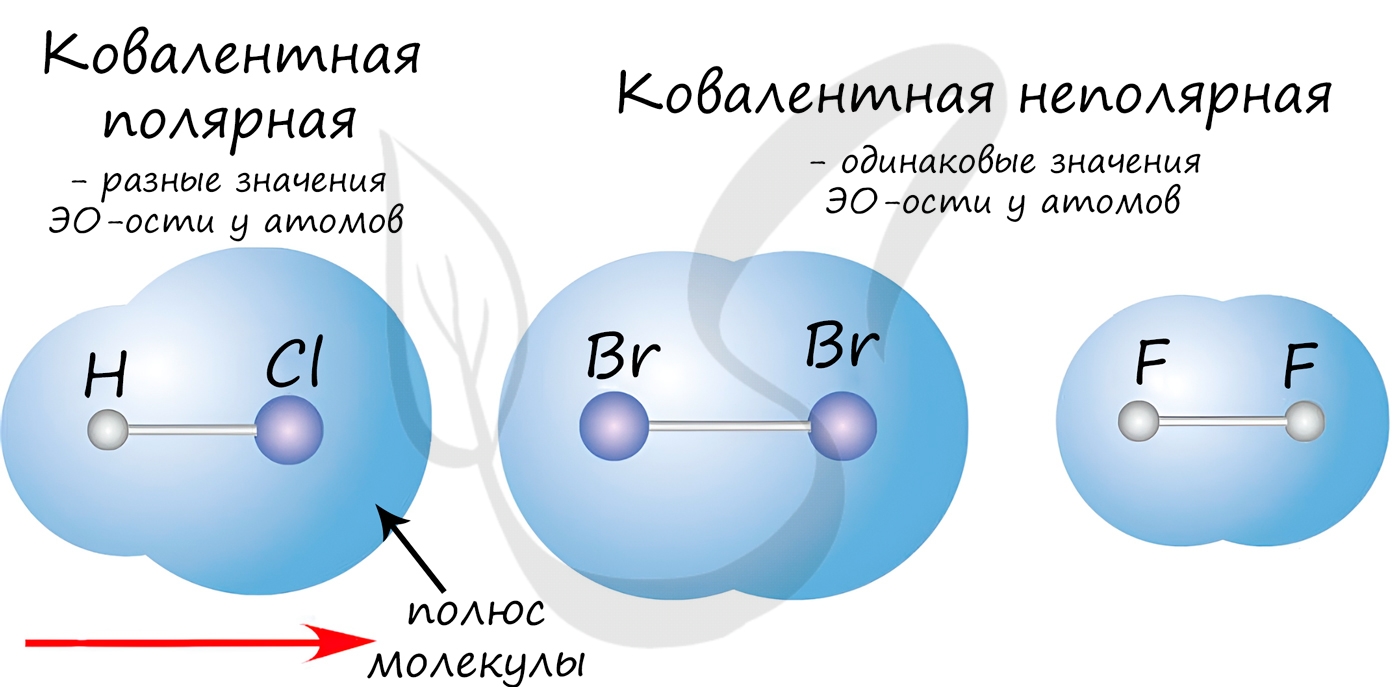
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково» вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4 + — в ионе аммония
- NH4 + Cl, NH4 + Br — внутри иона аммония во всех его солях
- NO3 — — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O + — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
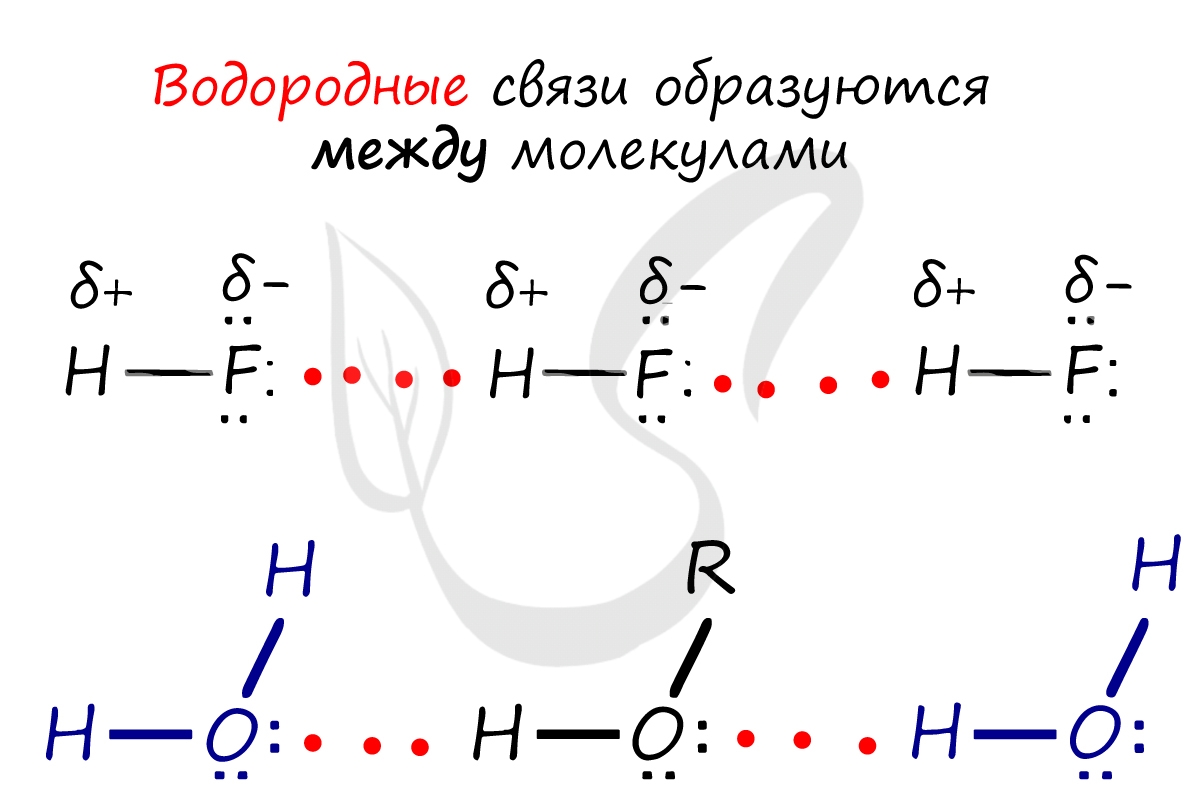
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник