Способы образования ковалентной связи 10 класс
Ключевые слова конспекта: Ковалентная неполярная и полярная связь. Электроотрицательность. Кратность ковалентной связи. Обменный и донорно–акцепторный механизмы образования ковалентных связей. Полярность связи. Полярность молекулы. Молекулярные и атомные кристаллические решётки.
Все органические соединения (их более 100 миллионов!) построены за счёт ковалентной химической связи. Однако и неорганических соединений с ионной связью меньше, чем с ковалентной.
Теорию ковалентной связи в 1916 г. предложил американский химик Гилберт Льюис. Он объяснил, как возникает химическая связь в двухатомных молекулах водорода Н2, азота N2, кислорода O2, галогенов (F2, Сl2, Вг2, I2).
Вспомним механизм образования некоторых двухатомных молекул на примере водорода и хлора.
Атом водорода на единственной s-орбитали содержит один электрон. Два атома объединяют непарные электроны в общую пару. Следовательно, у атомов водорода в распоряжении уже два электрона, т. е. их электронная оболочка завершена до устойчивой двухэлектронной оболочки благородного газа гелия.
В структурных формулах общая электронная пара обозначается чёрточкой.
| Ковалентной , или атомной химической связью , называется связь между атомами за счёт образования общих электронных пар. |
Условно этот процесс можно представить следующим образом. При сближении двух атомов водорода происходит перекрывание их сферических s-орбиталей до тех пор, пока сила отталкивания ядер не будет равна силе притяжения между ядром одного атома и электроном другого. Место взаимопроникновения орбиталей называется электронной плотностью. Это область пространства, где сосредоточен повышенный отрицательный заряд.
Атомы хлора в основном состоянии содержат неспаренный электрон не на s-, а на р-орбитали. В молекуле хлора Сl2 образование химической связи, т. е. общей электронной пары, происходит за счёт перекрывания р-орбиталей.
Атомы в молекулах водорода и хлора образовали одну общую электронную пару. Такая ковалентная связь называется простой или одинарной.
Иначе образуется химическая связь между двумя атомами азота, имеющими на внешнем энергетическом уровне по пять валентных электронов. До устойчивой восьмиэлектронной оболочки каждому атому не хватает трёх электронов, поэтому атомам придётся предоставить в общую копилку по три электрона и образовать три электронные пары:
Посчитайте: в молекуле азота каждый атом распоряжается восьмью электронами. Два атома азота в молекуле N2 связаны уже не одинарной, а тройной связью. Очевидно, что такая связь гораздо прочнее. Это и объясняет очень низкую реакционную способность азота.
Следовательно, по числу общих электронных пар, связывающих атомы в молекулы, т. е. по кратности, различают одинарную, двойную и тройную связи.
В рассмотренных примерах ковалентные связи образовывались между одинаковыми атомами, т. е. атомами одного элемента. Понятно, что эти два атома равноправны по отношению к общим электронным парам, которые симметрично располагаются между ядрами двух атомов. Такая химическая связь называется ковалентной неполярной.
| Ковалентная связь между атомами одного элемента называется ковалентной неполярной связью . |
Ковалентная связь может образоваться между двумя атомами, которые в соответствии с положением в периодической системе обладают различными неметаллическими свойствами. Усиление неметаллических свойств проявляется в стремлении атома оттянуть общую электронную пару к себе.
| Способность атомов химических элементов оттягивать к себе общие электронные пары ковалентной связи называется электроотрицательностью . |
Самым электроотрицательным элементом является фтор, за ним неметаллы располагаются следующим образом:
Между атомами разных химических элементов–неметаллов наблюдается аналогичный механизм возникновения ковалентной связи, например:
Однако в этом случае общие электронные пары смещаются в сторону более электроотрицательного элемента. В результате в молекуле НСl и СН4 на атомах хлора и углерода образуются избыточные отрицательные заряды, которые обозначаются δ – (греческая буква «дельта»), а атомы водорода с дефицитом электронной плотности несут частичные положительные заряды δ + :
| Ковалентная связь между двумя атомами с различной электроотрицательностью называется ковалентной полярной связью . |
Понятно, что между атомами с одинаковой электроотрицательностыо (атомами одного химического элемента-неметалла) образуется ковалентная неполярная связь.
В результате полярности связи Н—Сl молекула хлороводорода представляет собой частицу с двумя противоположно заряженными полюсами — диполь.
Несмотря на то, что в молекуле метана каждая из связей С—Н полярна, она не является диполем. Причина в том, что молекула метана имеет форму правильного тетраэдра, а потому полярность всех связей взаимно компенсируется.
Следовательно, полярность молекулы определяется двумя факторами: полярностью связей в молекуле и её геометрией.
Например, молекулы воды — диполи, имеющие угловую форму:
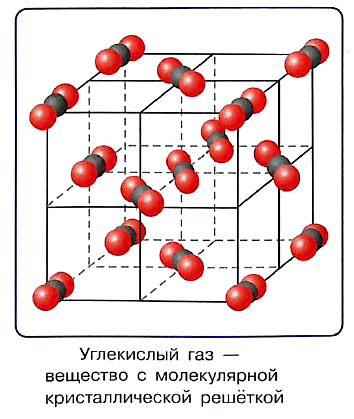
Наоборот, линейные молекулы СО2 (углекислого газа) неполярны: 
В рассмотренных примерах при образовании полярных и неполярных молекул был реализован обменный механизм возникновения ковалентной связи: каждый из участвующих атомов предоставлял другому на паритетных началах свои непарные электроны, образуя таким образом общие (поделённые) электронные пары. Однако имеется ещё один механизм образования ковалентной связи — донорно-акцепторный.
Рассмотрим его на примере строения катиона аммония NH4 + .
В молекуле аммиака NH3 по обменному механизму образуется три ковалентные полярные связи N—Н. В результате атом азота получает завершённый внешний слой из восьми электронов, в котором имеется собственная пара электронов, называемая неподелённой. К ней может присоединиться атом водорода, потерявший свой единственный электрон — катион водорода Н + . Образуется четвёртая связь N—Н, при этом атом азота, предоставивший для её образования свою пару электронов, называется донором, а катион водорода со свободной орбиталью — акцептором. Получившаяся при этом частица несёт положительный заряд и называется катионом аммония:
В результате образования ковалентных связей возникают молекулы. Такая связь преобладает в химических соединениях и значит все они имеют молекулярное строение. Это почти 100 млн органических соединений, большинство веществ, которые при обычных условиях представляют собой газы и жидкости, а также некоторые твёрдые вещества, например ромбическая сера, белый фосфор.
Ковалентная связь определяет два типа решёток: молекулярные и атомные.
В узлах кристаллической решётки вещества молекулярного строения находятся молекулы этого вещества, поэтому кристаллическая решётка такого типа называется молекулярной.
Молекулярную кристаллическую решётку имеют вода, большинство органических веществ, кристаллический йод, сера, почти все переведённые в твёрдое состояние жидкие и газообразные вещества, например «сухой лёд» — твёрдый углекислый газ.
Атомы в молекулах таких веществ связаны достаточно прочными ковалентными связями, а вот между молекулами связи значительно более слабые (вандерваальсовы силы). Разрушить молекулярную кристаллическую решётку нетрудно, поэтому соединения такого строения обычно легкоплавкие, летучие, часто обладают запахом.
Ковалентные связи могут приводить к образованию веществ не только молекулярного, но и атомного строения, т. е. с атомными кристаллическими решётками. В узлах таких кристаллических решёток располагаются отдельные атомы, связанные между собой очень прочными ковалентными связями. Атомная кристаллическая решётка характерна для некоторых простых веществ, например, модификаций бора, кремния, углерода. Если каждый углеродный атом в решётке находится в центре тетраэдра и окружён четырьмя другими атомами углерода, с которыми связан ковалентными неполярными связями, образуется кристаллическая решётка алмаза.
Высокой твёрдости алмаза присвоен высший балл (10) по шкале Мооса.
Это свойство используется для изготовления абразивных (от фр. abrasif — шлифовальный) инструментов, которые предназначены для шлифования, полирования, бурения металлов, керамических материалов, горных пород и т. д. Отшлифованные алмазы — бриллианты — используются в ювелирном деле.
Однако атомы углерода в кристаллической решётке могут располагаться слоями, образуя правильные шестиугольники наподобие пчелиных сот. Между атомами углерода соседних слоёв расстояние больше, чем в слоях, поэтому и связи менее прочные. Такую решётку имеет графит.
Это приводит к тому, что графит, в отличие от алмаза, электропроводен и мягок, но обладает высокой тугоплавкостью. Его используют для изготовления электродов и замедлителей нейтронов в ядерных реакторах. При высоких температурах и давлении из графита получают технические алмазы. Способность оставлять след на бумаге — свойство, на котором основано применение карандашей.
Гораздо более характерны атомные кристаллические решётки для сложных веществ. К ним относятся минералы, основу которых составляют оксид алюминия (наждак, корунд, рубин, сапфир) и оксид кремния(IV) (кварц, кремнезём, горный хрусталь).
Конспект урока по химии «Ковалентная химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Источник
Способы образования и разрыва ковалентной связи. Типы реакционных частиц в органической химии
Тема: «Способы образования и разрыва ковалентной связи. Типы реакционноспособных частиц в органической химии»
Тип занятия: лекция
Цель:1. Рассмотреть способы образования и разрыва ковалентной связи. Познакомить учащихся с типами реакционноспособных частиц в органической химии.
2. Продолжить развитие понятий о типах химических реакций.
3. Воспитывать творческий интерес к предмету.
Оборудование и реактивы
Опрос опорных знаний
Изучение нового материала:
Обменный механизм образования ковалентной связи. Гомолитический разрыв связи;
Донорно – акцепторный механизм образования ковалентной связи. Гетеролитический разрыв связи;
Дайте определение реакций отщепления.
Какие реакции называют реакциями дегидрирования, дегидротации?
Какая разница между реакциями дегалогенирования и дегидрогалагенирования?
Сформулируйте определение реакций полимеризации.
Какой процесс называют окислением (восстановлением) в органической химии? Что при этом происходит?
Как соотносятся между собой реакции гидрирования и восстановления?
Работа по карточкам.
Ответы в-1 задание 1 а) полимеризация, б)замещение,в) отщепление, г)окисление. Зад 2. В. Зад 3 – отщепление, присоединение, замещение
В-2 зад 1 а) отщепление,б) замещение, в) изомеризации, г) присоединение. Зад 2 – г. зад 3 отщепление, присоединение,окисление, окисление
2. Изучение нового материала
1 . Способы разрыва ковалентной связи в органических соединениях
Для органических соединений наиболее характерна ковалентная связь и молекулярное строение. Существует два способа образования ковалентной связи: обменный и донорно-акцепторный. Первый предполагает обобществление по одному неспаренному электрону каждого атома. По второму способу один атом (донор) представляет для образования связи неподеленную пару электронов, а второй (акцептор) – свободную (вакантную) орбиталь. В обоих случаях между атомами возникает ковалентная связь за счет образования общей электронной пары.
Сущность любой химической реакции заключается в образовании новых молекул, из тех же самых атомов, из которых были образованны исходные вещества. Следовательно, одни химические связи должны разорваться, другие – образоваться. Формально разрыв ковалентной химической связи – это процесс, обратный ее образованию:
На доске: А:В↔А∙+В∙ и А:В↔А + □+В — :
В результате разрыва (схема) химической связи могут образовываться как частицы с неспаренным электроном (атомы или радикалы), так и заряженные частицы – ионы(катионы и анионы). В первом случае первая пара электронов «поровну» делиться между связанными атомами. Такой разрыв называется ГОМОЛИТИЧЕСКИМ. Во втором случае оба электрона ковалентной связи остаются у одного атома, атома более электроотрицательного элемента. Это гетеролитический разрыв связи.
2 . Типы реакционноспособных частиц в органической химии
Как правило осколки молекулы(радикалы и ионы), образующиеся после разрыва связи, живут очень короткое время. Они стабилизируются, образуя связи с другими атомами и группами, т.е. проявляют ВЫСОКУЮ РЕАКЦИОННУЮ СПОСОБНОСТЬ. Однако эти реакционноспособные частицы в прямом смысле разборчивы в своих связях. Для стабилизации радикала ему нужна частица с неспаренным электроном. Анион или атом с неподеленной парой электронов ищет для образования связи атом с вакантной орбиталью. Катиону необходим «партнер» с избытком электронной плотности. Поэтому все реагенты в органической химии делятся на три группы: R∙ радикальный реагент (радикал); А + электрофильный реагент (электрофил те же катионы или молекулы, имеющие пустую орбиталь, атакующие в молекуле субстрата места с повышенной электронной плотностью), электро + фил= любящий электрон, отрицательный заряд; В — : — нуклеофильный реагент (нуклеофил он же анион или молекулы, имеющие неподеленную электронную пару и взаимодействующие с участками молекулы субстрата на которых сосредоточен частичный положительный заряд ), нуклеос+фил=любящий протон, положительный заряд. Пример СН3→ОН+:Br — →
3 . Взаимное влияние атомов в молекулах органических соединений
Назовите основные положения теории строения органических соединений А.М. Бутлерова( Атомы в молекулах соединяются в определенной последовательности согласно их валентности.
Химические свойства веществ определяются не только их составом, но и строением (структурой). Строение вещества можно отобразить структурной формулой, которая для него будет единственной. Если у веществ с одинаковым составом разное строение возникает явление изомерии.
По химическим свойствам соединения можно предположить его строение, и наоборот – по строению — химические свойства.) .
На этом занятии мы детально рассмотрим 3-е положение – о взаимном влиянии атомов в молекуле. В одной из научных статей в 1863г А.М Бутлеров писал: «Атомы водорода, соединенные с углеродом, ведут себя относительно реагентов…иначе, чем соединенные с кислородом». Пример : молекулярная формула метилового спирта СН4О. Три атома водорода в молекуле этого вещества связанны с углеродом, а один – с атомом кислорода, что наглядно демонстрирует структурная формула:Н-С(Н2)-О-Н
Очевидно, что три атома водорода метильной группы в химических реакциях будут вести себя иначе, чем водород гидроксильной группы. Вопрос : какой тип связи между атомами в молекуле метанола?(ковалентный полярный) какой из трех элементов наиболее электроотрицателен, а какой – наименее?(О2 И Н2). Какая связь в молекуле является самой полярной? (связь О-Н, т.к разность электроотрицательностей этих элементов максимальна. Смещение электронной палотности вдоль линии сигма связей в молекуле называют индуктивным эффектом и часто изображают стрелками: схема на доскеН → С → О ← Н.
Рассмотрим молекулу метилового спирта как сочетание двух групп: метильной и гидроксильной. Обе группы оказывают друг на друга определенное влияние за счет полярности связи между ними. Гидроксильная группа притягивает к секбе электронную плотность ковалентной связи. Такое влияние называют отрицательным индуктивным эффектом и обозначают (- I ). Метильная группа подает электронную пару более электроотрицательному кислороду, т.е обладает положительным индуктивным эффектом (+ I ). В результате на атоме кислорода образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный.
В метане по сравнению с метанолом атом углерода не имеет заряда ᵟ+, т.к атом водорода не обладает отрицательным индуктивным эффектом. Величина заряда ᵟ- на атоме кислорода в воде меньше, чем в метиловом спирте, т.к. отсутствует + I эффект метильной группы.
Индуктивный эффект быстро затухает в цепочке атомов. Вместе с тем существуют электронные эффекты, распространяющиеся на большое число атомов в цепочке. Такие эффекты называются мезомерными, они связанны со смещением электронной плотности кратных связей или неподеленных пар электронов. Объясняю понятие положительного мезомерного эффекта на примере хлорэтена. Атом хлора более электроотрицателен, чем атом углерода, он обладает отрицательным индуктивным эффектом. Вместе с тем у хлора имеется неподеленная пара электронов на р-орбитали. В непосредственной близости с атомом хлора расположена двойная связь.в результате отталкивания от р-электронов галогена электронная плотность двойной связи смещается к дальнему углеродному атому. Такой эффект атома хлора называется положительным мезомерным. Схема:
В результате положительного мезомерного эффекта хлора двойная связь поляризуется, что определяет ее реакционную способность, например в реакциях присоединения. Существуют также функциональные группы обладающие отрицательным мезомерным эффектом но с ним мы познакомимся немного позже.
4. Понятие о механизме химической реакции
Рассмотрение механизмов реакций в органической химии начинаю с повторения вопроса о реакционных частицах и типах реакций. Учащиеся вспоминают понятия реакций замещения, присоединения, элиминирования, классифицируют реакционные частицы на радикальные, нуклеофильные и электрофильные.юбой химической реакции происходит разрыв одних химических связей и образование других. Связь в исходном соединении (субстрате) может разрываться под действием:
В зависимости от того, какие реакционные частицы участвуют в процессе и что происходит с субстратом, различают несколько основных механизмов реакций в органической химии, они перечислены в учебнике.
Механизм – это последовательность отдельных стадий с указанием промежуточных частиц, образующихся на каждой из этих стадий. При изучении отдельных классов веществ некоторые из названных механизмов будут рассмотрены подробно. На данном этапе поясняю, что реакции радикального замещения или присоединения происходят под действием свободных радикалов, нуклеофильные реакции – с участием нуклеофильных реагентов, а электрофильные предполагают начальную атаку субстрата электрофилом.
Источник