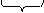- Механизм образования двойного электрического слоя на границе раздела фаз
- Лако-красочные материалы — производство
- Технологии и оборудование для изготовления красок, ЛКМ
- Механизм образования двойного электрического слоя
- 4.1.1. Механизм образования двойного электрического слоя
- 1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- Адсорбционный механизм образования дэс
- Механизм поверхностной диссоциации
- 2. Специфическая адсорбции ионов на поверхности твердой фазы
Механизм образования двойного электрического слоя на границе раздела фаз



Образование двойного электрического слоя возможно в результате ориентационного, индукционного или дисперсионного взаимодействия молекул, расположенных на поверхностях соприкасающихся фаз. В этом случае поверхность одной из соприкасающихся фаз заряжается положительно, другой – отрицательно (рис. 18).
| |
| |
 | |
 | |
 |
Рис. 18. Модель образования двойного электрического слоя на границе раздела фаз в результате индукционного взаимодействия:
а) поверхности двух фаз до контакта; б) образование двойного электрического слоя
Положительный заряд несет поверхность, вещество которой имеет большую диэлектрическую проницаемость. Так происходит с водой, поверхность которой заряжается положительно при контакте с поверхностью менее полярных веществ (рис. 18).
Другой путь возникновения двойного электрического слоя реализуется в результате избирательной адсорбции катионов или анионов на границе раздела фаз твердое тело – раствор электролита. Так происходит образование устойчивого золя (высокодисперсной коллоидной системы) йодистого серебра в результате обменной реакции:
Ag + (р-р)+NO3 — (р-р) + K + (р-р) + I — (р-р) ® AgI(т)¯+ K + (р-р) + NO3 — (р-р),
Ag + (р-р) + I — (р-р) ® AgI(т)¯.
На поверхности твердой частицы избирательно адсорбируются только те ионы, которые способны достроить её кристаллическую решетку (правило Панета-Фаянса). Если одна из солей, участвующая в обменной реакции, взята в избытке, например, избыток AgNO3 по отношению к KI – образуются микрокристаллы AgI (ядра) в окружении родственных кристаллической решетке положительно заряженных ионов серебра. Ионы серебра «достраивают» кристаллическую решетку уже в отсутствие ионов йода. Формируется мицелла (рис. 19), состоящая из ядра и двойного электрического слоя:
 |
ядро двойной электрический слой
где m — количество ионных пар в структуре ядра, n — количество потенциалопределяющих ионов, у — количество противоионов в диффузной части двойного электрического слоя.
 |
|


 |
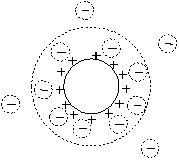
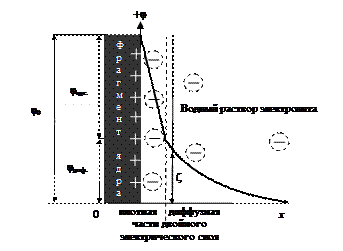
Рис. 20. Модель распределения зарядов в двойном электрическом слое мицеллы йодистого серебра в водном растворе, содержащем избыток AgNO3; х – расстояние от поверхности частицы в объем жидкой фазы
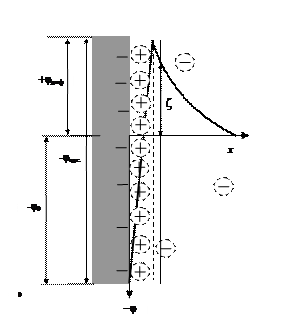
Двойной электрический слой, окружающий ядро, включает ионы адсорбционного и диффузного слоя (рис. 20). По мере удаления от поверхности твердого тела на расстояние (х) в объем электролита наблюдается падение разности потенциалов между твердой и жидкой фазами. Полное падение потенциала в двойном электрическом слое называется термодинамическим потенциалом j0. Он включает скачки потенциалов адсорбционной (плотной) и диффузной частей двойного электрического слоя:
Полная компенсация заряда твердой поверхности суммарным зарядом противоионов происходит на расстоянии х, где заканчивается диффузионный слой.
Адсорбционный слой противоионов примыкает к заряженной поверхности твердой частицы и имеет толщину гидратированного иона (гидратированные ионы адсорбционного слоя обведены пунктирными кружками). Ядро с адсорбционным слоем прочно связано электростатическими и адсорбционными силами и образует единое целое – заряженную микрочастицу коллоидного раствора, которая свободно перемещается в дисперсионной среде независимо от диффузного слоя. При движении частицы золя разрывается двойной электрический слой на так называемой границе скольжения. Граница скольжения лежит между адсорбционным и диффузным слоем или несколько удаляется от адсорбционного в диффузный слой. В последнем случае частица «захватывает» при своем движении некоторое количество противоионов диффузного слоя. Дзета-потенциал (z) – потенциал границы скольжения. Он определяет скорость перемещения дисперсной фазы относительного дисперсионной среды (рис. 20).
При избытке в растворе ионов йода (по отношению к ионам серебра) строение мицеллы изменяется:

 |
 |  |
ядро двойной электрический слой
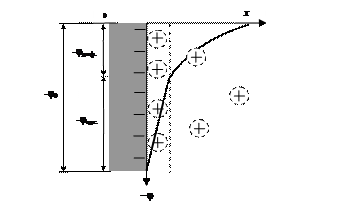
Рис. 21. Модель распределения зарядов в двойном электрическом слое мицеллы йодистого серебра в водном растворе, содержащем избыток КI; х – расстояние от поверхности в объем жидкой фазы
По цвету золь йодистого серебра напоминает молоко. Частицы золя имеют размеры, соответствующие высокодисперсной системе (10 — 9 ¸ 10 — 7 м). Они не оседают из-за небольшой массы и не слипаются в силу того, что имеют одинаковый знак заряда частиц золя.
Обратим еще раз внимание на правило Панета-Фаянса: на поверхности частиц золя адсорбируются родственные кристаллу ионы серебра или йода, и лишь затем располагаются противоионы.
Знак и величина заряда частицы зависят в существенной степени от специфической адсорбции потенциалоопределяющих ионов. Может оказаться, что адсорбционные силы и концентрация противоионов настолько высока, что происходит перезарядка частиц золя. В этом случае дзета-потенциал изменяет свой знак (рис. 22).
Рис. 22. Изменение z-потенциала поверхности при перезарядке частиц золя
Так происходит, если к золю йодистого серебра
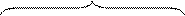 |
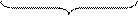 |
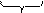 |
ядро двойной электрический слой
добавить, например, нитрат железа Fe(NO3)3. Ионы Fe 3+ обладают высокой адсорбционной способностью. Они будут входить в адсорбционный (плотный) слой вместе с ионами К + в таком количестве, что изменят знак заряда частицы золя. При этом ионы Fe 3+ не способны достраивать кристаллическую решетку частиц золя в силу действия известного правила Панета-Фаянса, т.к. не имеют никакого сходства по размеру (неизоморфны) с ионами серебра Ag + , входящими в ионную кристаллическую решетку частиц золя: Мицелла
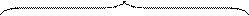 |
Источник
Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Механизм образования двойного электрического слоя
В курсе коллоидной химии рассматривается общая теория двойного электрического слоя и электрических межфазных явлений, значение которых выходит за рамки данной науки. Кроме ионообменной адсорбции, электрокинетических явлений, стабилизации и коагуляции дисперсных систем и других процессов, изучаемых в курсе коллоидной химии, электрические межфазные явления в значительной мере определяют электродные процессы (электрохимия), процессы массопереноса через межфазную поверхность, каталитические, мембранные, биологические процессы, обусловливают свойства полупроводниковых и других материалов.
Возникновение двойного электрического слоя на межфазных поверхностях, как и адсорбция, является результатом взаимодействия соприкасающихся фаз благодаря избыточной поверхностной энергии. Стремление гетерогенной системы к уменьшению поверхностной энергии вызывает определенное ориентирование полярных молекул, ионов и электронов в поверхностном слое, вследствие чего соприкасающиеся фазы приобретают заряды противоположного знака, но равной величины. В результате на поверхности возникает двойной электрический слой, обусловливающий различные электроповерхностные явления. Увеличение межфазного взаимодействия при возникновении двойного электрического слоя можно представить и как снижение поверхностного натяжения благодаря взаимному отталкиванию одноименных зарядов, концентрирующихся на поверхности со стороны каждой фазы, что уменьшает стягивающие силы в поверхностном слое.
Различают три возможных механизма образования двойного электрического слоя. Согласно одному из них двойной электрический слой образуется в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация). Например, с поверхности металла в газовую фазу переходят электроны, создавая электронное облако со стороны газовой фазы. Количественной характеристикой такого перехода может служить работа выхода электрона. Интенсивность электронного потока увеличивается с повышением температуры (термоэлектронная эмиссия). В результате поверхность металла приобретает положительный заряд, а газовая фаза — отрицательный. Возникший электрический потенциал на границе раздела фаз препятствует дальнейшему переходу электронов — наступает равновесие, при котором положительный заряд поверхности металла скомпенсирован отрицательным зарядом, созданным электронами в газовой фазе, т. е. формируется двойной электрический слой.
Двойной электрический слой образуется, например, на межфазной поверхности между водой и малорастворимым иодидом серебра. При растворении иодида серебра в воду преимущественно переходят катионы серебра, так как они сильнее гидра — тируются, чем иодид-ионы. В результате поверхность иодида серебра будет иметь некоторый избыток отрицательных ионов иода (потенциалопределяющих ионов), который нейтрализуется избытком положительных ионов серебра в прилегающем водном слое (противоионов). Если же в воду добавить хорошо растворимый нитрат серебра, увеличивается электрохимический потенциал ионов серебра. Вследствие этого с поверхности иодида серебра в воду будут переходить преимущественно иодид — ионы и поверхность соли зарядится положительно (избыток катионов серебра), а иодид-ионы будут выступать в качестве противоионов. Иногда такой процесс перехода ионов одного знака из одной фазы в другую рассматривают как автоадсорбцию (адсорбция одноименных ионов). Для определения заряда поверхности используют правило Фаянса — Панета, согласно которому структуру кристаллической решетки могут достраивать только те ионы, которые входят в ее состав.
Преимущественный переход тех или иных ионов с поверхности вещества в раствор количественно можно характеризовать изоэлектрической точкой (ИЭТ), т. е. отрицательным логарифмом концентрации потенциалопределяющего иона, при которой суммарный электрический заряд на поверхности равен нулк». (в отсутствие посторонних ионов):
ИЭТ+= — !gf+ или ИЭТ_= — lgc (П.9#
Где с _ и с_ — концентрации нотеициалопределяющих ионов в растворе, находящемся в равновесии с малорастворимым электролитом, когда числа положительных и отрицательных зарядов на поверхности одинаковы.
Изоэлектрическая точка непосредственно связана с произведением растворимости:
RiP=cv++cv-_ или lg ПР= + lg c+-f V — lg с_ (11.91) где v+ и v_ — стехиометрические коэффициенты ионов. С учетом соотношения (11.90) получим:
РПР= — lg ПР=чИЭТ+ +V-ИЭТ — Ш.92>
Электрический заряд поверхности иодида серебра в водном растворе равен нулю при концентрации ионов иода в растворе, равной Ю-10 6 М. Зная произведение растворимости Agl, равное « Ю-1® (25°С), можно определить и концентрацию ионов серебра при нулевом потенциале поверхности, т. е.
Или записать в виде изоэлектрических точек по катиону или аниону: ИЭТд8+ = 5,4 и ИЭТГ = Ю,6« Полученные значения характеризуют различие в стремлении ионов перейти в раствор. Оно выражено сильнее, как уже упоминалось, у ионов серебра. Чтобы поверхность зарядилась положительно, концентрация ионов серебра должна составлять >10
Источник
4.1.1. Механизм образования двойного электрического слоя
При погружении твердой фазы в раствор электролита происходят следующие явления: между твердой фазой и раствором возникает двойной электрический слой, появляется вполне определенная разность потенциалов между поверхностью дисперсной фазы и дисперсионной средой. Образование двойного электрического слоя можно объяснить рядом причин:
1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
С термодинамической точки зрения возникновение ДЭС на границе твердое тело – раствор может быть связано с неравенством электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе: 
Электрохимический потенциал – химический потенциал плюс электрохимическая составляющая 
Если электрохимические потенциалы одного и того же иона в твердой и жидкой фазе не одинаковы, то происходит перенос иона от большего электрохимического потенциала к меньшему до полного их выравнивания: 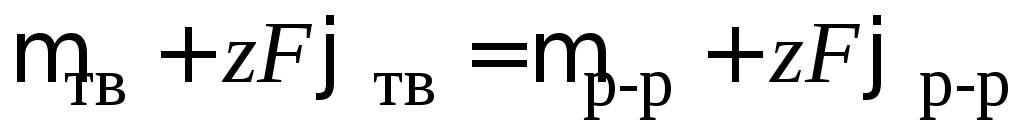
В рамках выравнивая электрохимических потенциалов, возможно два механизма образования ДЭС: адсорбционный и механизм поверхностной диссоциации.
Адсорбционный механизм образования дэс
Рис. 4.5. Мицелла золя иодида серебра
Рассмотрим адсорбционный механизм образования ДЭС на примере золя иодида серебра, полученного при избытке иодида калия по реакции:

При избытке KI электрохимический потенциал иодид-ионов в растворе больше электрохимического потенциала иодид-ионов на поверхности твердой фазы:

Иодид-ионы будут терять свою сольватную оболочку, и адсорбироваться на поверхности твердой фазы, заряжая частицу отрицательно. К отрицательно заряженной частице из раствора за счет электростатического притяжения будут притягиваться ионы противоположного знака (ионы калия), образуется двойной электрический слой. По аналогии со строением конденсатора вводится понятие внутренней и внешней обкладки ДЭС. Ионы, образующие внутреннюю обкладку и вызывающие возникновение потенциала – потенциалопределяющие ионы (ПОИ) – иодид-ионы; ионы, составляющие внешнюю обкладку – противоионы (ПИ) – ионы калия.
Механизм поверхностной диссоциации
Если электрохимический потенциал иодид ионов в кристаллической решетке твердой фазы больше, чем в объеме раствора 
2. Специфическая адсорбции ионов на поверхности твердой фазы
Возникновение ДЭС может быть результатом специфической адсорбции ионов на поверхности твердой фазы. Под специфической адсорбцией понимают накопление на поверхности твердой фазы ионов под действием адсорбционных сил.
Рис. 4.6. Потенциалопределяющие ионы – OH – ,
Так как адсорбционная способность анионов выше, чем у катионов, то на поверхности твердой частицы в результате специфической адсорбции может появиться адсорбционный слой анионов, которые притянут к себе катионы из раствора. Примером такой специфической адсорбции может являться адсорбция гидроксид-ионов на поверхности парафина (золь парафина в растворе щелочи).
Источник