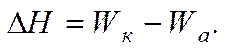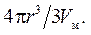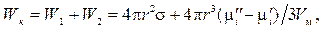- Методы получения ДИСПЕРСНЫХ СИСТЕМ
- Дисперсионные методы
- Методы конденсации
- Методыполучения свободнодисперсных систем (диспергирование, конденсация)
- ЛЕКЦИЯ №7
- План лекции:
- КЛАССИФИКАЦИЯ СПОСОБОВ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМ
- ДИСПЕРГИРОВАНИЕ
- ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ ЗА СЧЕТ КОНДЕНСАЦИОННЫХ ПРОЦЕССОВ
- МЕМБРАНЫ И МЕМБРАННЫЕ ПРОЦЕССЫ
- ПРИЧИНА МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИХ СВОЙСТВ
- БРОУНОВСКОЕ ДВИЖЕНИЕ
- ДИФФУЗИЯ
Методы получения ДИСПЕРСНЫХ СИСТЕМ



Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования (в отдельную группу выделяется метод пептизации, который будет рассмотрен позднее). Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц.
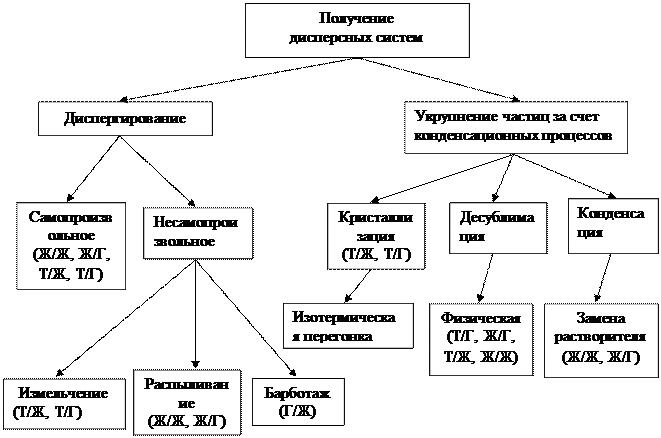
Рис. Классификация способов получения дисперсных систем (в скобках указан вид систем)
Дисперсионные методы
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.
Диспергирование может быть самопроизвольное и несамопроизвольное. Самопроизвольное диспергирование характерно для лиофильных систем и связано с ростом беспорядка системы (когда из одного большого куска образуется много мелких частиц). При диспергировании при постоянной температуре рост энтропии должен превышать изменение энтальпии.
В отношении лиофобных систем самопроизвольное диспергирование исключено, поэтому диспергирование возможно лишь путем затраты определенной работы или эквивалентного количества теплоты, которое измеряется, в частности, энтальпией.
Изменение энтальпии в изобарно-изотермическом процессе определяется соотношением между работой когезии Wки работой адгезии Wа. Энергия (работа) когезии Wкхарактеризует связь внутри тела, а энергия (работа) адгезии Wа — связь его с окружающей средой.
Энергию образования новой поверхности можно выразить через энтальпию, которая имеет вид:
Уравнение показывает изменение энтальпии в результате диспергирования. Для лиофильных систем, способных к самопроизвольному диспергированию, когда ΔS > 0, из условия следует, что ΔH 0) соответствуют увеличению энергии Гиббса:
Процесс диспергирования в этом случае является типично несамопроизвольным и осуществляется за счет внешней энергии.
Диспергирование характеризуется степенью диспергирования. Она определяется отношением размеров исходного продукта и частиц дисперсной фазы полученной системы. Степень диспергирования можно выразить следующим образом:
где dн; dк; Bн; Bк; Vн; Vк — соответственно диаметр, площадь пoвepxнocти, объем частиц до и после диспергирования.
Таким образом, степень диспергирования может быть выражена в единицах размера (α1), площади поверхности (α2) или объема (α3) частиц дисперсной фазы, т.е. может быть линейной, поверхностной или объемной.
Работа W, необходимая для диспергирования твердого тела или жидкости, затрачивается на деформирование тела Wди на образование новой поверхности раздела фаз Wа, которая измеряется работой адгезии. Деформирование является необходимой предпосылкой разрушения тела. Согласно П.А. Ребиндеру работа диспергирования определяется по формуле
где σ* — величина, пропорциональная или равная поверхностному натяжению на границе раздела между дисперсной фазой и дисперсионной средой; ΔB — увеличение поверхности раздела фаз в результате диспергирования; V — объем исходного тела до диспергирования; к — коэффициент, эквивалентный работе деформирования единицы объема тела.
Методы конденсации
К конденсационным методам получения дисперсных систем относятся конденсация, десублимация и кристаллизация. Они основаны на образовании новой фазы в условиях пересыщенного состояния вещества в газовой или жидкой среде. При этом система из гомогенной переходит в гетерогенную. Конденсация и десублимация характерны для газовой, а кристаллизация — для жидкой среды.

Необходимым условием конденсации и кристаллизации является пересыщение и неравномерное распределение вещества в дисперсионной среде (флуктуация концентрации), а также образование центров конденсации или зародышей.
Степень пересыщения β для раствора и пара можно выразить следующим образом:
где р, с — давление пересыщенного пара и концентрация вещества в пересыщенном растворе; рs— равновесное давление насыщенного пара над плоской поверхностью; сs— равновесная концентрация, соответствующая образованию новой фазы.
Для осуществления кристаллизации охлаждают раствор или газовую смесь.
В основе конденсационных методов получение дисперсных систем лежат процессы кристаллизации, десублимации и конденсации, которые вызваны уменьшением энергии Гиббса (ΔG 2 σ,
где 4πr 2 — поверхность сферических частиц радиусом r.
Химический потенциал изменяется следующим образом:
где μi / и μi // — химические потенциалы гомо и гетерогенных систем (при переходе от мелких капель к крупным).
Изменение химического потенциала характеризует перенос определенного числа молей вещества из одной фазы в другую; это число n молей равно объему частицы 4πr 3 /3, деленному на мольный объем Vм:
Работа образования новой поверхности в процессе конденсации Wк равна:
где W1и W2 — соответственно работа, затрачиваемая на образование поверхности частиц, и работа на перенос вещества из гомогенной среды в гетерогенную.
Образование дисперсных систем может происходить в результате физической и химической конденсации, а также при замене растворителя.
Физическая конденсация осуществляется при понижении температуры газовой среды, содержащей пары различных веществ. При выполнении необходимых условий образуются частицы или капли дисперсной фазы. Подобный процесс имеет место не только в объеме газа, но и на охлажденной твердой поверхности, которую помещают в более теплую газовую среду.
Конденсация определяется разностью химических потенциалов (μi // – μi / )
Источник
Методыполучения свободнодисперсных систем (диспергирование, конденсация)
Для получения дисперсных систем используют диспергационный и конденсационный методы, являющиеся основными при получении свободнодисперсных систем: порошков, суспензий, золей и прочее.
Под диспергированием понимают дробление и измельчение, под конденсацией – образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
Диспергационный метод представляет собой измельчение более крупных частиц в мелкие. Суть метода заключается в преодолении межмолекулярных сил и накоплении свободной поверхностной энергии в процессе диспергирования за счет внешней механической работы.
При дроблении и измельчении материалы разрушаются, в первую очередь, в местах дефектов. Поэтому, по мере измельчения, прочность частиц растет. В то же время, увеличение прочности материалов по мере их измельчения ведет к большему расходу энергии на дальнейшее их диспергирование.
Для получения дисперсных систем методом диспергирования широко применяют: дробилки, мельницы, жернова и прочее.
[2], с. 70 (А. М. Сыркин – Поверхностные явления и дисперсные системы в нефтепромысловом деле)
Основными условиями получения гетерогенных дисперсных систем являются:
— низкая растворимость вещества дисперсной фазы в дисперсионной среде;
— присутствие третьего компонента – стабилизатора, вещества, понижающего поверхностное натяжение или сообщающего частицам электрический заряд. Стабилизаторами являются ПАВ или электролиты, которые создают вокруг частиц дисперсной фазы адсорбционный защитный слой, препятствующий слипанию раздробленных частиц и выпадению их в осадок.
Диспергирование сопровождается увеличением поверхности раздела фаз, следовательно, возрастанием поверхностной энергии, на что требуется затратить энергию извне.
Механическое диспергирование – измельчение крупных частиц в мелкие. Используются мельницы, жернова и прочее.
Химическое диспергирование – диспергирование осадков, образующихся при слиянии коллоидных частиц, можно достичь с помощью химических добавок – пептизаторов. Этот метод химического диспергирования называется пептизацией.
В их основе лежат химические и физические процессы, ведущие к образованию твердой фазы в гомогенных растворах путем перевода растворенных веществ в нерастворимое состояние. При этом необходимо создать такие условия, чтобы в процессе образования твердой фазы не было возможности выпадения осадка. Для этого необходимо задержать рост образующихся частичек дисперсной фазы на нужном пределе, чтобы они не переросли размеры, свойственные микро- или ультрамикрогетерогенным системам. Практически это достигается с использованием определенной концентрации реагирующих веществ, изменением физических параметров, и введением химических добавок.
В зависимости от протекающих процессов различают химические и физические методы конденсации. Общим для этих методов является создание сильно перенасыщенного состояния (раствора), из которого и происходит образование частичек вещества дисперсной фазы.
В основе методов химической конденсации лежат разнообразные химические реакции: обмена, гидролиза, окислительно-восстановительные и прочее.
Реакции обмена и гидролиза солей, происходящие при смешивании природной и закачиваемой в пласт вод, при смешивании минерализованных пластовых вод разных горизонтов приводят к самопроизвольному образованию гетерогенных дисперсных систем, затрудняющих эксплуатацию скважин.
Окислительные процессы, приводящие к образованию гетерогенных дисперсных систем происходят и в результате воздействия различного рода бактерий.
В этих методах пресыщение раствора и образование частичек дисперсной фазы достигается изменением физических условий среды (температуры, давления, заменой растворителя и прочее).
Так, с уменьшением давления и температуры растворимость большинства солей уменьшается, и поэтому, при выходе пластовых вод на поверхность, происходит самопроизвольное выделение солей первоначально в виде дисперсных частиц, а затем, при отсутствии стабилизатора, и выпадение их в осадок.
Диспергирование – измельчение крупных частиц в более мелкие.
Конденсация – образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
Источник
ЛЕКЦИЯ №7
План лекции:
КЛАССИФИКАЦИЯ СПОСОБОВ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМ
Дисперсные системы могут быть созданы природой или получены искусственно. Способы искусственного получения делятся на две группы:
· диспергирование — получение дисперсной фазы из крупных тел;
· конденсация — укрупнение мелких частиц.
SHAPE \* MERGEFORMAT
ДИСПЕРГИРОВАНИЕ
Диспергирование может быть самопроизвольным и несамопроизвольным. Самопроизвольное диспергирование характерно для лиофильных систем. В отношении лиофобных систем самопроизвольное диспергирование исключено, диспергирование в них возможно путем затраты определенной работы.
Диспергирование характеризуется степенью диспергирования ( a ) . Она определяется отношением размеров исходного продукта и частиц дисперсной фазы полученной системы.
d н , d к — диаметр частиц до и после измельчения.
Работа W , необходимая для диспергирования твердого тела или жидкости, затрачивается на деформирование тела W д и на образование новой поверхности раздела фаз W а, которая измеряется работой адгезии. Деформирование является необходимой предпосылкой разрушения тела. Работа диспергирования определяется формулой:
W = W а + W д = 

D B — увеличение поверхности раздела фаз в результате диспергирования,
V — объем исходного тела до диспергирования,
k — коэффициент, эквивалентный работе деформирования единицы объема тела.
При помощи методов коллоидной химии можно снижать затраты энергии, необходимые для диспергирования. К числу таких методов относится адсорбционное понижение прочности. В результате адсорбции ПАВ на внешней и внутренней поверхности твердого тела снижается межфазовое поверхностное натяжение, облегчается деформирование твердого тела.
Снижение энергии диспергирования может быть достигнуто следующими методами: проведение процесса в жидкой среде, помол с одновременной вибрацией, применение ультразвукового метода.
ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ ЗА СЧЕТ КОНДЕНСАЦИОННЫХ ПРОЦЕССОВ
Конденсационные методы : конденсация, десублимация, кристаллизация. Они основаны на образовании новой фазы в условиях пересыщенного состояния вещества в газовой или жидкой среде. При этом система переходит из гомогенной в гетерогенную. Конденсация и десублимация характерны для газовой, а кристаллизация — для жидкой среды.
Необходимое условие конденсации и кристаллизации — пересыщение и неравномерное распределение вещества в дисперсионной среде и образование центров конденсации (зародышей).
Степень пересыщения b для раствора и пара можно выразить следующим образом:
р, с — давление пересыщенного пара и концентрация вещества в пересыщенном растворе, р s —равновесное давление насыщенного пара над плоской поверхностью, с s — равновесная растворимость, соответствующая образованию новой фазы.
Конденсации способствуют мельчайшие частички. Например, в качестве ядер конденсации водяного пара могут служить продукты сгорания самолетного топлива, частицы почвы и т.д..
Когда ядра конденсации отсутствуют, то капли могут существовать в переохлажденном состоянии. При конденсации паров в этих условиях будут образовываться не капли, а кристаллы. Процесс перехода газообразного вещества в твердое, минуя жидкое, состояние, называется десублимацией.
Сублимация — переход твердого вещества в газообразное, минуя жидкое.
В основе конденсационных методов лежат самопроизвольные процессы, которые сопровождаются уменьшением энергии Гиббса.
При зарождении и образовании частиц из пересыщенного раствора или газовой фазы изменяется химический потенциал m , возникает поверхность раздела фаз, которая становится носителем избыточной свободной поверхностной энергии.
Конденсация бывает физическая и химическая.
Физическая конденсация — осуществляется при понижении температуры газовой среды, содержащей пары различных веществ.
Изотермическая перегонка : уменьшение размеров мелких частиц до их полного исчезновения и рост крупных частиц.
МЕМБРАНЫ И МЕМБРАННЫЕ ПРОЦЕССЫ
Мембраны — полупроницаемые перегородки, при помощи которых осуществляется осмос. Осмос — самопроизвольный процесс переноса растворителя (дисперсионной среды) через мембрану из растворителя (менее концентрированного или коллоидного раствора) в раствор (или в более концентрированный раствор).
Мембраны — тонкие пористые пленки, они являются двухмерными высокодисперсными системами.
Наиболее часто мембраны применяют для очистки жидкостей от примесей при помощи обратного осмоса (движение растворенных примесей через мембрану под действием внешнего давления)
SHAPE \* MERGEFORMAT
Рис.7.2.Схема осмоса (а), обратного осмоса (б), ультрафильтрации и диализа (в)
1.дисперсионная среда (чистая жидкость) Ж, 2.коллоидный Т/Ж или истинный раствор, 3.мембрана, 4.поток чистой жидкости (растворителя), 5.поток примесей.
Если со стороны дисперсной системы 2 приложить давление Р, то поток жидкости из области 2 будет перемещаться в область 1.Через мембрану 3 проходят только молекулы растворителя (вследствие их большей подвижности). Содержимое области 1 будет обогащаться чистой жидкостью, а в области 2 сконцентрируются примеси.
Направление движения жидкости при обратном осмосе противоположно ее движению в случае осмоса.
Работа, необходимая для осуществления обратного осмоса, расходуется на продавливание жидкости через поры:
D р — перепад давления по обе стороны мембраны,
V — объем жидкости, прошедшей через мембраны.
Р — избыточное давление над раствором,
p — осмотическое давление.
Из равенства 7.5 следует , что Р > p . Это условие определяет избыточное давление, необходимое для осуществления обратного осмоса.
При помощи диализа (7.2, в) осуществляется очистка дисперсной системы от примесей в виде ионов или молекул. Дисперсную систему помещают в правую часть 2 сосуда, отделенную от левой части 1 мембраной 3. Мембрана проницаема для молекул и ионов, но задерживает частицы дисперсной фазы. Примеси в результате диффузии из области большей концентрации 2 самопроизвольно будут переходить в область меньшей концентрации 1.
Интенсифицировать очистку коллоидного раствора при помощи диализа можно путем приложения внешнего давления р (7.2, в). В этом случае процесс называют ультрафильтрацией.
Обратный осмос, диализ, ультрафильтрация используются для различный целей, но имеют много общего, используется аналогичная аппаратура.
Основной принцип действия мембран заключается в избирательной проницаемости, которая определяется размерами пор, свойствами очищаемых систем и внешним давлением.
Кроме очистки растворов мембраны способствуют равновесию электролитов в присутствии частиц или ионов, размеры которых не позволяют им проникать через поры, возникает так называемое мембранное равновесие, которое имеет практическое значение для растворов ВМС, в процессах набухания веществ и в различных физиологических процессах.
Мембранная технология намного эффективней других аналогичных технологий, требует меньших энергетических затрат.
ПРИЧИНА МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИХ СВОЙСТВ
Все молекулярно-кинетические свойства вызваны хаотичным тепловым движением молекул дисперсионной среды, которое складывается из поступательного, вращательного и колебательного движений молекул.
Молекулы обладают различной кинетической энергией. Тем не менее, при данной температуре среднее значение кинетической энергии молекул остается постоянным. Флуктуация значений кинетической энергии молекул дисперсионной среды является причиной молекулярно-кинетических свойств.
Молекулярно-кинетические свойства проявляются в жидкой и газообразной дисперсионной среде.
БРОУНОВСКОЕ ДВИЖЕНИЕ
Мельчайшие частицы незначительной массы испытывают неодинаковые удары со стороны молекул дисперсионной среды, на рисунке показана результирующая сила F , которая заставляет частицы двигаться.
SHAPE \* MERGEFORMAT
Рис.7.3.Воздействие молекул дисперсионной среды на частицу дисперсной фазы.
Направление и импульс этой силы непрерывно меняются, поэтому частицы совершают хаотичное движение.
Определить направление результирующей силы и связать его с молекулярно-кинетическими свойствами среды удалось в 1907 году независимо друг от друга Эйнштейну и Смолуховскому.
В основу их расчетов был взят не истинный путь частиц, а сдвиг частиц (рис.7.4).
SHAPE \* MERGEFORMAT
Путь частицы определяется ломаной линией, а сдвиг х характеризует изменение координаты частицы за определенный промежуток времени. Средний сдвиг будет определять среднеквадратичное смещение частицы:

х1, х2,х i — сдвиги частицы за определенное время.
Теория броуновского движения исходит из представления о взаимодействии случайной силы f ( t ) , которая характеризует удары молекул и, и силы F t , зависящей от времени и силы трения при движении частиц дисперсной фазы в дисперсионной среде со скоростью v . Уравнение броуновского движения (уравнение Ланжевена) имеет вид:
m ( d v / d t ) + h v = F t + f ( t ) (7.7)
где m — масса частицы, h — коэффициент трения при движении частиц.
Для больших промежутков времени инерцией частиц, то есть членом m ( d v / d t ) можно пренебречь. После интегрирования 7.7. при условии, что среднее произведение импульсов случайной силы равно нулю находят средний сдвиг:

где t — время, h — вязкость дисперсионной среды, r -радиус частиц дисперсной фазы.
Броуновское движение наиболее ярко выражено у высокодисперсных систем. Уяснение причин и разработка теории броуновского движения — блестящее доказательство молекулярной природы вещества.
ДИФФУЗИЯ
Диффузия — процесс самопроизвольного распространения вещества из области с большей концентрацией в область с меньшей концентрацией.
3. диффузия коллоидных частиц.
Ионная диффузия связана с самопроизвольным перемещением ионов. Формирование диффузного слоя противоионов на поверхности частиц дисперсной фазы происходит по механизму ионной диффузии.
Источник