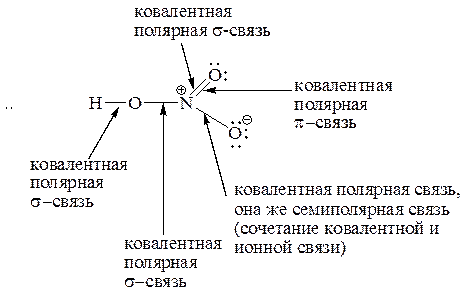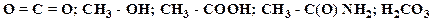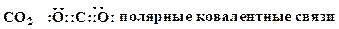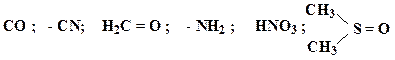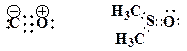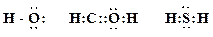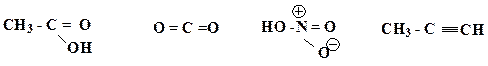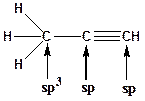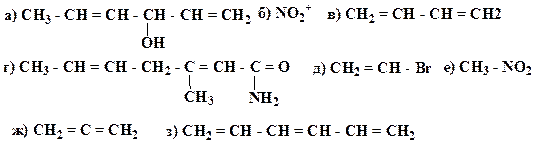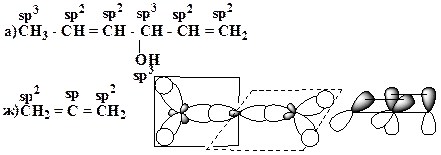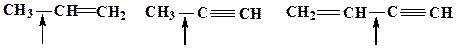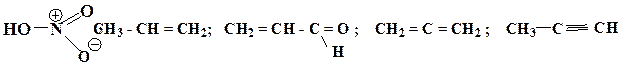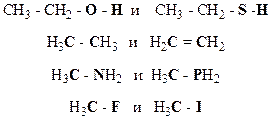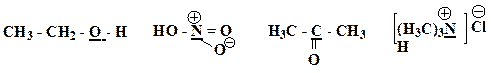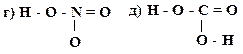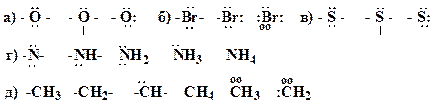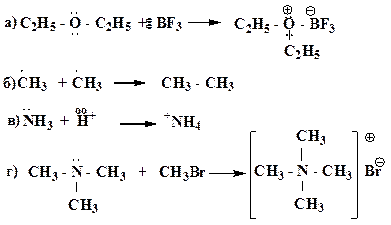- Задача 4. Определите, какие способы обобщения электронной пары реализуются при образовании следующих соединений и какие типы связей при этом возникают (табл
- Задача 4. Определите, какие способы обобщения электронной пары реализуются при образовании следующих соединений и какие типы связей при этом возникают (табл
- ГЛАВА 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
Задача 4. Определите, какие способы обобщения электронной пары реализуются при образовании следующих соединений и какие типы связей при этом возникают (табл
Определите, какие способы обобщения электронной пары реализуются при образовании следующих соединений и какие типы связей при этом возникают (табл. 9).
| Вариант | Схемы реакций |
 | |
 | |
 | |
 | |
 | |
 | |
 |
Продолжение табл. 9
| Вариант | Схемы реакций |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 |
Окончание табл. 9
| Вариант | Схемы реакций |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 |

3. ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция – это разрыв старых и образование новых химических связей с перераспределением электронной плотности атомов реагирующих молекул.
В химической реакции участвуют:
1) субстрат – соединение, атом углерода которого атакуется другой молекулой или частицей, а сам этот атом углерода называется реакционным центром;
2) реагент – молекула или частица, которая атакует реакционный центр в субстрате (табл. 10).
По направлению в соответствии с результатом химического превращения органические реакции делят на несколько основных типов:
а) реакции замещения (S);
б) реакции присоединения (A);
в) реакции элиминирования или отщепления (E);
Источник
Задача 4. Определите, какие способы обобщения электронной пары реализуются при образовании следующих соединений и какие типы связей при этом возникают (табл
Определите, какие способы обобщения электронной пары реализуются при образовании следующих соединений и какие типы связей при этом возникают (табл. 9).
| Вариант | Схемы реакций |
 | |
 | |
 | |
 | |
 | |
 | |
 |
Продолжение табл. 9
| Вариант | Схемы реакций |
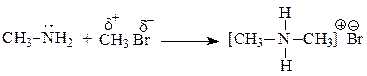 | |
 | |
 | |
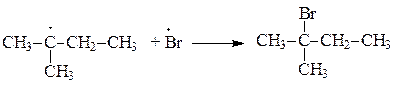 | |
 | |
 | |
 | |
 | |
 | |
 | |
 | |
 |
Окончание табл. 9
| Вариант | Схемы реакций |
 | |
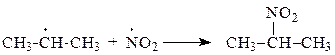 | |
 | |
 | |
 | |
 | |
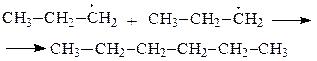 | |
 | |
 | |
 | |
 |

3. ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция – это разрыв старых и образование новых химических связей с перераспределением электронной плотности атомов реагирующих молекул.
В химической реакции участвуют:
1) субстрат – соединение, атом углерода которого атакуется другой молекулой или частицей, а сам этот атом углерода называется реакционным центром;
2) реагент – молекула или частица, которая атакует реакционный центр в субстрате (табл. 10).
По направлению в соответствии с результатом химического превращения органические реакции делят на несколько основных типов:
а) реакции замещения (S);
б) реакции присоединения (A);
в) реакции элиминирования или отщепления (E);
Источник
ГЛАВА 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
Электронное строение органических соединений
и реакционных частиц
Задачи
1. Приведите электронные конфигурации атомов элементов второго периода. Определите значение высшей валентности каждого элемента.
2. Дайте определения следующим понятиям: атом, катион, анион, радикал. Приведите примеры.
3. Укажите внешние электроны в следующих частицах:
а) H , H + , H — ; б) Br , Br + , Br — ; в) CH 3 , CH 3 + , CH 3 — ; г) OH , OH + , OH —
Назовите эти частицы.
4. Охарактеризуйте типы химических связей в приведенных соединениях (ковалентная неполярная, ковалентная полярная, ионная):
Образец выполнения задания:
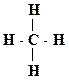
5. Охарактеризуйте типы химических связей (обычная ковалентная, координационная, семиполярная) в приведенных соединениях: H3C – Br, HNO3, CO, NH4Cl, H3C – CH3, C2H5ONa, NH3.
Образец выполнения задания:
6. Представьте следующие молекулы в виде структур Льюиса, укажите типы химических связей:
Образец выполнения задания:
7. Представьте следующие молекулы в виде структур Льюиса и поставьте, где необходимо, формальные заряды на атомах, укажите типы химической связи:
Образец выполнения задания:
8. Дополните указанные формулы соединений неподеленными электронными парами (НЭП), выберите заряженные частицы, проставьте заряды:
9. Какие из приведенных пар соединений являются изоэлектронными:
а) CH 3 + и BH 3 ; б) NH 3 и H 3 O + ; в) CH 4 и H 2 O
10. Выберите соединения, в молекулах или ионах которых валентность центрального атома равна четырем: CH 4 ; NH 4 + ; H 2 O ; CH 3 +
11. Выберите соединения, в молекулах или ионах которых валентность центрального атома равна трем: CH 4 ; NH 3 ; H 3 O + ; CH 3 + ; CH 3 — ; BF 3 ; NH 4 +
12. Выберите соединения, в молекулах или ионах которых координационное число центрального атома равно трем: CH 4 ; NH 3 ; H 3 O + ; CH 3 + ; CH 3 — ; BF 3 ; NH 4 +
13. Представьте следующие молекулы в виде структур Льюиса и объясните, почему они изоэлектронны: N 2 , CO , CN — .
14. Докажите, что приведенные структуры изоэлектронны: а) CO 3 2- и NO 3 — ; б) CO 2 и NO 2 + ; в) CO и N 2 .
15. В приведенных рядах соединений выберите изоэлектронные структуры, напишите для них формулы Льюиса:
1) NO + , NO, CO2, CN —
2) N2, NO + , CO, CN — , NO, NH2 —
16. Какие из перечисленных структур являются ионами:
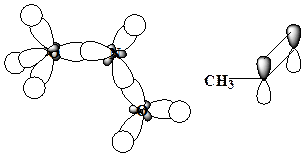
17. Для приведенных молекул укажите тип гибридизации каждого атома:
Образец выполнения задания:
18. Для приведенных молекул и частиц укажите тип гибридизации каждого атома, используя правило октета, проставьте все неподеленные электронные пары и укажите орбитали, на которых они находятся:
Приведите схемы s- и p-связей.
Образец выполнения задания:
19. Определите длину одинарных (σ-) связей в приведенных соединениях с учетом ковалентных радиусов атома углерода (RСsp3 = 0.767 Ǻ, RCsp2 = 0.742 Ǻ, RCsp = 0.668 Ǻ):
20. Из каждой пары веществ выберите такие, в молекулах которых выделенная связь имеет большую длину: а) CH 3 — CH 3 или CH 2 = CH 2 ; б) > C = O или CH 3 – OH ; в) HC º CH или CH 3 — Cl .
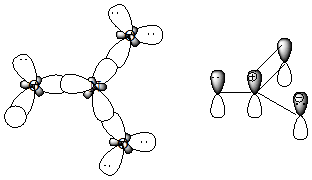
21. Приведите схемы σ- и π- связей для молекул следующих соединений, укажите орбитальные углы:
Образец выполнения задания:
Схема s – и π-связей для молекулы азотной кислоты:
120 °
Схема σ- и p -связей для молекулы пропена:
22. Какая из связей в каждой паре более полярна, какая более поляризуема:
а) C – C и C º C ; б) C – Cl и С — I ; в) C — N и C º N ; г) C — O и C = O ;
д) C — S и C — O ; е) C — O и C — F ; ж) C — F и C — Br ; з) C = N и C º N ;
и) C = C и C º C
23. Сопоставьте полярность и поляризуемость выделенных связей в следующих парах соединений:
(Указание: воспользуйтесь данными табл.10 в Приложении).
24. Определите ковалентность и координационное число для выделенных атомов в следующих соединениях:
25. Рассчитайте формальные заряды на выделенных атомах:
а)[ CH 3 – OH 2 ] Br ; б) [ NH 4 ] Cl ; в) [ CH 3 – C º C :] K ;
26. Рассчитайте формальные заряды в следующих фрагментах молекул:
27. Приведите конкретные примеры для каждого случая образования ковалентной связи по донорно-акцепторной схеме:
A: + B + → A + — B
A: — + B + → A — B
A: — + B → A – B —
A : — + B + → A – B
28. Какие способы обобщения электронной пары реализуются при образовании приведенных соединений:
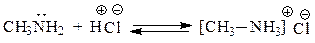
29. В каком случае донорно-акцепторное взаимодействие приводит к образованию семиполярной связи? В чем ее отличие от ионной и ковалентной? В каких из приведенных соединений имеются семиполярные связи?
Источник