Особенности разных видов микроскопии
Основными задачами микроскопии являются следующие:
– выявление микроорганизмов в различных материалах;
– ориентировочная идентификация микроорганизмов в образце;
– изучение некоторых морфологических признаков и структур микроорганизмов (например, капсул, жгутиков и т. д.);
– изучение окрашенных мазков из колоний и чистых культур.
На сегодняшний день наиболее используемой является световая микроскопия.
Световая микроскопия обеспечивает увеличение до 2–3 тысяч раз, цветное и подвижное изображение живого объекта, возможность микрокиносъемки и длительного наблюдения одного и того же объекта, оценку его динамики и химизма. Изображение в световом микроскопе формируется вследствие того, что объект и различные его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст).
Основными характеристиками любого микроскопа являются разрешающая способность и контраст. Разрешающая способность – это минимальное расстояние, на котором находятся две точки, демонстрируемые микроскопом раздельно. Разрешение человеческого глаза в режиме наилучшего видения равно 0,2 мм. Контраст изображения– это различие яркостей изображения и фона. Если это различие составляет менее 3–4 %, то его невозможно уловить ни глазом, ни фотопластинкой; тогда изображение останется невидимым, даже если микроскоп разрешает его детали. На контраст влияют как свойства объекта, изменяющие световой поток по сравнению с фоном, так и способности оптики уловить возникающие различия в свойствах луча. Возможности светового микроскопа ограничены волновой природой света. Физические свойства света – цвет (длина волны), яркость (амплитуда волны), фаза, плотность и направление распространения волны изменяются в зависимости от свойств объекта. Эти различия и используются в современных микроскопах для создания контраста.
Увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. У типичных исследовательских микроскопов увеличение окуляра равно 10, а увеличение объективов – 10, 40 и 100. Соответственно, увеличение такого микроскопа составляет от 100 до 1 000. Некоторые из микроскопов имеют увеличение до 2 000. Еще более высокое увеличение не имеет смысла, так как при этом разрешающая способность не улучшается. Напротив, качество изображения ухудшается.
Числовая апертура используется для выражения разрешающей способности оптической системы. Числовая апертура – это оптический «охват» линзы, она является мерой количества света, попадающего в линзу. Числовая апертура объектива указана на его оправе. Апертура конденсора должна соответствовать числовой апертуре объектива. Числовая апертура любой линзы, граничащей с воздухом (т.е. «сухой системы»), не может превысить 1, так как показатель преломления воздуха равен 1. Числовую апертуру можно повысить, если увеличить показатель преломления среды между фронтальной линзой объектива и предметным стеклом, приблизив его к показателю преломления стекла (1,5). Для этого между фронтальной линзой объектива и исследуемым объектом помещают каплю жидкости с показателем преломления большим, чем показатель преломления воздуха, например, каплю воды (n = 1,3), глицерина (n = 1,4) или кедрового (иммерсионного) масла (n = 1,5). Для каждой из указанных выше жидкостей выпускаются специальные объективы, которые называются иммерсионными.
Световая микроскопиявключает обычную просвечивающую микроскопию (светло-, темнопольную), фазово-контрастную, люминесцентную. В последнее время разработаны и другие способы микроскопии и микроскопы – инверсионная и конфокальная лазерная сканирующая микроскопия.
Светлопольная микроскопия позволяет исследовать объекты в проходящем свете в светлом поле. Данный вид микроскопии предназначен для исследования морфологии, размеров клеток, их взаимного расположения, структурной организации клеток и других особенностей. У светового микроскопа максимальная разрешающая способность составляет 0,2 мкм, что обеспечивает высокоточное увеличение микроскопа до 1500х.
Фазово-контрастная микроскопия позволяет более четко наблюдать живые прозрачные объекты, которые имеют коэффициенты преломления, близкие к коэффициентам преломления среды. Действие фазово-контрастного микроскопа основано на интерференции света в плоскости изображения, обусловленной сдвигом по фазе (при использовании фазового кольца в апертурной диафрагме). При фазово-контрастной микроскопии часто применяют биологические микроскопы с обратным расположением оптики – инвертированные микроскопы. У таких микроскопов объективы расположены снизу, а конденсор – сверху.
С помощью фазово-контрастной микроскопии изучают форму, размеры, взаимное расположение клеток, их подвижность, размножение, прорастание спор микроорганизмов и т. д. Благодаря применению этого способа микроскопии контраст живых неокрашенных микроорганизмов резко увеличивается и они выглядят темными на светлом фоне (позитивный фазовый контраст) или светлыми на темном фоне (негативный фазовый контраст).
Темнопольная микроскопия основана на освещении объекта косыми лучами света. При таком освещении лучи не попадают в объектив, поэтому поле зрения выглядит темным. Такое освещение препарата достигается использованием специального темнопольного конденсора. Темнопольная микроскопия является очень простым, но эффективным методом и хорошо подходит для получения изображения живых и неокрашенных биологических образцов. Учитывая простоту установки, качество получаемых изображений весьма хорошее.
При микроскопировании в темном поле можно увидеть объекты, величина которых измеряется сотыми долями микрометра, что находится за пределами разрешающей способности обычного светлопольного микроскопа. Однако наблюдение за объектами в темном поле позволяет исследовать только контуры клеток и не дает возможности рассмотреть их внутреннюю структуру.
Люминесцентная (флуоресцентная) микроскопия основана на способности ряда веществ биологического происхождения или некоторых красителей светиться при их освещении невидимым ультрафиолетовым или синим светом. При использовании ультрафиолетового света разрешающая способность микроскопа может достигать 0,1 мкм.
Клетки микроорганизмов обрабатывают специальными красителями – флуорохромами (акридиновый оранжевый, примулин, родамин и др.) в виде сильно разбавленных водных растворов: 1:500–1:100 000. Такие растворы слабо токсичны, что дает возможность изучать неповрежденную клетку. В зависимости от химического состава, клеточные структуры в разной степени адсорбируют красители и люминесцируют различным образом. Кроме того, флуорохромы неодинаково адсорбируются живыми и мертвыми клетками. Это позволяет использовать данный вид микроскопии для цитологических и иммунологических исследований, определения жизнеспособности клеток и т. д.
Электронная микроскопия позволяет обнаружить объекты, которые не разрешаются при использовании световых или ультрафиолетовых лучей. Теоретически разрешение просвечивающего электронного микроскопа составляет 0,002 нм; реальное разрешение современных электронных микроскопов приближается к 0,1 нм. На практике разрешение для биологических объектов достигает 2 нм.
Короткая длина волны электронов позволяет различить объекты размером 0,5–1,0 нм. В современных электронных микроскопах на экране достигается увеличение 5000– 200 000. Благодаря столь высокому разрешению становится возможным выявление деталей бактериальных структур. Например, с помощью напыления солей тяжелых металлов, окружающих бактерию и проникающих в поверхностные неровности, получают контрастирование за счет дифференциальной задержки электронов. Этот эффект получил название негативного контрастирования.
Электронный микроскоп, в котором изображение формируется благодаря прохождению (просвечиванию) электронов через образец, называют просвечивающим (или трансмиссионным).
В сканирующем электронном микроскопе (растровая электронная микроскопия (РЭМ) пучок электронов быстро сканирует поверхность образца, вызывая излучение, которое формирует изображение на светящемся экране. Для РЭМ характерны высокая разрешающая способность, большой диапазон увеличений (до 100 000 и выше), большая глубина фокусировки (
100 мкм), многообразие режимов работы. Сканирующий микроскоп дает картину поверхностей и позволяет получать трехмерное изображение.
Лазерная конфокальная микроскопия дает возможность получить отчетливое изображение и наблюдать объекты в фокусе по всему полю. Данный метод пригоден лишь для исследования самосветящихся (флуоресцентных) объектов. При сочетании с компъютерной техникой возможна пространственная реконструкция изучаемого объекта. В конфокальном лазерном сканирующем микроскопе изображения внутренних сечений формируются за счет сканирования сфокусированным лазерным пучком от разных (405, 488, 532, 635 нм) лазеров и пространственной фильтрации излучения. При использовании сканирующей микроскопии ближнего поля (СМБП) достигается высокая разрешающая способность. Наименьший размер элемента, полученного с помощью СМБП, составляет 20 нм при длине волны света 0,486 нм. В изображении контролируемого элемента отсутствуют дифракционные или интерференционные эффекты, затрудняющие определение его границ. Отличительной особенностью СМБП по сравнению с атомно-силовым микроскопом является чувствительность к оптическим характеристикам поверхности контролируемого образца, длине волны света, люминесценции и др.
Компьютерная интерференционная микроскопия позволяет получить высококонтрастное изображение при наблюдении субклеточных структур; во многих случаях применяется для изучения живых клеток. Принцип действия автоматизированного интерференционного микроскопа основан на интерференции световых пучков лазерного излучения, отраженного от опорного зеркала и зеркала, на котором помещен измеряемый фазовый объект. Теоретически предельно достижимая разрешающая способность может составить в среднем 0,2 нм, практически она составляет 0,4 мкм.
Рентгеновская компьютерная томография (РКТ), позитронная эмиссионная томография(ПЭТ) позволяют наблюдать объекты в обычных условиях.
Источник
Гистологическая техника. Методы и техника микроскопирования
Цель занятия: Познакомиться с принципами работы и использования приборов специальной микроскопии в исследовательских целях. Закрепить навык микроскопирования гистологического препарата.
¨ Задание:
1. Заполните таблицу 2, отметив основные виды микроскопии, их разновидности, кратко сформулируйте цели использования каждой разновидности.
Методы и техника микроскопирования
| Виды микроскопии | Разновидности | Цели использования |
1. Световая микроскопия.Применяются обычные световые микроскопы и их разновидности, в которых используются источники света с различными длинами волн. В световом микроскопе можно видеть не только отдельные клетки размером от 4 до 150 мкм, но и их внутриклеточные структуры – органеллы и включения. Для усиления контрастности микрообъектов применяют их окрашивание.
а) Ультрафиолетовая микроскопия.Используются более короткие ультрафиолетовые лучи с длинной волны около 0,2 мкм. Полученное невидимое глазом изображение преобразуется в видимое с помощью регистрации на фотопластинке или путем применения специальных устройств (люминесцентный экран, электронно-оптический преобразователь).
б) Флюоресцентная (люминесцентная) микроскопия.Суть метода заключается в том, что атомы и молекулы ряда веществ, поглощая коротковолновые лучи, переходят в возбужденное состояние. Обратный переход из возбужденного состояния в нормальное происходит с испусканием света, но с большей длиной волны. Применяются ртутные и ксеоновые лампы сверхвысокого давления, обладающие высокой яркостью в области ближних ультрафиолетовых и сине-фиолетовых лучей. Любая клетка живого организма обладает собственной флюоросценцией (часто довольно слабой).
— Первичная флюоресценция – обладают серотонин, катехоламины (адреналин и норадреналин), содержащиеся в нервных, тучных и других клетках, после фиксации тканей в парах формальдегида (метод Фалька).
— Вторичная флюоресценция возникает при обработке препаратов специальными красителями – флюорохромами.
в) Фазово-контрастная микроскопия.Этот методслужит для получения контрастных изображений прозрачных и бесцветных живых объектов, невидимых при обычных методах микроскопирования. Для этого неокрашенные структуры помещают в кольцевую диафрагму, помещаемую в конденсоре, и фазовой пластинки, находящейся в объективе. Такая конструкция оптики дает возможность преобразовать не воспринимаемы глазом фазовые изменения прошедшего через неокрашенный препарат света в изменение его амплитуды, т.е. яркости получаемого изображения.
г) Микроскопия в темном поле.Достигает объективатолько свет, который дает дифракцию структур в препарате. В микроскопе есть специальный конденсор, который освещает препарат строго косым светом. Таким образом, поле выглядит темным, а мелкие частицы в препарате отражают свет, который далее попадает в объектив. Этот метод используется для изучения живых объектов, например зерен серебра, которые выглядят светлыми на темном поле. В клинике его применяют для изучения кристаллов в моче (мочевая кислота, оксалаты), для демонстрации спирохет и т.д.
д) Интерференционная микроскопия.Используется дифференциальный интерференционный микроскоп (с оптикой Номарского), который используют для изучения рельефа поверхности клеток и других биологических объектов.
В этом микроскопе пучок света от осветителя разделяется на два потока: один проходит через объект и изменяет по фазе колебания, второй идет, минуя объект. В призмах объектива оба пучка соединяются и интерферируют между собой. В результате строится изображение, в котором участки микрообъекта разной толщины и плотности различаются по степени контрастности. Проведя количественную оценку изменений, определяют концентрацию и массу сухого вещества.
Преимущество такой микроскопии является возможность наблюдать клетки в процессе движения и митоза. При этом регистрация движения клеток может производиться с помощью покадровой микрокиносъемки.
е) Темнопольный микроскоп применяется для получения изображений прозрачных живых объектов. Образец в нем рассматривается при столь «косом» освещении, что прямой свет не имеет возможности попасть в объектив. Изображение формируется светом, дифрагированным на объекте, и в результате объект выглядит очень светлым на темном фоне (с очень большим контрастом).
2. Поляризационная микроскопия.Поляризационный микроскоп является модификацией светового микроскопа, в котором установлены два поляризационных фильтра – первый (поляризатор) между пучком света и объективом, а второй (анализатор) между линзой объектива и глазом. Оба фильтра могут вращаться, изменяя направления пучка света. Структуры, содержащие продольно ориентированные молекулы (коллаген, микротрубочки, микрофиламенты), и кристаллические структуры (в Лейдига – гландулоциты яичка) при изменении оси вращения проявляются как светящиеся. Способность кристаллов или паракристаллических образований к раздвоению световой волны на обыкновенную и перпендикулярную к ней называется двойным лучепреломлением. Такой способностью обладают фибриллы поперечно-полосатых мышц.
3. Электронная микроскопия.Рассматривая характеристики светового микроскопа, можно убедиться, что единственным путем увеличения разрешения оптической системы будет использование источника освещения, испускающего волны с наименьшей длиной. Таким источником может быть раскаленная нить, которая в электрическом поле выбрасывает поток электронов, последний можно фокусировать, пропуская через магнитное поле. Это послужило основой для создания электронного микроскопа, в котором уже сейчас достигнуто разрешение в 0,1 нм. По принципу конструкции электронный микроскоп очень сходен с оптическим: в нем есть источник освещения (катод электронной пушки), конденсорная система (конденсорная магнитная линза), объектив (объективная магнитная линза), окуляр (проекционные магнитные линзы), только вместо сетчатки глаза электроны попадают на люминесцирующий экран или на фотопластинку. В электронном микроскопе используется поток электронов, с более короткими, чем в световом микроскопе, длинами волн. Разрешаемое расстояние в 100 000 раз меньше, чем в световом микроскопе. В современных электронных микроскопах разрешаемое расстояние составляет около 0,1-0,7 нм.
В настоящее время используются трансмиссионные и сканирующие электронные микроскопы, которые имеют большую глубину резкости, широкий диапазон непрерывного изменения увеличения (от 10-ков до 10-ков тысяч раз) и высокая разрешающая способность.
2. Рассмотрите строение светового микроскопа. Повторите правила работы с ним.
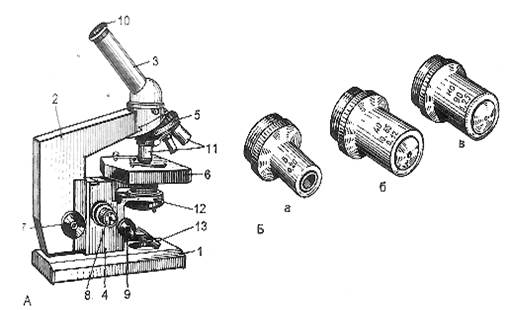
Работа с микроскопом. Устройство типичного биологического микроскопа (рис.1). Штативная подставка выполняется в виде тяжелой отливки. К ней на шарнире прикреплен тубусодержатель, несущий все остальные части микроскопа.
С помощью тубуса, в который вмонтированы линзовые системы, можно перемещать их относительно образца для фокусировки. На нижнем конце тубуса расположен объектив.
Как правило, микроскоп снабжен несколькими объективами разного увеличения на револьверной головке, которая позволяет устанавливать их в рабочее положение на оптической оси. При исследовании образца оператор обычно начинает с объектива, который имеет наименьшее увеличение и наиболее широкое поле зрения, находит интересующие его детали, после чего рассматривает их, пользуясь объективом с большим увеличением.
Окуляр вмонтирован в конец выдвижного держателя, при помощи которого можно при необходимости изменять длину тубуса. Передвигая вверх и вниз весь тубус с объективом и окуляром, микроскоп наводится на резкость.
В качестве образца обычно берется очень тонкий прозрачный слой или срез, который кладут на стеклянную пластинку прямоугольной формы, называемую предметным стеклом, а сверху накрывают более тонкой стеклянной пластинкой меньших размеров, которая называется покровным стеклом. Чтобы увеличить контраст, образец часто окрашивают химическими веществами.
Предметное стекло кладут на предметный столик таким образом, чтобы образец находился над центральным отверстием столика. Столик, как правило, бывает снабжен механизмом для плавного и точного перемещения образца в поле зрения.
Третья система линз – конденсор – концентрирует свет на образце. Держатель конденсоров, которых может быть несколько, находится под предметным столиком. Здесь же расположена ирисовая диафрагма для регулировки апертуры. Еще ниже находится осветительное зеркало, устанавливаемое в универсальном шарнире. За счет того, что зеркало отбрасывает свет лампы на образец оптическая система микроскопа и создает видимое изображение.
Рис. 1. Микроскоп для биологических исследований.
А-общий вид: 1 — основание; 2 – тубусодержатель; 3 – тубус; 4 – коробка механизма микроподачи; 5 – револьверное устройство; 6 – предметный столик; 7 — макрометрический винт; 8 – микрометрический винт; 9 – винт конденсора; 10 – окуляр; 11 – объективы; 12 – конденсор с ирисовой диафрагмой; 13 – зеркало; Б – объективы малого (а), большого (б) и иммерсионного (в) увеличения.
3. 
Источник