8.2. Методы культивирования бактерий
Для успешного культивирования бактерий, кроме правильно подобранных сред и проведенного посева, необходимы оптимальные условия: температура, влажность, аэрация. В среднем температура для культивирования большинства микробов должна быть в пределах 37-38 °С.
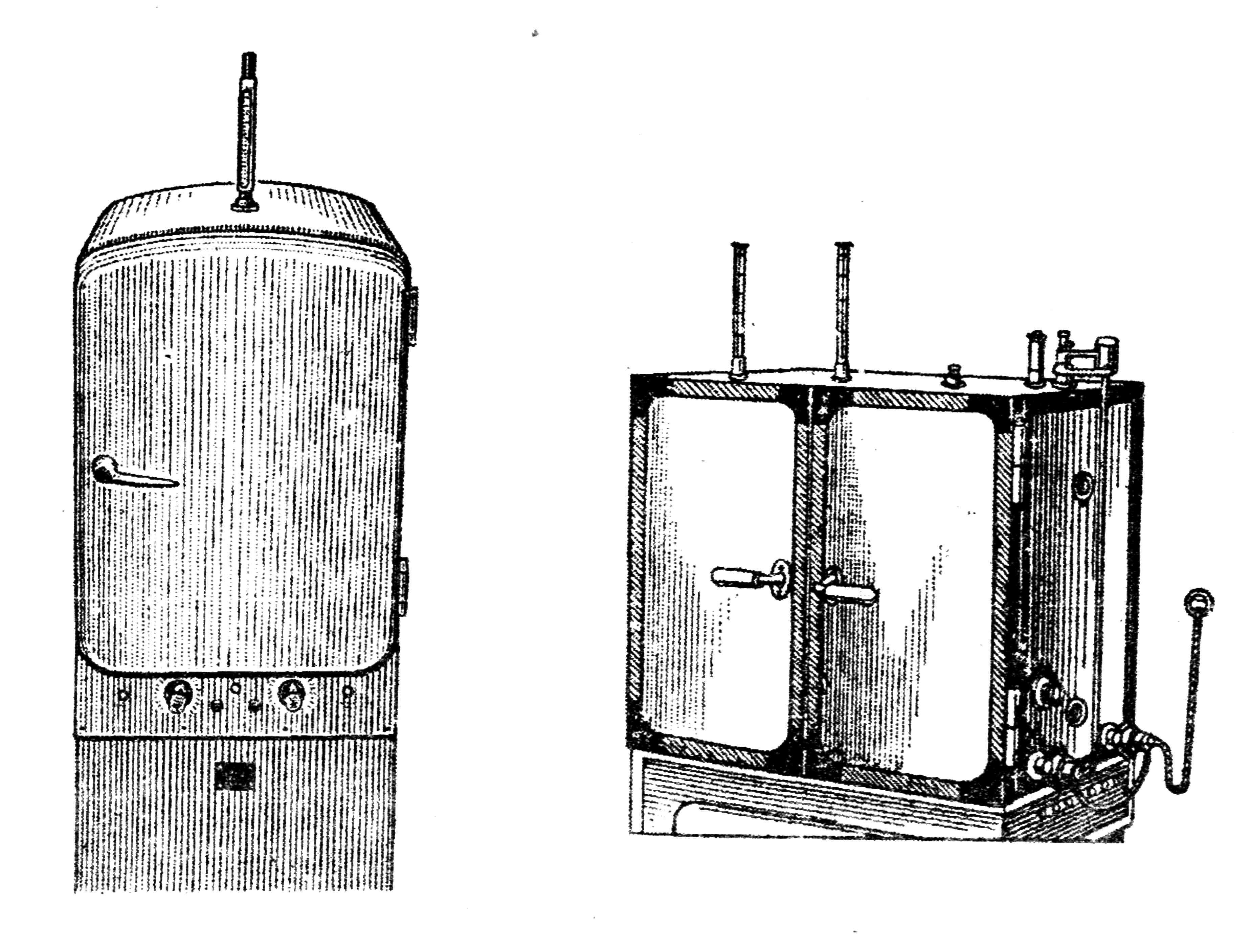
Для выращивания микробов в лабораторных условиях используют специальный аппарат — термостат, в котором поддерживается постоянная и определенная температура (рис. 26).
Термостаты бывают различного устройства и размера. Термостат представляет собой шкаф с полками внутри и открывающейся дверцей, сделанные из теплоизолирующих материалов. Источником нагрева в современных термостатах являются электронагревательные элементы, которые прогревают воздух или воду.
Существенной частью любого термостата является система терморегуляции, которая обеспечивает поддержание температуры на оптимальном уровне. Датчиком температуры в большинстве термостатов является ртутный контактный термометр с магнитной головкой. Такой термометр имеет два контакта, один из которых представляет собой платиновую подвижную проволоку, заключенную в канал термометра, другой присоединяется к ртути. Уровень температуры по положению подвижного контакта регулируется магнитной головкой. При нагревании термостата выше 37° замыкаются контакты термометра, и сигнал поступает в электронное устройство, которое с помощью реле отключает источники нагрева. При снижении температуры контакты размыкаются и подается сигнал для включения источников нагрева. Таким образом, в термостатах постоянно поддерживается нужная температура.
В больших лабораториях по такому же принципу создаются комнаты-термостаты.
Рис. 26. Различные системы термостатов: сухо-воздушный (А), с водяной рубашкой (Б)
Свет подавляющему большинству патогенных микробов не нужен: их культивируют в темноте. Однако для изучения пигментообразования, которое происходит активнее на рассеянном свету, бактериальные культуры после термостата выдерживают 2-3 дня при комнатном освещении.
Для успешного культивирования бактерий необходимо применять свежие питательные среды, содержащие определенное количество влаги. Особенно это касается использования плотных питательных сред, которые разливают в чашки и скашивают в пробирках в день посева.
При выращивании аэробов и факультативных анаэробов аэрация происходит в естественных условиях без применения каких-либо дополнительных приспособлений.
Сроки культивирования большинства патогенных микроорганизмов составляют 18-24 часа, но есть и культуры, растущие медленно – до 4-6 недель.
8.3. Методы выделения чистых культур бактерий
Морфологические, культуральные и биохимические особенности микроорганизмов, необходимые для определения вида с целью постановки бактериологического диагноза, изучают, используя чистые культуры бактерий.
Микробы, выделенные из внешней среды, организма животных или людей и размноженные на питательных средах, называют культурами.
В исследуемом материале патогенные микроорганизмы во многих случаях находятся в числе других, чаще сапрофитных бактерий. Выделить чистую культуру возбудителя болезни является основной задачей при проведении бактериологической диагностики.
Чистая культура микробов содержит только один вид микроорганизмов, который определяется по совокупности его свойств. Культура микроорганизмов, выделенная из определенного источника (организм животного, воздух, почва и др.) получила название штамм.
Если выделенная бактериальная культура одного вида различается по некоторым признакам, то она называется – вариант.
Методы выделения микроорганизмов из исследуемого материала можно отнести к двум группам – механические и биологические.
А. Механические методы
Они основаны на механическом разъединении одной бактериальной клетки от другой с целью получения отдельных изолированных колоний на плотной питательной среде. После культивирования посевов в термостате из отдельной нужной колонии делается пересев на питательную среду, в которой вырастают чистые культуры бактерий.
1-й день исследования
Из исследуемого материала готовят мазки и окрашивают их по Граму. При микроскопии устанавливают наличие бактерий, их морфологические особенности и отношение к окраске по Граму.
Для получения изолированных колоний исследуемый материал высевают на поверхность плотной питательной среды в чашках Петри.
Агар в чашки разливают следующим образом: флакон со стерильной питательной средой помещают в водяную баню. После расплавления агара и его охлаждения до 42°С флакон берут в правую руку, левой рукой извлекают пробку, обжигают горлышко флакона, большим и указательным пальцами левой руки слегка приподнимают крышку чашки. Вводят горлышко флакона под крышку чашки (не касаясь краев), наливают 15-20 мл питательного агара, быстро выводят горлышко флакона и закрывают чашку крышкой. Края горлышка флакона подводят к пламени и закрывают его обожженой пробкой. Слегка покачивая круговыми движениями чашку, достигают равномерного распределения среды. Чашки оставляют на месте, пока среда не застынет, а затем их переносят в термостат, поворачивая вверх дном, снимают крышку и оставляют в таком виде на 15-20 минут для подсушивания.
Существует несколько методов посева материала для выделения чистой культуры бактерий. Посев на чашки штрихом производится при помощи петли, которой набирают небольшое количество исследуемого материала и, не вынимая петлю из пробирки, стряхивают излишнее его количество. Чашку с питательной средой помещают на столе вверх дном. Левой рукой берут дно чашки, держа ее почти вертикально, и густо заштриховывают петлей небольшой участок агара в верхней части чашки. Петлю следует держать свободно большим и указательным пальцами правой руки, ближе к концу петледержателя. Освободив таким образом петлю от излишнего материала, легкими движениями, не повреждая поверхности среды, наносят, отрывая друг от друга, параллельные штрихи на расстоянии около 0,5 см.
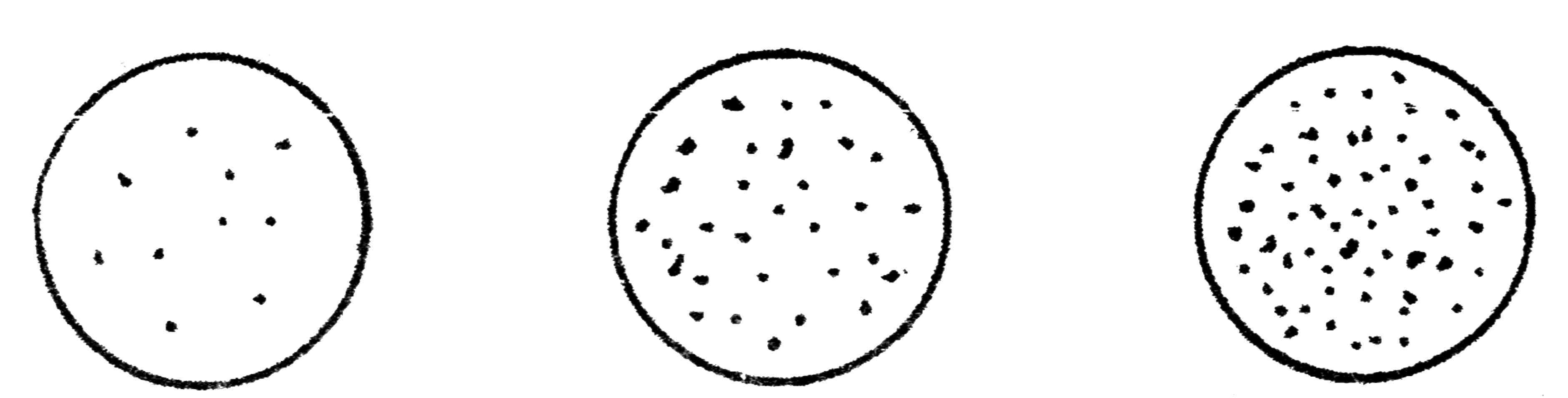
В отдельных случаях можно производить последовательный рассев материала, используя для этого несколько чашек с питательной средой. Набрав петлей материал, производят посев штрихами на первой чашке и той же петлей, не набирая материала, вновь наносят штрихи на вторую и третью чашки с питательным агаром. На первой чашке обычно получают рост в виде сплошных штрихов, на второй и, особенно на третьей бактерии развиваются в виде изолированных колоний (рис. 27).
Рис. 27. Рост бактерий на плотной питательной среде при последовательном посеве
Посев шпателем. Посев исследуемого материала нередко производят шпателем, который заранее заворачивают в бумагу и стерилизуют горячим воздухом. Исследуемый материал в количестве одной петли или капли наносится пастеровской пипеткой в центр чашки со средой, каплю шпателем распределяют на небольшом участке среды, а затем круговыми движениями по всей ее поверхности. На время посева крышка чашки, поддерживаемая левой рукой, остается слегка открытой.
Шпатель из первой чашки быстро переносят во вторую чашку, а затем в третью. По окончании посева шпатель погружают в банку с дезинфицирующим раствором. Чашку с соответствующей надписью на дне помещают в термостат вверх дном для того, чтобы конденсационная вода, скапливающаяся на внутренней поверхности крышки, не попадала на поверхность посева и не размывала выросшие колонии.
2-й день исследования
Изучают культуральные свойства чистой культуры, выросшие колонии на третьей чашке. Их изучают невооруженным глазом, с помощью лупы, при малом увеличении микроскопа и иногда под стереоскопическим микроскопом.
Нужную колонию отмечают со стороны дна чашки восковым карандашом. Из нее делают мазок и окрашивают по Граму. При микроскопии изучают морфологические особенности и отношение бактерий к окраске по Граму. Из этой колонии делают пересев на питательные среды (МПА и МПБ). Посевы помещают в термостат для культивирования.
3-й день исследования
Изучают культуральные свойства бактерий на МПА и МПБ, делают мазок, окрашивают по Граму, микроскопируют. Убедившись в том, что бактериальная культура чистая, приступают к изучению ее биохимических (ферментативных) свойств, устанавливают подвижность, определяют чувствительность к антибиотикам и др.
В научно-исследовательской работе, особенно при генетических исследованиях, необходимо получать культуры заведомо из одной клетки. Такая культура называется клон. Для его получения чаще всего пользуются микроманипулятором. Этот прибор снабжен инструментами (иглами, пипетками) микроскопических размеров. С помощью держателя под контролем микроскопа их вводят в препарат с бактериями на предметном стекле и одну нужную клетку засевают в питательную среду.
Б. Биологические методы
Они основаны на учете тех или иных биологических особенностей выделяемых бактерий в чистую культуру.
1. Выделение спорообразующих микроорганизмов
При выделении чистых культур из исследуемого материала, содержащего споровые формы микробов, его прогревают 10 мин при 80° или 2-3 мин при 100° в расчете на то, что менее стойкие неспоровые формы погибнут при этой температуре. При этом споровые формы останутся жизнеспособными.
Из прогретого материала проводится посев на питательные среды, на которых вырастают спорообразующие микроорганизмы.
2. Выделение кислоустойчивых микроорганизмов.
Для выделения чистой культуры возбудителей туберкулеза и па-ратуберкулеза из патологического материала используют химический метод. С этой целью исследуемый материал после его гомогенизации обрабатывают 6%-ным раствором серной кислоты в течение 5-7 мин, добавляя ее в равном объеме. Благодаря этому погибают микробы сопутствующей микрофлоры, а кислотоустойчивые остаются жизнеспособными.
После нейтрализации раствора кислоты проводят посев на специальные питательные среды, на которых вырастают кислотоустойчивые микробы.
3. Выделение подвижных микроорганизмов (метод Шукевича)
Исследуемый материал, из которого выделяется подвижный микроб, засевают в конденсационную воду скошенного МПА. При посеве необходимо следить, чтобы петля с материалом не коснулась поверхности среды над конденсационной водой. Бактерии, обладающие активной подвижностью, вырастут не только в конденсационной воде, но и вне ее, на поверхности МПА. Из верхней части роста производят повторно посев в конденсат свежей питательной среды. Производя таким образом несколько пересевов, в конце концов получают чистую культуру подвижных бактерий.
4. Выделение патогенных микроорганизмов
Чистые культуры патогенных бактерий выделяют путем заражения исследуемым материалом лабораторных животных, наиболее восприимчивых к тому или иному возбудителю.
После гибели животного из крови и органов трупа делают посевы на питательные среды, на которых в большинстве случаев вырастает чистая культура возбудителя (этот метод подробно представлен в разделе «Заражение лабораторных животных»).
Задания для самостоятельной работы
1. Приготовить мазки-препараты из смеси бактерий, окрасить по Граму и провести микроскопию.
2. Овладеть техникой посева на скошенный МПА и МПБ.
3. Освоить методы и приемы выделения чистой культуры бактерий (1-й день исследования);
а) из смеси бактерий произвести рассев на солевой МПА для выделения чистой культуры стафилококка;
б) из смеси бактерий произвести рассев на среде Эндо для выделения чистой культуры кишечной палочки;
в) взвесь бактерий прогреть в течение 10 мин при 80° или 2-3 мин при 100°. Прогретую взвесь микробов рассеять на МПА для выделения чистой культуры вакцинного штамма сибиреязвенной палочки.
4. Посевы поместить в термостат и ознакомиться с его устройством.
5. Сведения о проделанной работе внести в бланк экспертизы.
Вопросы для самоподготовки и контроля знаний
1. Найдите каждому определению соответствующий термин:
1. Популяция микробов, состоящая из особей одного вида.
2. Культура микроорганизмов, полученная из одной особи (одноклеточная культура).
3. Культура микробов одного вида, выделенная из определенного источника (организм животного, окружающая среда).
4. Культура микроорганизмов одного вида, различающаяся по некоторым признакам (в пределах характеристики вида).
А. Клон. В. Вариант.
Б. Штамм. Г. Чистая культура.
2. В ветеринарную лабораторию поступил исследуемый материал после убоя животного с подозрением на туберкулез. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителей туберкулеза?
А. Прогреть при 80° 2-3 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
3. В ветеринарную лабораторию поступил несвежий патологический материал (кусочки мышц) после гибели коровы с подозрением на эмфизематозный карбункул. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителя?
А. Прогреть при 80° 15-20 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
4. В ветеринарную лабораторию на экспертизу поступили пробы мяса после вынужденного убоя животного. Необходимо исключить присутствие в них вульгарного протея, который может вызвать массовые отравления людей. Какой метод используете для выделения чистой культуры этого микроба?
А. Рассев на МПА в чашках Петри.
Б. Прогрев материала с последующим посевом на МПА.
Г. Посев на скошенный МПА в конденсат.
5. В ветеринарную лабораторию поступил исследуемый материал (ухо) от павшей нетели с подозрением на сибирскую язву. Какой метод используете для выделения чистой культуры возбудителя?
Источник
Культивирование бактерий. Изучение культуральных свойств
Описание презентации по отдельным слайдам:
Описание слайда:
Презентация на тему:
«Культивирование бактерий. Изучение культуральных свойств.»
Описание слайда:
Содержание
Химический состав бактериальной клетки.
Ферменты бактерий. Питание, дыхание, рост и размножение бактерий.
Питательные среды, их назначение, применение, классификация. Условия культивирования бактерий. Термостат, правила эксплуатации.
Выделение чистой культуры бактерий. Культуральные и биохимические свойства бактерий, их значение для дифференциации бактерий.
Особенности культивирования риккетсий и хламидий. Культивирование анаэробов.
Список использованной литературы.
Описание слайда:
Химический состав бактериальной клетки.
В состав бактерий входят белки, жиры, НК, углеводы, липиды, минеральные вещества.
Вода составляет 80% массы клетки.
Белки – 40-80% сухой массы бактерий (участвуют в процессах метаболизма, обладают ферментативной активностью).
Белки обладают антигенными и иммуногенными свойствами, вирулентностью и видовой принадлежностью.
НК (нуклеиновые кислоты) – 10-30% сухой массы.
ДНК определяет наследственность.
РНК – информационная, матричная, транспортная, рибосомальная.
Участвуют в биосинтезе белка.
Описание слайда:
Химический состав бактериальной клетки.
Углеводы – моно- и дисахариды составляют 12-18% сухой массы.
Крахмал и гликоген являются запасными питательными веществами.
Липиды входят в состав цитоплазматической мембраны и её производных. В цитоплазме откладываются на запас. Липиды представлены фосфолипидами, жирными кислотами и глицерином.
Минеральные вещества – 2-14% сухой массы. Фосфор, калий, натрий, сера, железо, кальций, магний, а также микроэлементы – цинк, медь, кобальт, барий, марганец.
Описание слайда:
Ферменты бактерий. Питание, дыхание, рост и размножение бактерий.
Ферменты – биологические катализаторы. Они катализируют тысячи химических реакций, из которых слагается метаболизм микроорганизма.
Ферменты представляют собой белки с молекулярной массой от 10000 до нескольких миллионов. Ферменты синтезируются самой микробной клеткой и имеют сложное строение.
Описание слайда:
Ферменты бактерий. Питание, дыхание, рост и размножение бактерий.
Описание слайда:
Ферменты бактерий. Питание, дыхание, рост и размножение бактерий.
1. Аутотрофы – бактерии, использующие для построения своих клеток углекислый газ.
2. Гетеротрофы – питаются готовыми органическими соединениями.
3. Сапрофиты – гетеротрофы, утилизирующие органические остатки отмерших организмов.
4. Паразиты – бактерии, существующие за счет органических веществ живых клеток и тканей, вызывающие заболевания у человека или животных.
5. Фототрофы — фотосинтезирующие бактерии.
6. Хемотрофы – бактерии, синтезирующие химическую энергию.
По способу питания:
Описание слайда:
Описание слайда:
Рост и размножение.
Рост – формирование структурно-функциональных компонентов клетки и увеличение самой бактериальной клетки.
Размножение – самовоспроизведение, приводящее к увеличению количества бактериальных клеток и популяции.
Бактерии размножаются бинарным делением пополам, реже – почкованием.
Описание слайда:
Питательные среды, их назначение, применение, классификация. Условия культивирования бактерий. Термостат, правила эксплуатации.
Различают среды:
по консистенции – жидкие, полужидкие и плотные.
по составу – простые, сложные.
по источнику – естественные и синтетические (искусственные).
по назначению – основные, универсальные, специальные, элективные, транспортные, дифференциально-диагностические, обогащенные, индикаторные.
Описание слайда:
Выделение чистой культуры бактерий. Культуральные и биохимические свойства бактерий, их значение для дифференциации бактерий.
Посев из пробирки в пробирку:
Обе пробирки держат в левой руке слегка наклонно, причем пробирку с посевным материалом держат ближе к себе. В правой руке, как писчее перо держат бактериальную петлю и прокаливают ее вертикально в пламени горелки. Мизинцем и краем ладони правой руки вынимают одновременно пробки из обеих пробирок- края пробирок обжигают в пламени горелки. Прокаленной петлей набирают немного посевного материала и вносят в пробирку с жидкой средой. Необходимо следить за тем, чтобы среда не вылилась и не касалась пробки.
После посева петлю извлекают из пробирки, края пробирки обжигают и, проведя пробку через пламя горелки, закрывают пробирку, после чего прокалывают петлю. Посев жидкого материала можно производить стерильными пастеровскими или градуированными пипетками. Пробирки с засеянной культурой этикируют и помешают в термостат
Способы посева микроорганизмов
Описание слайда:
Способы посева микроорганизмов.
Посев в чашку Петри шпателем
Левой рукой приоткрывают крышку. Материал набирают петлей или в пипетку, наносят на поверхность МПА и втирают шпателем по всей поверхности агара. При посеве материала, обильно обсемененного микрофлорой, используют 2-3 чашки для последовательного посева.
Описание слайда:
Способы посева микроорганизмов.
Посев в пробирку петлей
Полученные изолированные колонии служат для выделения чистой культуры микроба.
Осторожно приподняв крышку чашки, захватывают прокаленной и остуженной петлей одну отдельно расположенную колонию и вносят в пробирку с плотной питательной средой. Пробирку держат в наклонном положении в левой руке между большим и указательным пальцами. Правой рукой держат петлю с посевным материалом. Мизинцем, мякотью ладонью правой руки вынимают пробку из пробирки, обжигают в пламени горелки ее край и вносят в нее петлю, посев производят:
а) штрихами на поверхности агара;
б) уколом в столбик агара.
При посевах и пересевах внимание работающего должно быть обращено на соблюдение правил стерильности: чтобы с одной стороны не загрязнить свои посевы посторонней микрофлорой, а с другой — не явиться источником инфекции для окружающих.
Описание слайда:
Методы культивирования.
1. Температура
2. Влажность
3. Аэрация – потребность микробов в свободном кислороде.
4. Пассивная аэрация – культивирование на плотных и жидких средах в сосудах, закрытых ватным тампоном, или в чашках Петри.
5. Активная аэрация (выращивают в больших объёмах.
Сроки культивирования – 18-24 часа, но есть виды, растущие медленно ( до 4-6 недель).
Описание слайда:
Методы выделений чистых культур микроорганизмов.
Чистой культурой называют скопление микробов одного вида на плотной или в жидкой питательной среде.
Существует ряд методов выделения чистой культуры в зависимости от свойств изучаемого материала и цели исследования. Обычно чистые культуры получают из изолированных колоний — обособленных скоплений микробов на плотной среде.
Этапы выделения чистой культуры:
1-й день — получение изолированных колоний. Каплю исследуемого материала петлей, пипеткой или стеклянной палочной наносят на поверхность агара в чашке Петри. Шпателем втирают материал в поверхность среды; не прожигая и не перевертывая шпателя, производят посев на 2-й, а затем на 3-й чашке. При таком посеве на 1-ю чашку приходится много материала и соответственно много микробов, на 2-ю меньше и на 3-ю еще меньше.
2-й день — изучают рост микробов на чашках. В 1-й чашке обычно бывает сплошной рост — выделить изолированную колонию не удается. На поверхности агара во 2-й и 3-й чашке вырастают изолированные колонии. Их изучают невооруженным глазом, с помощью лупы, при малом увеличении микроскопа и иногда в стереоскопическом микроскопе. Нужную колонию отмечают со стороны дна чашки и пересевают на скошенный агар. Посевы ставят в термостат.
Описание слайда:
Методы выделений чистых культур микроорганизмов (продолжение)
3-й день — изучают характер роста на скошенном агаре. Делают мазок, окрашивают его и, убедившись в том, что культура чистая, приступают к ее изучению. На этом выделение чистой культуры заканчивается. Выделенная из определенного источника и изученная культура, называется штаммом.
При выделении чистой культуры из крови (гемокультуры) ее предварительно «подращивают» в жидкой среде: 10-15 мл стерильно взятой крови засевают в 100-150 мл жидкой среды. Так поступают потому, что в крови обычно мало микробов. Соотношение засеваемой крови и питательной среды 1:10 не случайно — так достигается разведение крови (неразведенная кровь губительно действует на микроорганизмы). Колбы с посевом ставят в термостат. Через сутки (иногда через большее время в зависимости от выделяемой культуры) из содержимого колб делают высевы на чашки для получения изолированных колоний. При необходимости повторяют высевы с интервалами 2-3 дня.
В ряде методов для получения чистых культур используют биологические особенности выделяемого микроба. Например, при выделении спорообразующих бактерий посевы прогревают при 80° С 10 мин, убивая этим вегетативные формы; при выделении возбудителя туберкулеза, устойчивого к кислотам и щелочам, с помощью этих веществ посевной материал освобождают от сопутствующей флоры; для выделения пневмококка и палочки чумы исследуемый материал вводят белым мышам — в их организме, высокочувствительном к данным возбудителям, эти микробы размножаются быстрее других.
В научно-исследовательской работе, особенно при генетических исследованиях, необходимо получать культуры заведомо из одной клетки. Такая культура называется клон. Для ее получения чаще всего пользуются микроманипулятором — прибором, снабженным инструментами (иглами, пипетками) микроскопических размеров. С помощью держателя под контролем микроскопа их вводят в препарат «висячая капля», извлекают нужную клетку (одну) и переносят ее в питательную среду.
Описание слайда:
Ферментативная активность
Ферментативная активность микроорганизмов богата и разнообразна. По ней можно установить не только видовую и типовую принадлежность микроба, но и определить его варианты (биовары).
Протеолитические свойства (способность расщеплять белки, полипептиды) изучают на средах с желатином, молоком, сывороткой, пептоном. При росте на желатиновой среде микробов, ферментирующих желатин, среда разжижается.
Гемолитические свойства (способность разрушать эритроциты) изучают на средах с кровью. Жидкие среды становятся прозрачными, а на плотных средах вокруг колонии появляется прозрачная зона.
Описание слайда:
Сохранение культур.
Высушивание проводят в специальных аппаратах. Хранят культуры при 4°С, лучше при – 30… +70°С.
Длительно сохранять культуры можно также в жидком азоте (-196°С) в специальных приборах.
Методы непродолжительного сохранения:
Субкультивирование;
Сохранение по слоем масла;
Хранение при -20… +70°С;
Хранение в запаянных пробирках.
Описание слайда:
Особенности культивирования риккетсий и хламидий. Культивирование анаэробов.
Культивирование анаэробов сложнее, чем аэробов, так как их необходимо лишить доступа свободного кислорода воздуха. Для этого удаляют воздух из питательной среды различными способами.
Культивирование актиномицетов, грибов, микоплазм, L-форм, спирохет и простейших.
Культивирование этих микроорганизмов принципиально сходно с культивированием бактерий. Для них разработаны специальные среды и подобраны режимы, соответствующие их потребностям.
Культивирование риккетсий и вирусов.
Риккетсии и вирусы являются облигатными паразитами, т. е. могут развиваться только в живых клетках. Их культивируют в культурах тканей, организме экспериментальных животных, развивающихся куриных эмбрионах.
Описание слайда:
Список использованной литературы.
1. Основы микробиологии и иммунологии: Камышева К.С. 2015г. Ростов-на-Дону
2. http://meduniver.com/Medical/Microbiology/68.html
3. http://bsmy.ru/3692
4.http://biologylib.ru/books/item/f00/s00/z0000015/st010.shtml
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Источник