Особенности культивирования анаэробных бактерий
Важным условием, которое необходимо соблюдать на всех этапах выделения и идентификации анаэробов, является защита этих микробов от токсического действия молекулярного кислорода. Время между взятием материала и его посевом на питательные среды должно быть максимально коротким.
Анаэробные бактерии можно культивировать только на специальных бескислородных средах с низким окислительно-восстановительным потенциалом (10 — 150мВ). Для контроля за степенью насыщения этих сред кислородом используют специальные редокс — индикаторы (метиленовый синий, резазурин), восстановленные формы которых бесцветны. При возрастании окислительно-восстановительного потенциала (ОВП) метиленовый синий окрашивает среды в синий, а резазурин — в розовый цвет, что указывает на непригодность таких сред для культивирования облигатных анаэробов. Для сохранения низкого ОВП питательные среды должны быть агаризированы. Добавление даже 0,05% агара повышает их вязкость и уменьшает аэрацию.
Анаэробный тип энергетического метаболизма во много раз менее продуктивный, чем аэробный, поэтому питательные среды для анаэробов должны быть богаче питательными субстратами и витаминами. В практических лабораториях для выделения анаэробов из патологического материала чаще всего используют среду для контроля стерильности крови (СКС), среду Китта-Тароцци, анаэробный кровяной агар (на основе эритрит-агара или агара Д), среду Вильсона — Блера, среду Шедлера и др. Эти свежеприготовленные питательные среды должны быть использованы для посева в течение 2-х часов во избежание насыщения кислородом.
Методы создания анаэробных условий. Создание анаэробных условий достигается с помощью физических, химических, биологических и смешанных методов.
Физические методы. Основаны на выращивании микроорганизмов в безвоздушной среде, что достигается:
1. посевом в среды, содержащие редуцирующие и легко окисляемые вещества; В качестве редуцирующих веществ обычно используют кусочки (около 0,5 г) животных тканей (печень, мозг, почки, селезенка, кровь). Эти ткани связывают растворенный в среде кислород и адсорбируют бактерии. Чтобы уменьшить содержание кислорода в питательной среде, ее перед посевом кипятят 10-15 мин, а затем быстро охлаждают и заливают сверху небольшим количеством стерильного вазелинового масла. В качестве легко окисляемых веществ используют глюкозу, лактозу и муравьинокислый натрий. Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта-Тароцци, которая используется для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов.
2. посевом микроорганизмов в глубину плотных питательных сред. Посев микроорганизмов в глубину плотных сред производят по методу Вейнберга
Метод Вейнберга. 1-2 капли материала со среды Кита-Тароцци вносят в пробирку с МПБ для разведения. Затем пастеровской пипеткой с запаянным концом переносят материал последовательно в 3-5 узких пробирок с сахарным МПА, предварительно расплавленным и прокипяченным в течение 20 мин и остуженным до 50°С, погружая капилляр пипетки в расплавленный агар до дна пробирки. Засеянные пробирки быстро охлаждают под струей холодной воды, при этом агар застынет и зафиксирует разобщенное положение отдельных микробных клеток. Инкубируют в анаэробных условиях. Через сутки отбирают колонии, на уровне колонии пробирку распиливают, колонию отсасывают пипеткой и переносят в среду Китта-Троцци для накопления и идентификации.
3. механическим удалением воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы; Удаление воздуха производят путем его механического откачивания их специальных приборов — анаэростатов, в которые помещают чашку с посевом анаэробов. Переносной анаэростат представляет собой толстостенный металлический или пластиковый цилиндр с хорошо притертой крышкой (с резиновой прокладкой), снабженный отводящим краном и вакуумметром. После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса.
4. заменой воздуха в сосуде каким-либо индифферентным газом. Замену воздуха индифферентным газом (азотом, водородом, аргоном, С02) можно производить в анаэростатах путем вытеснения его газом из баллона.
Приборы и среды для культивирования анаэробов:
Микроанаэростат — используется для создания вакуума с дозированным содержанием кислорода. Прибор представляет собой герметически закрывающийся сосуд, снабженный манометром, в который помещают посевы и откачивают воздух. Микроанаэростат помещают в термостат.
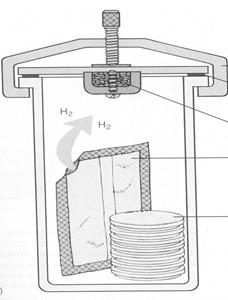
Эксикатор — стеклянный лабораторный сосуд с притертой крышкой. В его донной части имеется дополнительная емкость, куда наливается смесь пирогаллола и едкого натра или гидросульфита натрия и двууглекислой соды. На сетку-подставку помещают посевы и притирают крышку с помощью вазелина. Эксикатор помещают в термостат.

Винтовой зажим с герметичной прокладкой
Рис. 9 Газогенераторные пакеты
Система Generbag anaer состоит из воздухонепроницаемых емкостей, изготовленных из прозрачной пластмассы и генераторов, содержащих смесь веществ, поглощающих кислород (рис. 9). При применении GasPak Plus необходимо увлажнить таблетку боргидрида натрия, при этом выделяется водород и в присутствии палладиевого катализатора он соединяется с кислородом с образованием воды. Последовательность работы: вынуть генератор из пакета, поместить в нижнюю часть воздухонепроницаемого пакета, затем поместить чашки (или пробирки) с посевами и закрыть пакет. Инкубация при 37°С.
Анаэробный бокс — прозрачная плексиглассовая камера со шлюзом, отверстиями для рук с рукавами, заканчивающимися резиновыми перчатками. В нем создаются стерильные условия, его заполняют газовой смесью и поддерживают температуру 37°С.
Среда Китта-Тароцци. Содержит мясо-пептонный бульон (МПБ), 0,5% глюкозы и 0,15% агара. На дно пробирки для адсорбции О2 помещают кусочки вареной печени или фарша слоем 1-1,5 см и заливают 6-7 мл среды. Среду перед посевом регенерируют (прогревают 15-20 мин на водяной бане для удаления воздуха, а затем быстро охлаждают). После посева среду заливают вазелиновым маслом и помещают в термостат.
Полужидкий сахарный агар (высокий столбик). В пробирку с 6-7 мл расплавленного и охлажденного до 40-45 0 полужидкого питательного агара, содержащего 0,5-1% глюкозы, вносят исследуемый материал и перемешивают. Посевы помещают в термостат.
Химические методы. Основаны на поглощении кислорода воздуха в герметически закрытом сосуде (анаэростате, эксикаторе) такими веществами, как пирогаллол или гидросульфит натрия.
1. Применение щелочных растворов пирогаллола для поглощения кислорода в замкнутой воздушной среде.
2. Можно применять гидросульфит натрия. Для связывания кислорода в 1 л объема берут 100 мл свежеприготовленного 20% раствора Na2S204и 16 мл 50% КОН.
3. Использование веществ — редуцентов, к которым относятся тиогликолевая кислота или тиогликолат натрия (0,01-0,02%), аскорбиновая кислота (0,1%), различные сахара (0,1-3%), цистин и цистеин (0,03-0,05%), муравьинокислый натрий (0,25-0,75%) и др.
Применение газогенерирующих систем для создания анаэробных условий в замкнутой воздушной среде (микроанаэростатах, эксикаторах, прозрачных газонепроницаемых пластиковых пакетах). Для образования водорода и двуокиси углерода, необходимых для роста облигатных анаэробов, используют специальные таблетки, которые активируются добавлением воды. Водород, генерируемый таблетками боргидрида натрия, связывает кислород воздуха в присутствии палладиевого катализатора с образованием воды. Углекислый газ вырабатывается при взаимодействии лимонной кислоты с бикарбонатом натрия.
Биологические методы
1. Совместное выращивание анаэробов и аэробов (метод Фортнера). При этом на одну половину чашки Петри с плотной питательной средой засевают исследуемый материал, а на другую — культуру аэробного микроорганизма, способного энергично поглощать кислород. После посева чашку закрывают крышкой, края которой для герметизации заливают парафином или заклеивают пластилином. В качестве активного поглотителя кислорода из замкнутого пространства часто используют культуру “чудесной палочки” (Serratia marcescens), которая является своеобразным индикатором качества анаэробиоза. При недостаточной герметизации чашки этот микроорганизм образует ярко-красный пигмент, а при сохранении строго анаэробных условий вырастают бесцветные или бледно-розовые колонии.
2. Помещение в питательную среду кусочков печени, головного мозга, почек и других внутренних органов. При этом тканевые клетки активно поглощают и адсорбируют на себе кислород, в результате чего в среде создаются анаэробные условия. Примером питательной среды, сконструированной по этому принципу, является содержащая кусочки печени среда Китта — Тароцци. К тому же в печеночной ткани содержится большое количество веществ с SH-группой (цистеин, глютатион и др.), обладающих сильным редуцирующим действием.
3. Культуры некоторых облигатных анаэробов можно поддерживать путем пассажа на лабораторных животных, однако в настоящее время этот метод используется достаточно редко.
Комбинированные методы основаны на сочетании физических, химических и биологических методов создания анаэробиоза, и используются в большинстве практических лабораторий. Для работы с наиболее чувствительными к молекулярному кислороду анаэробами используют строгую анаэробную технику (метод Хангейта). Принцип метода заключается в использовании лишенных кислорода питательных сред, воздух над которыми удаляется и замещается бескислородным газом.
III. План практической работы
1. Изучить аппаратуру для стерилизации, культивирования бактерий аэробов и анаэробов, зарисовать схему устройства микроанаэростата
2. Изучить технику и зарисовать схемы посевов исследуемого материала на питательные среды с целью получения изолированных колоний
3. Выписать цель и схему бактериологического метода исследования
4. Ознакомиться с питательными средами и заполнить таблицу «Питательные среды».
5. Заполните таблицу «Основные методы стерилизации»
6. Посеять смесь бактерий истощающим штрихом на МПА с целью выделения чистой культуры
7. Решить ситуационные задачи
IV. Примеры ситуационных задач
Ситуационная задача № 1
Из материала больного выделили кишечную палочку. Какие питательные среды используют для того, чтобы выделить чистую культуру и отличить ее от других представителей кишечной микрофлоры:
1. Дифференциально-диагностические среды
2. Универсальные среды
3. Среды обогащения
4. Синтетические среды
Ситуационная задача № 2
Для проведения бактериологических исследований необходимо подготовить стерильные чашки Петри, пипетки, колбы и др. посуду. Какой метод стерилизации используют:
1. Стерилизацию сухим жаром
2. Стерилизацию облучением
3. Химическую стерилизацию
4. Стерилизацию текучим паром
Ситуационная задача № 3
Из больного с опасением на анаэробную инфекцию взяли материал (раневой экссудат). Какие среды используют для культивирования возбудителя:
1. Среду Китта-Тароцци
2. Среду Вильсона — Блера
3. Среду Плоскирева
Ситуационная задача № 4
Врач-бактериолог в мазке из исследуемого материала выделил смесь нескольких микроорганизмов. Что необходимо для дальнейшей идентификации возбудителя:
1. Получение чистых культур микроорганизмов
2. Посев исследуемого материала на среду накопления
3. Произвести реакцию агглютинации с поливалентными сыворотками
4. Произвести посев материала на ряд Гиса
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Источник
Методы культивирования анаэробных микробов
Читайте также:
|
| Последовательность действий (этапы) | Способы действия (ориентиры) |
| I. Методы культивирования анаэробов | 1. Ознакомиться с анаэробным эксикатором, с характером роста на средах Китта-Тароцци, Вильсона-Блера, в агаре столбиком. 2. Ознакомиться по демонстрационным посевам с методом выделения чистых культур анаэробов: по Цейслеру, Вейнбергу, Фортнеру. |
| II. Выделение чистых культур анаэробов (I – II этапы) | 1. Разобрать и записать в дневник I этап выделения чистой культуры анаэробов. 2. Со среды Китта-Тароцци приготовить мазок, окрасить по Граму, микроскопировать, зарисовать, сделать вывод – к какому семейству принадлежат бактерии. 3. Произвести посев со среды Китта-Тароцци по методу Вейнберга с последующим заполнением агаром трубок Вейон-Виньяла. Записать в дневник, обосновав цель посева. |
| III. Выделение чистой культуры анаэробов (III этап) | 1. Наметить план исследования II этапа. 2. Изучить и описать выросшие на чашке колонии; для оценки правильности методики посева чашку показать преподавателю. 3. Отметить колонии, принадлежащие к разным видам бактерий, приготовить из них мазки, окрасить по Граму, микроскопировать и зарисовать. 4. Произвести пересев одной из колоний на косой агар. |
· записать в виде таблицы схему описания колоний;
· зарисовать пробирки, демонстрирующие характер роста на жидких средах и пигментообразующие бактерии.
Тема:«Ферменты бактерий. Биохимическая активность микробов, бактериологический метод исследования (продолжение)»
Цель:
– освоить бактериологический метод исследования.
Задачи:
– овладеть навыками идентификации чистой культуры
– уметь определять сахаролитическую, протеолитическую активность
и редуцирующую способность микроорганизмов, правильно
оценивать полученные результаты.
В основе метаболических реакций, протекающих в клетке, лежит деятельность ферментов – особых белков, которые являются биокатализаторами. Ферменты обеспечивают протекание реакции в физиологических условиях Микробы синтезируют разнообразные ферменты.
Эндоферменты — функционируют в клетке и находятся и цитоплазме.
Экзоферменты — выделяются в окружающую среду.
Конституционные ферменты — постоянно присутствуют и клетке в одинаковых концентрациях.
Изучение биохимических свойств бактерий в медицинской микробиологии является одним из основных методов при идентификации вида возбудителя. Особое значение этот метод имеет вдиагностике кишечных инфекций (колиэнтеритов, брюшного тифа, сальмонеллезов, дизентерии).
Длябиохимической дифференциации выделенной культуры определяются сахаролитические и протеолитические свойства. Для обнаружения этих свойств делают посев на дифференциально-диагностические среды, содержащие вещества, в отношении которых бактерии способны проявлять ферментативную активность.

| Название микроба | Сахаролитические | Протеолитические | |||
| Лактоза | Глюкоза | Мальтоза | Маннит | МПБ | Разжи-жение жела-тины |
| Индол | NH3 | H2S |
Дата добавления: 2015-05-08 ; просмотров: 67 ; Нарушение авторских прав
Источник