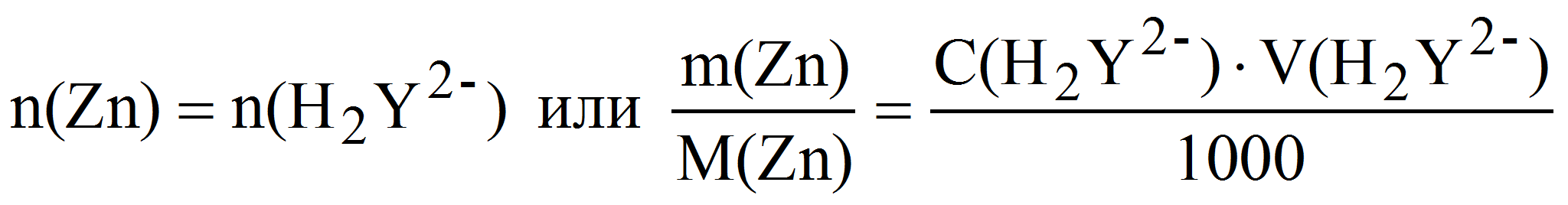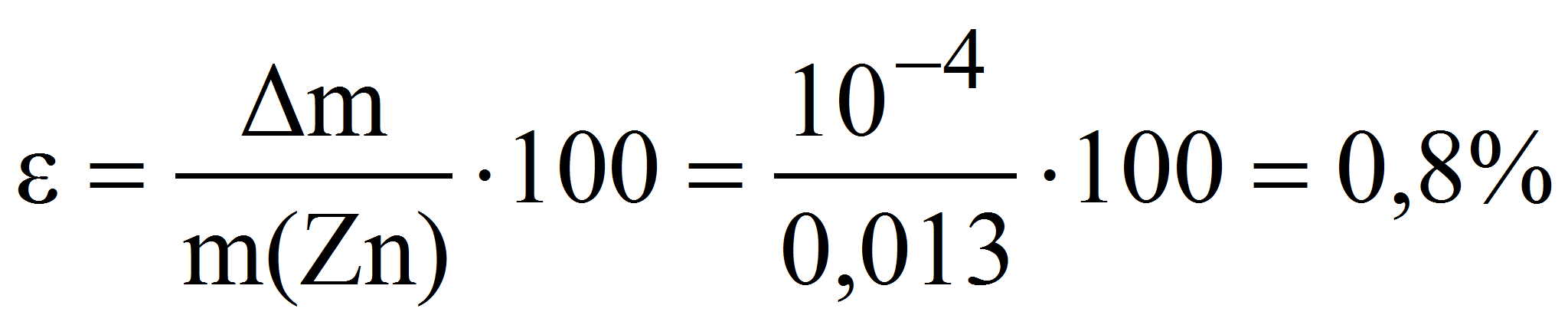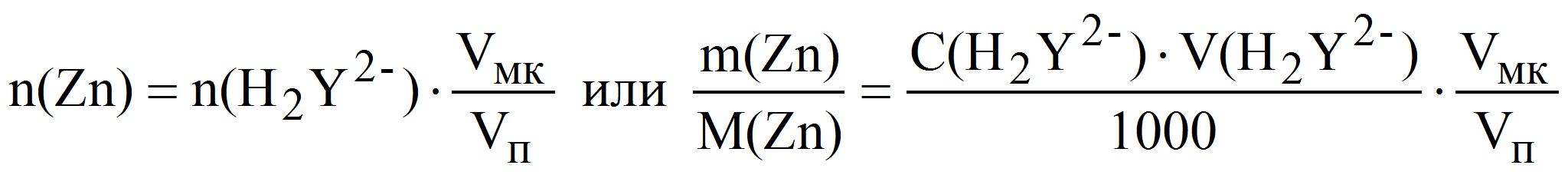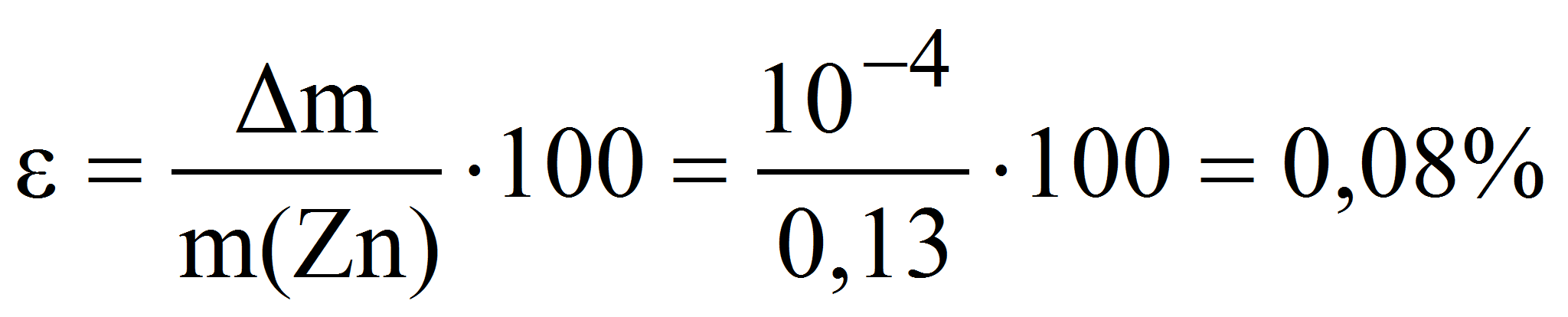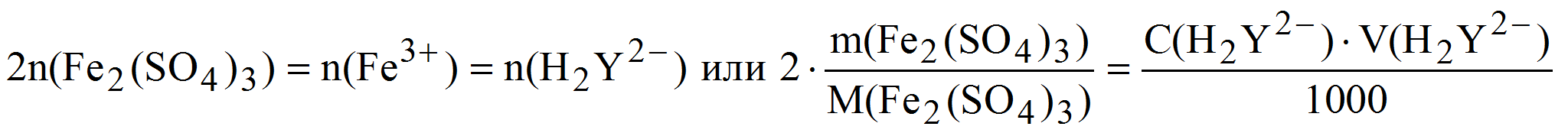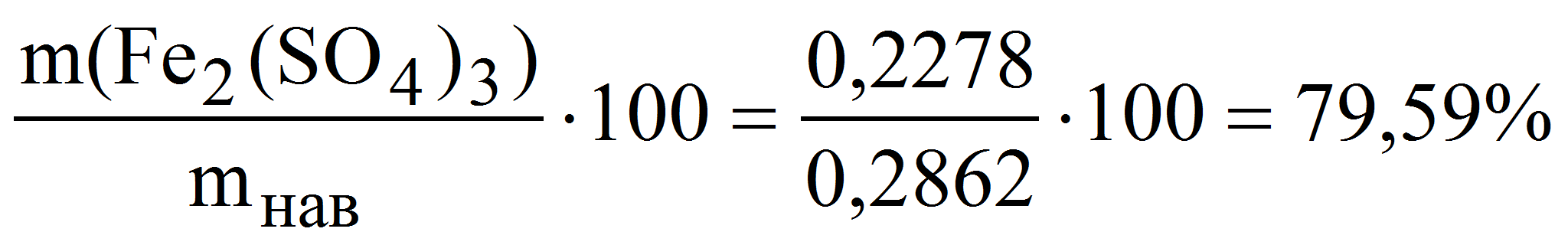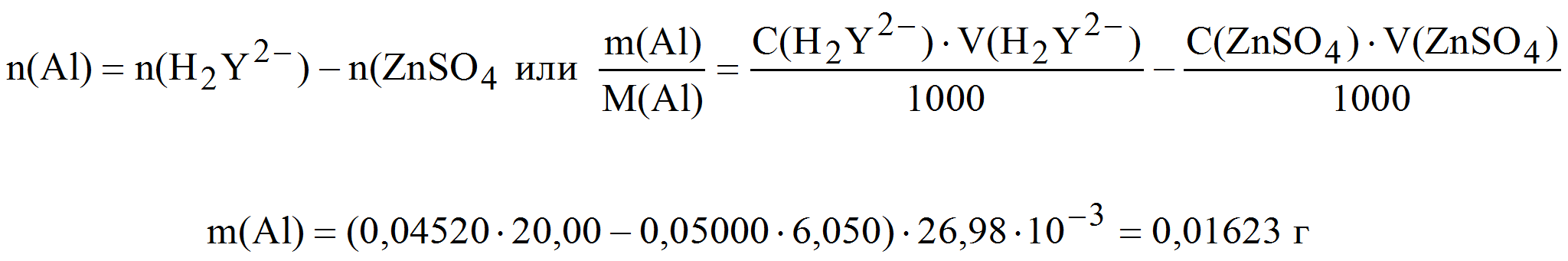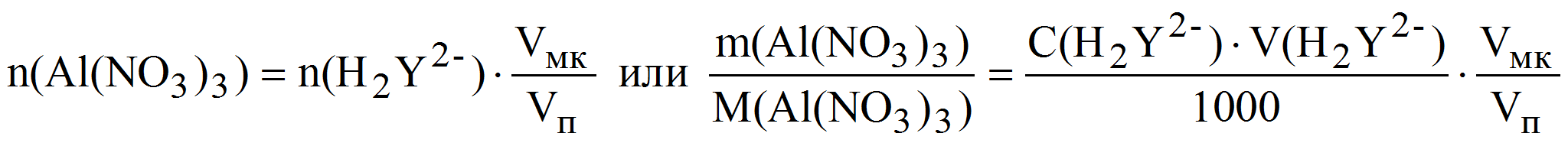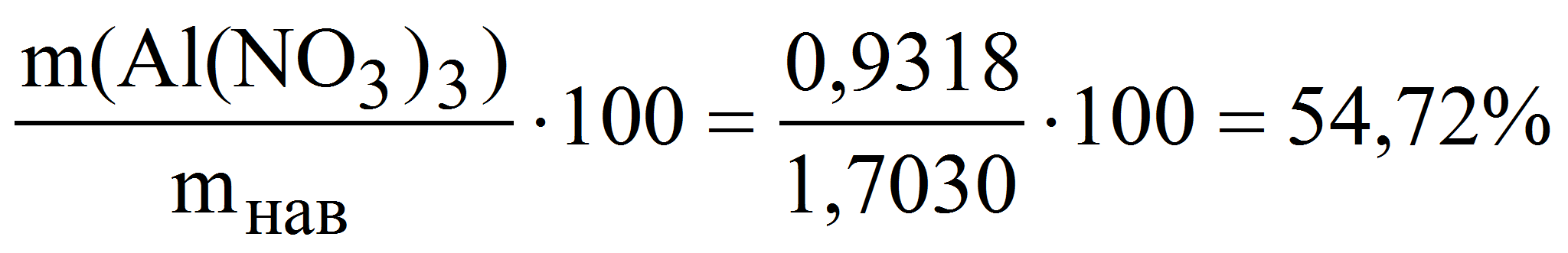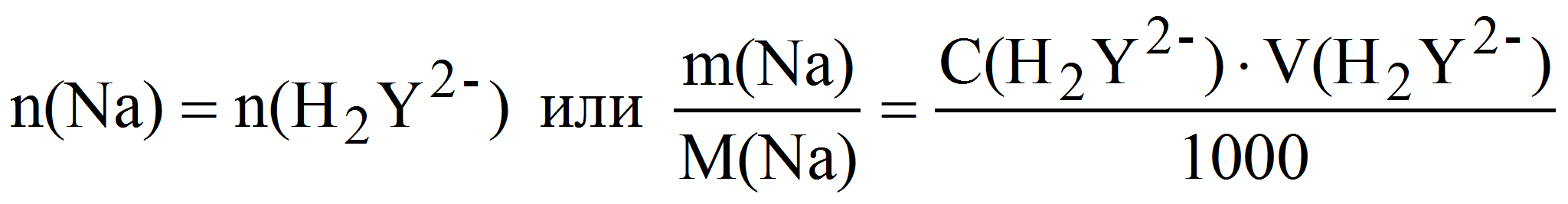Способы комплексонометрического титрования



Прямое титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, металлоиндикатор и титруют стандартным раствором трилона Б. Способом прямого титрования определяют катионы Cu 2+ , Со 2+ , Pb 2+ , Ni 2+ , Zn 2+ , Fе 3+ , Ва 2+ , Сг 3+ ,Ca 2+ , Mg 2+ и т. д.
Обратное титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, затем точно отмеренный удвоенный минимальный объем (35,00-40,00 см 3 ) стандартного раствора трилона Б, который вступает в реакцию с определяемыми ионами, а его избыток оттитровывают стандартным раствором магния сульфата или цинка сульфата в присутствии металлоиндикатора. При этом протекают реакции:
Ме 2+ + H2L 2- ↔ [Ме] 2- + 2Н +
изб. H2L 2- + Zn 2+ ↔ [ZnL] 2- + 2Н +
Способ обратного титрования применяют:
1. когда реакция комплексообразования протекает медленно;
2. нет подходящего индикатора для фиксирования конечной точки титрования при прямом способе титрования;
3. индикатор образует с определяемым ионом очень прочный комплекс, который не разрушается комплексоном;
4. для определения катионов в нерастворимых в воде осадках например Са 2+ в СаС2О4, Mg 2+ в MgNH4PО4, Рb 2+ в PbSО4
Заместительное титрование. Метод основан на том, что большинство ионов образуют с трилоном Б более устойчивые комплексные соединения, чем комплекс катионов Mg 2+ с трилоном Б [MgL] 2- (β = 9,72). После прибавления к анализируемому раствору комплекса [MgL] 2- протекает реакция обмена:
[MgL] 2- + Ме 2+ → [MeL] 2- + Mg 2+
Эта реакция возможна потому, что ионы металла образуют с H2L 2- более прочное комплексное соединение [MeL] 2- (β > 9,2), и равновесие вышеприведенной реакции смещается вправо. Выделившиеся ионы Mg 2+ оттитровывают стандартным раствором трилона Б в присутствии металлохромного индикатора:
Mg 2+ + H2L 2- → [MgL] 2- + 2Н +
Трилонометрическим методом определяют:
а) общую жесткость воды;
б) практически все катионы щелочноземельных и тяжелых металлов;
в) в фармацевтическом анализе — лекарственные формы, содержащие катионы щелочноземельных металлов.
Источник
7. Способы комплексонометрического титрования
Известны следующие четыре способа проведения комплексонометрического титрования – прямое титрование, обратное титрование (по остатку), титрование по способу вытеснения (замещения), косвенное титрование.
Прямое титрование – наиболее распространенный прием, когда к анализируемому раствору, содержащему ион определяемого металла, прибавляют рабочий раствор комплексона (титрант) до тех пор, пока не будет дотигнута точка эквивалентности, которую устанавливают с помощью индикатора. Прямое титрование удобно применять если есть возможность подобрать соответствующий индикатор и взаимодействие иона металла с комплексоном протекает достаточно быстро.
По результатам титрования рассчитывают содержание определяемого элемента. Расчеты в комплексонометрии можно проводить по закону эквивалентов, как это делается в других методах титрования. При этом следует учитывать, что при взаимодействии иона металла в любой степени окисления с комплексоном (ЭДТА) выделяется два иона водорода:
M n+ + H2Y 2- MY n-4 + 2H +
Поэтому факторы эквивалентности ЭДТА и иона металла, независимо от его заряда, всегда равны ½. Уравнение материального баланса в этом случае в соответствии с законом эквивалентов выглядит следующим образом:
Поскольку по уравнению реакции на 1 моль металла всегда приходится 1 моль комплексона, то расчеты можно производить также исходя из равенства числа моль или миллимоль, учитывая при необходимости стехиометрические коэффициенты.
Пример 6. Какую навеску металлического цинка следует растворить в серной кислоте при определении точной концентрации 0,010 М раствора трилона Б с помощью макробюретки объёмом 25 мл: а) методом отдельных навесок; б) методом аликвотных частей (пипетирования), используя для этого мерную колбу и пипетку номинальным объёмом 100 и 10 мл соответственно? Рассчитать относительную погрешность взвешивания навески цинка на аналитических весах в обоих случаях.
Zn 2+ + H2Y 2- ZnY 2- + 2H +
Для расчета используем объём раствора комплексона равный 80% от объёма бюретки V(H2Y 2- ) = 0,8·25 = 20 мл.
а) метод отдельных навесок:
тогда m(Zn) = 0,010·20·65,37·10 -3 = 0,013 г и
б) метод аликвотных частей:
тогда m(Zn) = 0,010·20·65,37·10 -3 ·10 = 0,13 г и
Пример 7. Рассчитать массовую долю (%) сульфата железа() в образце, если после растворения его навески массой 0,2862 г в кислой среде на титрование израсходовали 22,38 мл 0,05 М (К = 1,018) раствора трилона Б.
Fe 3+ + H2Y 2- FeY — + 2H +
В одной молекуле Fe2(SO4)3 содержится два атома железа, тогда:
( Fe2(SO4)3) =
Задачу можно решить и по закону эквивалентов, тогда: n(1/4Fe2(SO)4) = n(1/2H2Y 2- ).
Обратное титрование (по остатку) – менее удобно, чем прямое, однако к нему приходится прибегать, когда для прямого титрования нельзя подобрать соответствующий индикатор, или когда катионы металла очень медленно взаимодействуют с титрантом, или когда при благоприятных значениях рН определяемый ион металла осаждается в виде гидроксидов. Во всех этих случаях к титруемому раствору прибавляют точно известный избыток комплексона, раствор выдерживают некоторое время для завершения реакции или ускоряют процесс нагреванием. Затем избыток комплексона титруют рабочим раствором соли другого металла (M’), для которого реакция с комплексоном соответствует всем требованиям, предъявляемым к реакциям комплексонометрического титрования. При обратном титровании комплексонат определяемого металла на определение точки эквивалентности практически не влияет, так как он образуется медленно и также медленно разрушается.
При обратном титровании уравнение материального баланса имеет вид:
или через эквиваленты:
n(1/2H2Y 2- ) = n(1/2M n+ ) + n(1/2M’ n+ )
Пример 8. Рассчитать массу алюминия в анализируемом растворе, если к этому раствору при рН=5 добавили 20,00 мл 0,04520 М раствора трилона Б, затем после окончания реакции добавили аммиак до рН=9 (образовалась аммонийная буферная смесь) и остаток комплексона, не вступивший в реакцию с алюминием, оттитровали с металлохромным индикатором эриохромом черным Т, затратив 6,050 мл 0,05000 М раствора сульфата цинка.
H2Y 2- ост + Zn 2+ ZnY 2- + 2H +
Составляем уравнение материального баланса n(H2Y 2- ) = n(Al) + n(ZnSO4), тогда:
Титрование по способу вытеснения (замещения) – применяют в тех же случаях, что и обратное титрование. При вытеснительном (заместительном) титровании к анализируемому раствору, содержащему ион определяемого металла, прибавляют избыток комплексоната другого металла, условная константа устойчивости которого в данной среде меньше таковой для определяемого металла. Обычно применяют комплексонат магния, константа устойчивости которого lgK(MgY 2- ) = 8,7 (табл.1) значительно меньше, чем для большинства металлов. При этом протекает реакция замещения, после чего вытесненные ионы магния титруют при рН=9 раствором ЭДТА с металлохромным индикатором эриохромом черным Т:
M n+ + MgY 2- MY n-4 + Mg 2+
Mg 2+ + H2Y 2- MgY 2- + 2H +
Чем больше разница в константах устойчивости MY n-4 и MgY 2- , тем полнее идет реакция замещения. Если вытеснение магния происходит медленно, необходимо анализируемый раствор выдержать некоторое время до окончания реакции или ускорить её нагреванием.
Таким способом нельзя определить ионы бария, так как K(BaY 2- ) 2- ) (табл.1). Однако, если к раствору, содержащему ионы бария, добавить достаточное количество аммиака и комплексонат цинка, то произойдет реакция:
После чего аммиакат цинка при рН=9 титруют комплексоном в присутствии металлохромного индикатора эриохрома черного Т. Такое течение реакции замещения становится возможным, так как в данных условиях K’(BaY 2- ) > K”(ZnY 2- ).
Уравнение материального баланса, связывающее количество определяемого вещества и титранта, в заместительном титровании аналогично прямому титрованию.
Пример 9. Навеску кристаллогидрата Al(NO3)3·xH2O массой 1,7030 г растворили в мерной колбе объёмом 200,0 мл и к аликвоте полученного раствора 20,00 мл прибавили избыток комплексоната Na2MgY. На титрование выделившихся ионов магния израсходовали 17,45 мл 0,02507 М раствора трилона Б. Рассчитать массовую долю (%) Al(NO3)3 в исходном препарате.
Al 3+ + MgY 2- AlY — + Mg 2+
Mg 2+ + H2Y 2- MgY 2- + 2H +
Из уравнения материального баланса имеем:
m(Al(NO3)3) = 0,02507·17,45·213,0·10 -3 ·10 = 0,9318 г
( Al(NO3)3) =
Косвенное титрование – применяется для определения ионов, не взаимодействующих с комплексоном непосредственно, например, катионов щелочных металлов и некоторых анионов, образующих малорастворимые соединения.
Таким образом определяют ионы натрия, осаждая их в виде натрийцинкуранилацетата – NaZn(UO2)3(CH3COO)9, который затем растворяют в кислоте и комплексонометрически определяют образовавшиеся ионы цинка. При этом n(Na + ) = n(Zn 2+ ) = n(H2Y 2- ).
Аналогично определяют и анионы. Например, фосфатный ион можно осадить в виде MgNH4PO4, а затем растворить его в кислоте и после ионообменного отделения фосфата определить магний с помощью трилона Б. При этом n(PO4 3— ) = n(H2Y 2- ).
Косвенное определение можно проводить и обратным титрованием. Например, при определении сульфатов к анализируемому раствору прибавляют точно известный избыток нитрата свинца и остаток последнего определяют комплексонометрически. Уравнение материального баланса при этом следующее: n(SO4 2- ) = n(Pb 2+ ) – n(H2Y 2- ).
Пример 10. Какая масса натрия содержалась в анализируемом растворе, если после осаждения его в виде натрийцинкуранилацетата полученный осадок отделили, растворили и на титрование образовавшихся ионов цинка затратили 20,85 мл 0,01 М (K = 0,9194) раствора трилона Б?
Zn 2+ + H2Y 2- ZnY 2- + 2H +
Уравнение материального баланса имеет вид:
откуда m(Na) = 0,01·0,9194·20,85·22,99·10 -3 = 0,4407 г
Работа 1. Определение точной концентрации рабочего раствора трилона Б.
Сущность работы: Определение основано на взаимодействии раствора трилона Б со стандартным раствором сульфата цинка в присутствии аммонийной буферной смеси (рН
9) по уравнению реакции:
Zn 2+ + H2Y 2- ZnY 2- + 2H +
Для определения конечной точки титрования применяется металлохромный индикатор эриохром черный Т.
Посуда и реактивы:
конические колбы для титрования на 100 мл – 2 шт.;
макробюретка на 25 мл – 1 шт.;
аммонийная буферная смесь (рН
сухая индикаторная смесь (тщательно растертые в ступке 0,5 г эриохрома черного Т и 50 г хлорида натрия);
раствор сульфата цинка с точно известной концентрацией.
Для работы следует получить в лаборантской водный раствор трилона Б с приближенной молярной концентрацией эквивалента 0,01-0,02 моль/л.
В конические колбы для титрования с помощью бюретки отбирают различные объемы (17-22 мл) стандартного раствора сульфата цинка. Затем аккуратно по каплям прибавляют 2 М раствор аммиака до появления белого осадка (гидроксид цинка) и его последующего растворения. К полученному раствору добавляют 10 мл аммонийной буферной смеси и сухую индикаторную смесь (на кончике шпателя) до получения фиолетовой окраски — очень интенсивная окраска не рекомендуется, так как при этом затрудняется наблюдение перехода окраски в конечной точке титрования. Далее титруют раствором трилона Б до перехода окраски в синюю (без примеси фиолетового), при этом последние капли титранта следует добавлять медленно, хорошо перемешивая раствор. Для облегчения определения конечной точки титрования можно приготовить раствор-свидетель, добавив к 50 мл дистиллированной воды 10 мл аммонийной буферной смеси, индикаторную смесь и немного раствора трилона Б до синей окраски. По показаниям бюретки определяют объём раствора трилона Б, пошедший на титрование, и полученные результаты заносят в таблицу:
Источник
Лекция 12. 1. Виды (приемы) комплексонометрического титрования (прямое, обратное, заместительное). Применение комплексонометрического титрования
1. Виды (приемы) комплексонометрического титрования
(прямое, обратное, заместительное).
Применение комплексонометрического титрования.
Как и в других титриметрических методах, в комплексонометрии применяют прямое, обратное и заместительное (косвенное) титрование. Наиболее точные результаты получают при прямом титровании.
Прямое титрование. При прямом титровании анализируемого раствора, содержащего определяемый катион металла, стандартным раствором комплексона в типичном эксперименте к аликвотной части раствора, взятой для титрования, прибавляют буферную смесь (часто ‒ аммиачный буфер) для достижения требуемого значения pH раствора, индикатор и титруют стандартным раствором комплексона до изменения окраски титруемого раствора.
Проиллюстрируем сказанное некоторыми примерами.
1)Стандартизация раствора сульфата магния MgSO4 раствором ЭДТА. Титрование проводят в щелочной среде аммиачного буфера при pH = 9,5‒10.
Таблица 1. Изменение окраски некоторых металлохромных индикаторов в ТЭ при прямом титровании катионов металлов раствором
Изменение окраски в ТЭ
Эриохром черный Т
РЗЭ-катионы редкоземельных элементов
К анализируемому раствору сульфата магния прибавляют аммиачный буфер для поддержания pH = 9,5‒10, индикатор эриохром черный Т (индикаторную смесь) и медленно титруют стандартным раствором ЭДТА до изменения окраски титруемого раствора от красно-фиолетовой на синюю.
При этом в системе осуществляются следующие процессы.
Введение индикатора H3Ind в исходный анализируемый раствор приводит к образованию растворимого красно-фиолетового комплекса магния Mglnd — с индикатором по схеме:
H3Ind = HInd2-+ 2Н+
Mg2+ + HInd2- = MgInd- + H+
Исходный анализируемый раствор окрашивается в красно-фиолето — вый цвет.
При добавлении титранта образуется растворимый, устойчивый, бесцветный комплекс магния с ЭДТА состава MgY2+:
Mg2+ + HY3- = MgY2- + H+
Вблизи ТЭ менее устойчивый комплекс Mglnd — разрушается с образованием более стабильного комплексоната MgY2- :
MgInd — + HY3- = MgY2- + HInd2-
Окраска раствора в ТЭ изменяется из красно-фиолетовой на синеголубую.
Расчеты концентрации и титра исходного раствора сульфата магния проводят обычным способом на основе закона эквивалентов, учитывая, что при образовании комплексоната магния состава 1:1 фактор эквивалентности как катиона магния, так и ЭДТА равен единице:
c(MgSO4)V(MgSO4) = с(ЭДТА) V(ЭДТА),
c(MgSO4) = с(ЭДТА) V(ЭДТА)/V(MgSO4),
где все обозначения ‒ традиционные.
1)Определение катионов свинца Рb2+. Титрование проводят в слабокислой среде при pH ≈ 5.
К аликвоте анализируемого раствора, содержащего свинец(II), прибавляют небольшое количество уротропина до достижения значения pH = 5 (по универсальной индикаторной бумаге) и несколько капель раствора индикатора ксиленолового оранжевого до получения отчетливой краснофиолетовой окраски раствора. Затем раствор титруют стандартным раствором ЭДТА до изменения цвета титруемого раствора из фиолетового на лимонно-желтый.
В системе происходят следующие превращения.
При введении индикатора H6Ind в исходный анализируемый раствор (pH ≈ 5) образуется растворимый красно-фиолетовый комплекс свинца(II) с индикатором состава PbH4Ind:
Pb2+ + H6Ind = PbH4Ind + 2Н+
Исходный анализируемый раствор принимает красно-фиолетовую окраску.
При титровании образуется устойчивый, растворимый, бесцветный комплекс свинца с ЭДТА состава PbY2- (при pH ≈ 5 ЭДТА присутствует в форме H2Y2-):
Pb2+ + H2Y2- = PbY2- + 2Н+
Вблизи ТЭ комплекс свинца с индикатором разрушается с образованием более прочного комплексоната свинца:
PbH4Ind + H2Y2- = PbY2- + H6Ind
Окраска титруемого раствора изменяется из красно-фиолетовой в желтую. Расчет концентрации и титра свинца(II) в анализируемом растворе проводят аналогично предыдущему:
с(Рb2+) = с(ЭДТА) V(ЭДТА)/V(Рb2+),
2) Определение катионов кальция Ca2+ . Катионы кальция определяются комплексонометрически титрованием анализируемого раствора содержащего Са2+, стандартным раствором ЭДТА в присутствии различных индикаторов: кальконкарбоновой кислоты (в щелочной среде NaOH) ‒ в ТЭ розовая окраска раствора переходит в синюю; хромового темно-синего (в аммиачном буфере) ‒ в ТЭ вишнево-красная окраска раствора переходит в сине-фиолетовую.
Са2+ + H2Ind3- = CaH2Ind —
При титровании образуется бесцветный, растворимый эдетеат кальция CaY2- (в рассматриваемых условиях ЭДТА присутствует в растворе в форме Y4-):
Вблизи ТЭ разрушается красный комплекс CaH2Ind — с образованием сине-фиолетовых анионов H2Ind3-:
CaH2Ind — + Y4- = CaY2- + H2Ind3-
Вследствие этого окраска раствора из красной переходит в синефиолетовую.
Расчет концентрации и титра Са2+ проводят аналогично расчетам, описанным выше.
3)Определение катионов магния и кальция при их совместном присутствии. Вначале в отдельной пробе анализируемого раствора определяют сумму катионов Mg2+ и Са2+ титрованием анализируемого раствора в аммиачном буфере (pH ≈ 10) стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т до перехода красной окраски титруемого раствора в фиолетово-синюю вследствие разрушения комплекса магния с индикатором:
MgInd — + HY3- = MgY2- + HInd2-
Затем в другой пробе анализируемого раствора определяют кальций. К раствору прибавляют щелочь для осаждения магния в виде гидроксида Mg(OH)2. Катионы кальция остаются в растворе. Их определяют титрованием стандартным раствором ЭДТА в присутствии индикатора мурексида до перехода красной окраски титруемого раствора в синефиолетовую вследствие разрушения комплекса кальция с индикатором:
CaH2Ind — + HY3- + ОН — = CaY2- + H2Ind3- + Н2O
Обратное титрование. Этот способ применяют тогда, когда проведение прямого титрования затруднено из-за медленного протекания реакции образования комплексоната или невозможности подбора соответствующего индикатора.
Для проведения обратного титрования в типичном эксперименте к анализируемому раствору, содержащему определяемый катион, прибавляют избыточное, по сравнению со стехиометрическим, количество стандартного раствора ЭДТА. После окончания реакции образования комплексоната определяемого катиона избыток не вступившего в реакцию ЭДТА оттитровывают стандартным раствором соли магния, цинка, свинца или других катионов в присутствии индикатора.
Так, при определении свинца методом обратного комплексономет — рического титрования к анализируемому раствору, содержащему катионы Рb2+, прибавляют избыток стандартного раствора ЭДТА, аммиачный буфер и небольшое количество индикаторной смеси эриохрома черного Т до приобретения раствором отчетливой синей окраски. Затем титруют стандартным раствором сульфата магния до изменения окраски титруемого раствора от синей до красно-фиолетовой.
В системе осуществляются следующие процессы.
Прибавление ЭДТА в анализируемый раствор приводит к образованию комплексоната свинца PbY2-
Pb2+ + H2Y2- = PbY2- + 2Н+
При добавлении аммиачного буфера (pH = 9,5—10) избыточные анионы H2Y2- переходят в HY3-:
H2Y2- + ОН — = HY3- + Н2O
Индикатор в этих условиях присутствует в форме HInd2-, придающей раствору синюю окраску.
При последующем титровании избыточных анионов HY3- раствором сульфата магния образуется комплексонат магния MgY2-:
HY3- + Mg2+ = MgY2- + H+
В ТЭ все анионы HY3- оказываются оттитрованными, поэтому прибавление первой же избыточной капли титранта ‒ раствора MgSO4 ‒ приводит к образованию красно-фиолетового комплекса MgInd-:
HInd2- + Mg2+ = MgInd — + H+
Окраска титруемого раствора из синей переходит в красно-фиолетовую.
Расчет концентрации и титра свинца(II) проводят, как обычно при обратном титровании:
n(ЭДТА) = n(РЬ2+) + n(MgSO4),
с(ЭДТА)V(ЭДТА) = c(Pb2+)V(Pb2+) + c(MgSO4)K(MgSO4),
c(Pb2+) = [с(ЭДТА) V(ЭДТ А) — c(MgSO4) V(MgSO4)]/V(Pb2+),
T(Рb2+) = с(Рb2+)M/(Рb2+)/ 1000,
где все обозначения ‒ традиционные.
Комбинируя осаждение с обратным титрованием, можно комплексонометрически определять не только катионы металлов, но и анионы, например, сульфид-, сульфат-, ортофосфат-, оксалат-ионы.
Принцип определения состоит в следующем. К анализируемому раствору, содержащему определяемый анион, прибавляют в избытке рас-
твор, содержащий точно известное количест твор, содержащий точно известное количество катиона металла, переводящего определяемый анион в осадок. Этот осадок отфильтровывают, а в фильтрате определяют содержание избыточных (не вступивших в реакцию с анионом) прибавленных катионов титрованием стандартным раствором ЭДТА.
Так, при определении сульфат-ионов их вначале осаждают в виде сульфата бария, прибавляя избыток растворимой соли бария (например, ВаС12) к анализируемому раствору.
Ва2+ + SO42- = BaSO4↓
Осадок BaSO4 отфильтровывают, а в растворе определяют остаточное содержание катионов Ва2+ титрованием стандартным раствором ЭДТА:
Ва2+ + H2Y2- = BaY2 + 2Н+
Аналогично определяют ортофосфат-ионы по схеме:
РО43- + Mg2+ + NH4+ = NH4MgPО4↓ (осаждение)
Mg2+ + H2Y2- = MgY2- + 2Н+ (титрование)
Оксалат-ионы можно определять по схеме:
С2O42- + Са2+ = СаС2O4↓ (осаждение)
Са2+ + H2Y2- = CaY2- + 2Н+ (титрование)
Заместительное титрование. В случае определения катионов металлов этот способ иногда называют вытеснительным титрованием.
К раствору, содержащему определяемые катионы металла, способные образовывать прочные комплексонаты, прибавляют избыток раствора, содержащего менее прочный комплексонат другого металла, например, магния или цинка. Менее прочный комплексонат разрушается с выделением катионов (магния или цинка), которые затем оттитровывают стандартным раствором ЭДТА.
Рассмотрим, например, определение катионов кальция Са2+ в растворе.
К анализируемому раствору, содержащему определяемые катионы кальция, прибавляют в избытке (по сравнению со стехиометрическим количеством) раствор, содержащий комплекс магния с ЭДТА. При этом протекает реакция:
Са2+ + MgY2- = CaY2- + Mg2+
Выделившиеся катионы магния в количестве, эквивалентном количеству катионов кальция, находившихся в анализируемом растворе, оттитровывают стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т до перехода окраски титруемого раствора из крас — но-фиолетовой в синюю
Mg2+ + HY3- = MgY2- + Н+
MgInd — + HY3- = MgY2- + HInd2-
Расчет концентрации Са2+ в исходном анализируемом растворе проводят по обычному способу для заместительного титрования, как и для прямого титрования:
n(Са2+) = n(Mg2+) = n(ЭДТА),
с(Са2+) V(Са2+) = с(ЭДТА)V(ЭДТА),
где все обозначения ‒ традиционные.
Аналогично можно определять катионы бария Ва2+ при прибавлении избытка раствора комплексоната цинка ZnY2- с последующим титрованием выделившихся катионов цинка стандартным раствором ЭДТА в аммиачном буфере.
Комбинированными способами заместительного и обратного титрования можно определять также анионы, например, сульфат-, фосфат-, хромат-ионы.
При определении сульфат-ионов их вначале осаждают хлоридом бария из анализируемого раствора в виде сульфата бария BaSO4. Осадок сульфата бария количественно отделяют от маточника и растворяют в избытке стандартного раствора ЭДТА в аммиачном буфере. Остаточное количество непрореагировавшего ЭДТА оттитровывают стандартным раствором сульфата магния или сульфата цинка в присутствии индикатора кислотного хромового темно-синего.
Для определения хромат-ионов СrO42- их вначале осаждают в виде хромата свинца РЬСrO4, прибавляя к горячему анализируемому раствору, содержащему хромат-ионы, горячий раствор нитрата свинца. Осадок количественно отделяют от маточника и растворяют в стандартном растворе ЭДТА в аммиачном буфере. Прибавляют индикатор кислотный хромовый темно-синий и медленно оттитровывают остаток непрореагировавшего ЭДТА стандартным раствором сульфата цинка до изменения окраски титруемого раствора из изумрудно-зеленой в коричнево-красную.
Аналогично можно определять ортофосфат-ионы, осаждая их в форме магнийаммонийфосфата NH4MgPO4·6Н2O с последующим растворением осадка и комплексонометрическим определением катионов магния.
Алкалиметрическое титрование в комплексонометрии. Способ основан на титровании стандартным раствором щелочи ионов водорода, выделяющихся при реакции катионов определяемого металла с ЭДТА, например, по схеме:
М2+ + H2Y2- = MY2- + 2Н+
Поскольку ионы водорода выделяются в количестве, эквивалентном количеству прореагировавших катионов металла, то, определив алкали — метрически количество выделившихся ионов водорода, можно найти содержание катионов металла в анализируемом растворе.
Способ не получил широкого распространения в аналитической практике.
2. Кривые титрования, их расчет и построение, анализ. Влияние различных факторов на скачок на кривой титрования (устойчивость комплексонатов, концентрация ионов металла и комплексона, рН раствора).
Кривая комплексонометрического титрования ‒ это графическое представление зависимости концентрации определяемых катионов металла в растворе от количества (обычно ‒ от объема) прибавляемого титранта. Часто кривые комплексонометрического титрования строятся в координатах рМ ‒ V(Т), где рМ = — lg[Mn+] ‒ показатель равновесной концентрации катионов Мn+ в растворе, V (Т) ‒ объем прибавленного титранта.
Кривые титрования можно также строить в координатах рМ ‒ f, где f ‒ степень оттитрованности раствора.
Рассмотрим построение кривой титрования на примере комплексонометрического титрования катионов металлов (титруемое вещество X) стандартным раствором ЭДТА (титрант Т) в сильно щелочной среде, когда мольная доля ионов Y4- равна ɑ=1, т. е. весь незакомплексованный ЭДТА находится в форме анионов Y4-.
Пусть требуется рассчитать и построить кривые комплексонометрического титрования V(Х) = 100 мл = 0,1 л с концентрацией с (Х) = 0,1 моль/л водных щелочных растворов СаCl2 и ZnCl2 раствором ЭДТА с молярной концентрацией с (Т) = 0,1 моль/л при pH = 12.
При титровании протекает реакция образования комплексонатов MY2-:
где М2+ = Са2+ или Zn2+.
Концентрационная константа устойчивости комплексов β равна:
Расчет рМ = -lg[M2+] до точки эквивалентности. В исходном анализируемом растворе до начала титрования
В процессе титрования катионы М2+ связываются в прочный комплекс, их концентрация в растворе уменьшается:
Расчет рМ в точке эквивалентности. В ТЭ все катионы М2+ оттитрованы с образованием комплекса MY2-. Небольшая часть комплекса диссоциирует по схеме:
поэтому равновесные концентрации [М2+] и [Y4-] одинаковы: [М2+] = [Y4-]. Из выражения для концентрационной константы устойчивости
находим квадрат равновесной концентрации катионов металла:
Концентрация [М2+] в ТЭ пренебрежимо мала (практически все катионы М2+ связаны в комплекс), поэтому:
[MY2- ] = с(М2+) ‒ [М2+] = с(М2+) = с(Х),
где с(М2+) = 0,1 моль/л ‒ концентрация определяемых катионов металла в исходном анализируемом растворе. Тогда:
Зная значение константы устойчивости комплексоната, можно рассчитать величину рМ в ТЭ.
Расчет рМ после точки эквивалентности. Равновесную концентрацию катионов М2+ в растворе после ТЭ можно рассчитать из выражения для константы устойчивости комплексоната:
-lg[M2+] = — lgc(X) + lgβ + lg[Y4-],
pM = pc(X) + lgβ + lg[Y4-].
Рассчитаем равновесную концентрацию [Y4-]:
Вычислив величину [Y4-], можно найти значение рМ после ТЭ.
Таблица конечных данных. По полученным выше формулам рассчитаем значения рМ в различные моменты титрования, учитывая, что с(Х) = с(Т) = 0,1 моль/л; V(Х) = 100 мл = 0,1 л; lgβ (CaY2-) = 10,6; lgβ (ZnY2-) = 16,3.
Рассчитанные значения рМ представлены в табл. 1.2.
Таблица 2. Рассчитанные значения рСа и pZn в различные моменты
титрования 100 мл растворов солей кальция и цинка (с(Са2+) = с(Zn2+) = 0,1 моль/л ) стандартным 0,1 моль/л раствором ЭДТА
Источник