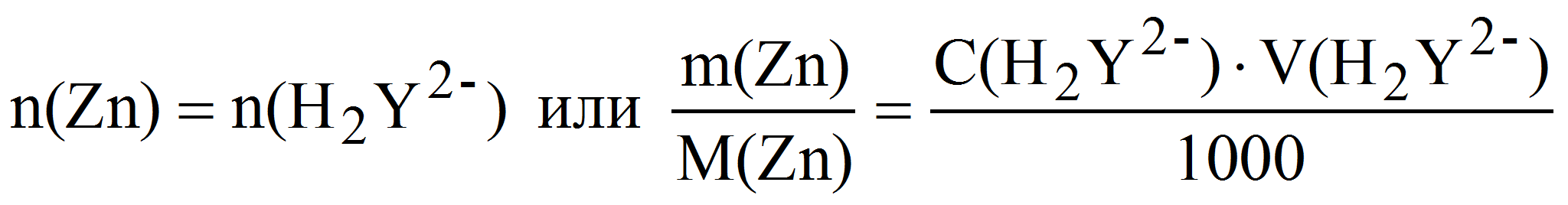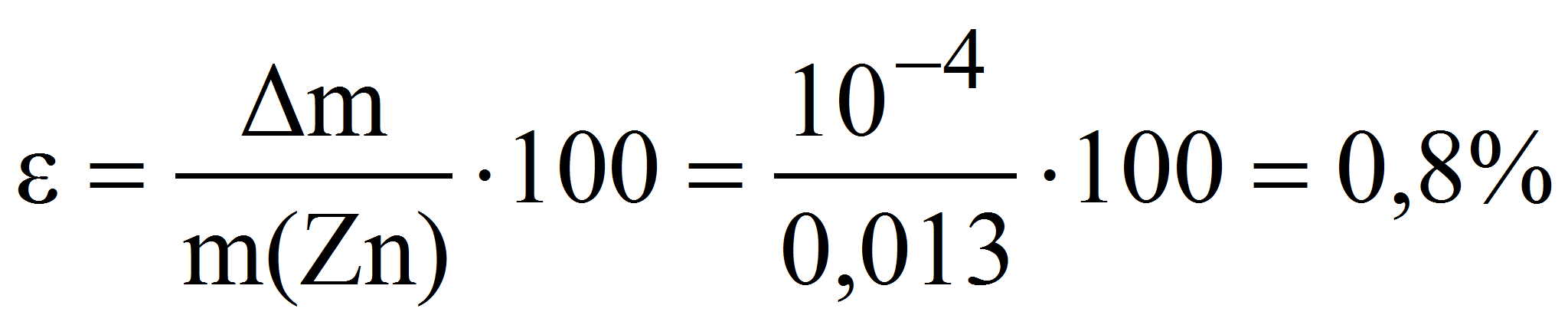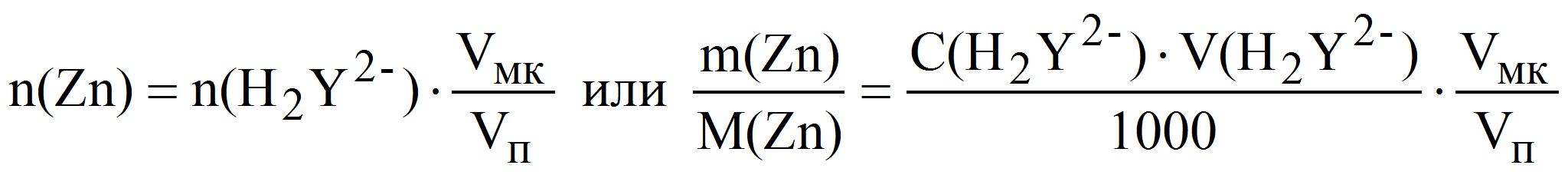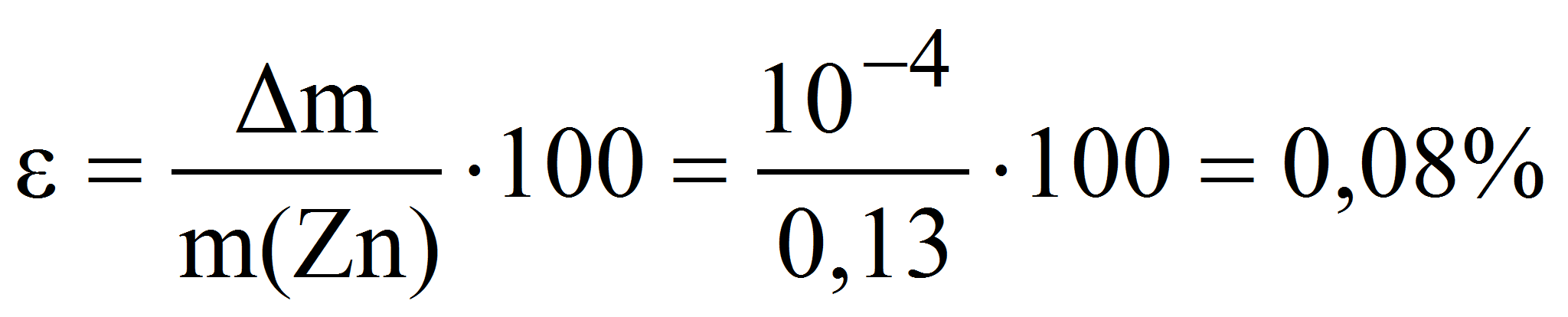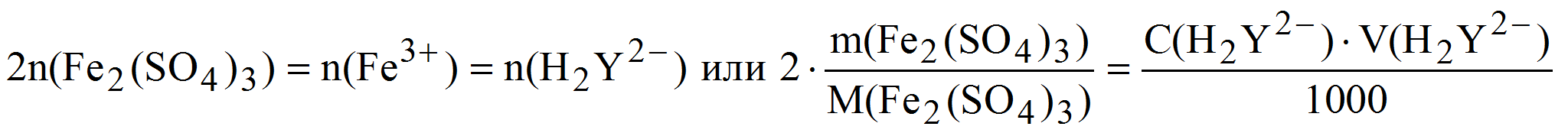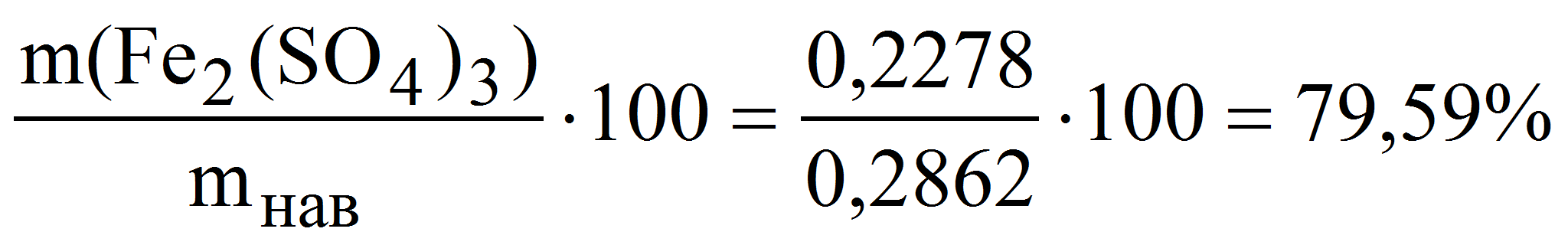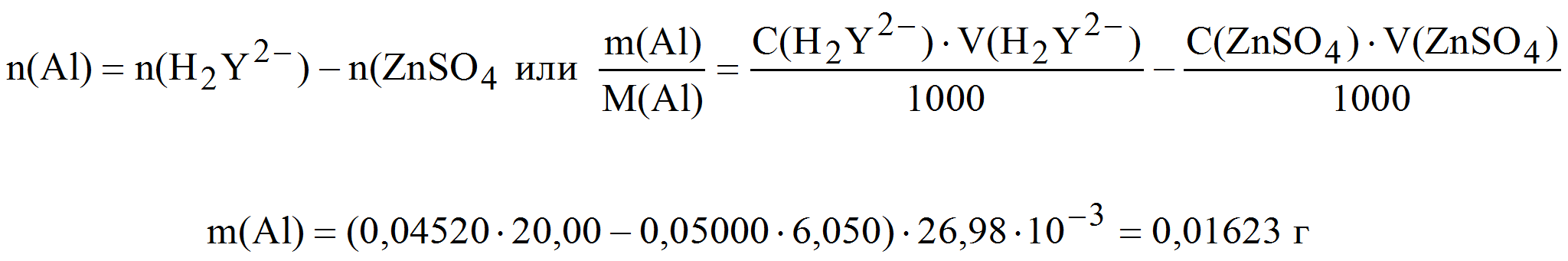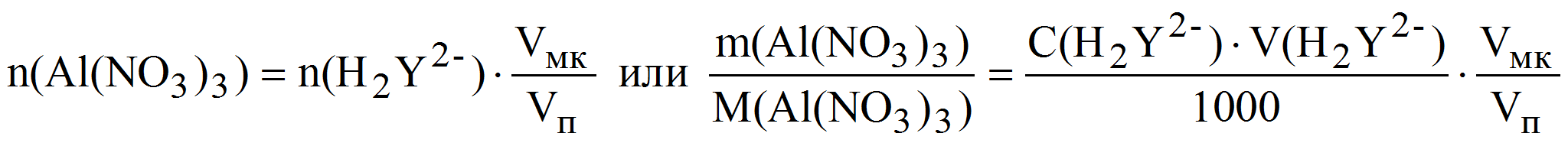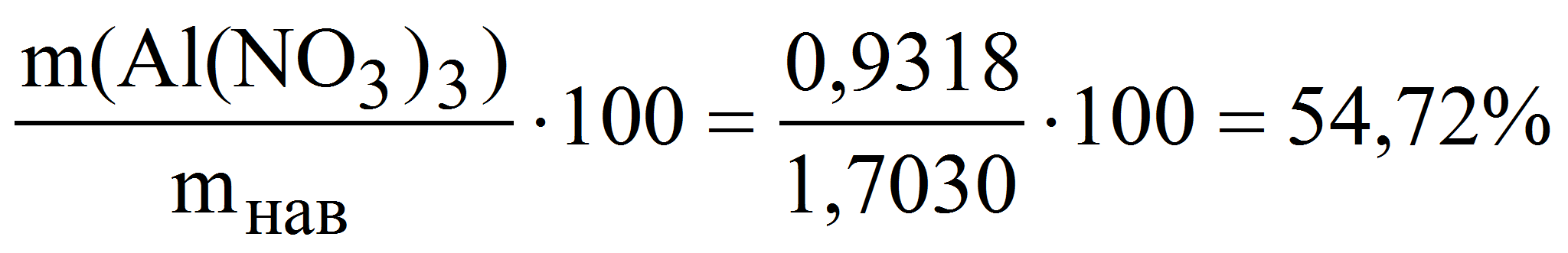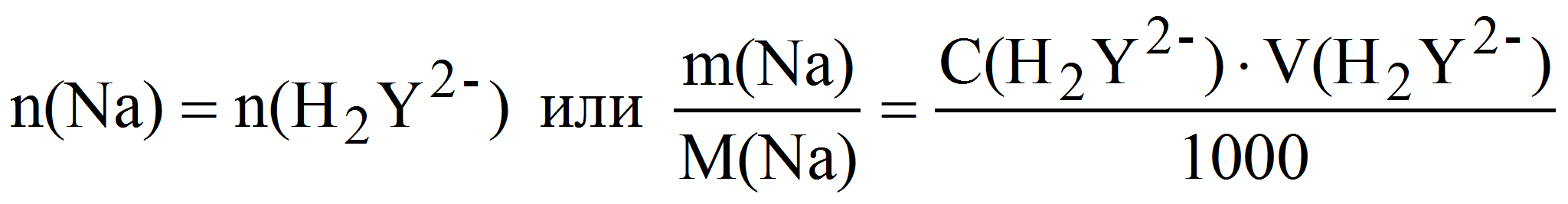Комплексонометрическое титрование
В аналитической химии широко применяется метод анализа, основанный на использовании реакций, сопровождающихся образованием внутрикомплексных (хелатных) соединений с органическими соединениями — комплексонами. Комплексонами называют аминополикарбоновые кислоты и их производные. В анализе используют ее динатриевую соль Na2H2L×2Н2О, которая в отличие от кислоты хорошо растворима в воде и находит более широкое применение:
Комплексоны являются полидентатными лигандами, которые образуют со многими катионами (Са 2+ , Ва 2+ , Sr 2+ , Mg 2+ , Со 2+ , Сu 2+ , Bi 3+ , Al 3+ , Zn 2+ , Fe 3+ , Ni 2+ и др.) очень прочные, хорошо растворимые в воде, бесцветные внутрикомплексные (хелатные) соединения.
Внутрикомплексные соли образуются всегда в тех случаях, когда катионы металла – комплексообразователя замещают активные атомы водорода функциональных групп органического соединения, а также с определенными его группами образуют координационные (донорно-акцепторные) связи. К группам, в которых атомы водорода способны замещаться на ионы металла, относятся СООН, -SО3Н, -ОН, =NOH и др.
Донорно-акцепторную связь с ионами комплексообразователя способны образовывать группы −NH2, =NH, −NOH, =S, =СО и др.
Комплексонометрия (трилонометрия) – титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота.
Во всех случаях независимо от степени окисления катионов они реагируют с комплексоном в соотношении 1: 1, поэтому фактор эквивалентности для ЭДТА и катионов металла равен 1.
Схематически реакции комплексообразования с катионами, имеющими различные степени окисления, можно представить следующими уравнениями:
H2L 2- + Ме 2+ ↔ [MeL] 2- + 2Н +
H2L 2- + Ме 3+ ↔ [MeL] — + 2Н +
H2L 2- + Ме 4+ ↔ [MeL] + 2Н +
В качестве титранта используют растворы 0,1; 0,05 или 0,02 моль/дм 3 трилона Б.
Способы фиксирования конечной точки титрования. При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы — это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
При этом комплекс катиона с индикатором и свободный индикатор имеют различную окраску:
H2Ind — + Ме 2+ ↔ [Ме Ind] —
(окраска 1) (окраска 2)
При комплексонометрическом титровании к анализируемому раствору прибавляют металлоиндикатор, который образует с определяемыми катионами комплекс, имеющий определенную окраску. В процессе титрования трилоном Б комплекс катионов металла с индикатором разрушается и образуется бесцветный, очень прочный комплекс катионов с трилоном Б, а в раствор переходят ионы свободного индикатора:
[Ме Ind] — + H2L 2 — ↔ [MeL] 2 — + H2Ind —
(окраска 2) (окраска 1)
Конечную точку титрования определяют по собственной окраске индикатора (окраска 1).
Металлоиндикаторы в водном растворе, неустойчивы. Поэтому их применяют в виде сухих смесей, тщательно растирая в фарфоровой ступке индикатор с сухими, химически чистыми NaCl или КСl в соотношении 1 : 100 . или 1 : 200. Для титрования берут сухой стеклянной ложечкой 20-30 мг этой смеси на 100 мл титруемого раствора.
Условия комплексонометрическоro титрования:
1. Реакции комплексообразования должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости образующихся комплексов должна быть малой величиной.
2. Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б.
3. Комплексонометрическое титрование следует проводить при определенном значении рН (рН + , в результате чего рН раствора понижается, что приводит к смешению реакции комплексообразования влево и делает реакцию обратимой. Для поддержания определенного значения рН титрование следует проводить в присутствии буферных растворов, имеющих определенное значение рН. Большинство катионов титруют трилоном Б в присутствии аммиачного буферного раствора NH4ОH + NH4Cl при рН = 9,2.
Очень прочные комплексы с комплексоном III образуют катионы Fe 3+ , Sn 2+ и другие, их можно определить в кислой среде. Катионы, образующие менее прочные комплексы с трилоном Б, не мешают определению, так как не титруются в кислой среде.
Способы комплексонометрического титрования.
1. Прямое титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, металлоиндикатор и титруют стандартным раствором трилона Б. Способом прямого титрования определяют катионы Cu 2+ , Со 2+ , Pb 2+ , Ni 2+ , Zn 2+ , Fе 3+ , Ва 2+ , Сг 3+ ,Ca 2+ , Mg 2+ и т. д.
2. Обратное титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, затем точно отмеренный удвоенный минимальный объем (35,00-40,00 см 3 ) стандартного раствора трилона Б, который вступает в реакцию с определяемыми ионами, а его избыток оттитровывают стандартным раствором магния сульфата или цинка сульфата в присутствии металлоиндикатора. При этом протекают реакции:
Ме 2+ + H2L 2- ↔ [Ме] 2- + 2Н +
изб. H2L 2- + Zn 2+ ↔ [ZnL] 2- + 2Н +
Способ обратного титрования применяют:
− когда реакция комплексообразования протекает медленно;
− нет подходящего индикатора для фиксирования конечной точки титрования при прямом способе титрования;
− индикатор образует с определяемым ионом очень прочный комплекс, который не разрушается комплексоном;
− для определения катионов в нерастворимых в воде осадках например Са 2+ в СаС2О4; Mg 2+ в MgNH4PО4; Рb 2+ в PbSО4.
3. Заместительное титрование. Метод основан на том, что большинство ионов образуют с трилоном Б более устойчивые комплексные соединения, чем комплекс катионов Mg 2+ с трилоном Б [MgL] 2- (β = 9,72). После прибавления к анализируемому раствору комплекса [MgL] 2- протекает реакция обмена:
[MgL] 2- + Ме 2+ → [MeL] 2- + Mg 2+
Эта реакция возможна потому, что ионы металла образуют с H2L 2- более прочное комплексное соединение [MeL] 2- (β > 9,2), и равновесие вышеприведенной реакции смещается вправо. Выделившиеся ионы Mg 2+ оттитровывают стандартным раствором трилона Б в присутствии металлохромного индикатора:
Mg 2+ + H2L 2- → [MgL] 2- + 2Н +
Трилонометрическим методом определяют:
а) общую жесткость воды;
б) практически все катионы щелочноземельных и тяжелых металлов;
в) в фармацевтическом анализе – лекарственные формы, содержащие катионы щелочноземельных металлов.
Лабораторная работа № 13
Комплексонометрическое определение общей жесткости воды
Цель работы:определение общей жесткости воды, то есть общее содержание в ней солей кальция и магния.
Ход работы
Определение содержания ионов Ca 2+ и Mg 2+ .
Получить у преподавателя контрольный раствор в мерную колбу на 100 мл. Разбавить раствор водой до метки, закройте пробкой и тщательно перемешайте. Отмерьте пипеткой 20 (25) мл полученного раствора в коническую колбу для титрования. Разбавьте дистиллированной водой до 50-70 мл, прибавьте 5 мл аммонийной буферной смеси и около 20 мг индикатора ЭХЧ – Т. Оттитруйте комплексоном III до перехода винно-красной окраски в синюю с зеленоватым оттенком. Повторите титрование 2-3 раза.
Вычислите средний объем комплексона III, пошедший на титрование, и вычислите результат, то есть количество эквивалентов Ca 2+ (Mg 2+ ) в 100 мл раствора:
n ( 


где n – количество эквивалентов Ca 2+ и Mg 2+ ,
С (трилон Б) – концентрация комплексона III, моль/л,
V (трилон Б) – объем рабочего раствора, измеренного по бюретке, мл,
Vм.к. – объем мерной колбы (100 мл),
Vп. – объем пипетки, мл.
Контрольные вопросы:
1. На чем основан метод комплексонометрии?
2. Какое соединение в комплексонометрии обозначают через ЭДТА?
3. Что такое металлоиндикаторы? На чем основано их применение?
4. Что такое общая жесткость воды? В каких единицах она измеряется?
5. В чем сущность комплексонометрического метода определения общей жесткости воды?
6. Чему равна общая жесткость воды, если на титрование 100,00 мл ее израсходовано 25,50 мл 0, 1022 н. раствора трилона Б?
Источник
7. Способы комплексонометрического титрования
Известны следующие четыре способа проведения комплексонометрического титрования – прямое титрование, обратное титрование (по остатку), титрование по способу вытеснения (замещения), косвенное титрование.
Прямое титрование – наиболее распространенный прием, когда к анализируемому раствору, содержащему ион определяемого металла, прибавляют рабочий раствор комплексона (титрант) до тех пор, пока не будет дотигнута точка эквивалентности, которую устанавливают с помощью индикатора. Прямое титрование удобно применять если есть возможность подобрать соответствующий индикатор и взаимодействие иона металла с комплексоном протекает достаточно быстро.
По результатам титрования рассчитывают содержание определяемого элемента. Расчеты в комплексонометрии можно проводить по закону эквивалентов, как это делается в других методах титрования. При этом следует учитывать, что при взаимодействии иона металла в любой степени окисления с комплексоном (ЭДТА) выделяется два иона водорода:
M n+ + H2Y 2- MY n-4 + 2H +
Поэтому факторы эквивалентности ЭДТА и иона металла, независимо от его заряда, всегда равны ½. Уравнение материального баланса в этом случае в соответствии с законом эквивалентов выглядит следующим образом:
Поскольку по уравнению реакции на 1 моль металла всегда приходится 1 моль комплексона, то расчеты можно производить также исходя из равенства числа моль или миллимоль, учитывая при необходимости стехиометрические коэффициенты.
Пример 6. Какую навеску металлического цинка следует растворить в серной кислоте при определении точной концентрации 0,010 М раствора трилона Б с помощью макробюретки объёмом 25 мл: а) методом отдельных навесок; б) методом аликвотных частей (пипетирования), используя для этого мерную колбу и пипетку номинальным объёмом 100 и 10 мл соответственно? Рассчитать относительную погрешность взвешивания навески цинка на аналитических весах в обоих случаях.
Zn 2+ + H2Y 2- ZnY 2- + 2H +
Для расчета используем объём раствора комплексона равный 80% от объёма бюретки V(H2Y 2- ) = 0,8·25 = 20 мл.
а) метод отдельных навесок:
тогда m(Zn) = 0,010·20·65,37·10 -3 = 0,013 г и
б) метод аликвотных частей:
тогда m(Zn) = 0,010·20·65,37·10 -3 ·10 = 0,13 г и
Пример 7. Рассчитать массовую долю (%) сульфата железа() в образце, если после растворения его навески массой 0,2862 г в кислой среде на титрование израсходовали 22,38 мл 0,05 М (К = 1,018) раствора трилона Б.
Fe 3+ + H2Y 2- FeY — + 2H +
В одной молекуле Fe2(SO4)3 содержится два атома железа, тогда:
( Fe2(SO4)3) =
Задачу можно решить и по закону эквивалентов, тогда: n(1/4Fe2(SO)4) = n(1/2H2Y 2- ).
Обратное титрование (по остатку) – менее удобно, чем прямое, однако к нему приходится прибегать, когда для прямого титрования нельзя подобрать соответствующий индикатор, или когда катионы металла очень медленно взаимодействуют с титрантом, или когда при благоприятных значениях рН определяемый ион металла осаждается в виде гидроксидов. Во всех этих случаях к титруемому раствору прибавляют точно известный избыток комплексона, раствор выдерживают некоторое время для завершения реакции или ускоряют процесс нагреванием. Затем избыток комплексона титруют рабочим раствором соли другого металла (M’), для которого реакция с комплексоном соответствует всем требованиям, предъявляемым к реакциям комплексонометрического титрования. При обратном титровании комплексонат определяемого металла на определение точки эквивалентности практически не влияет, так как он образуется медленно и также медленно разрушается.
При обратном титровании уравнение материального баланса имеет вид:
или через эквиваленты:
n(1/2H2Y 2- ) = n(1/2M n+ ) + n(1/2M’ n+ )
Пример 8. Рассчитать массу алюминия в анализируемом растворе, если к этому раствору при рН=5 добавили 20,00 мл 0,04520 М раствора трилона Б, затем после окончания реакции добавили аммиак до рН=9 (образовалась аммонийная буферная смесь) и остаток комплексона, не вступивший в реакцию с алюминием, оттитровали с металлохромным индикатором эриохромом черным Т, затратив 6,050 мл 0,05000 М раствора сульфата цинка.
H2Y 2- ост + Zn 2+ ZnY 2- + 2H +
Составляем уравнение материального баланса n(H2Y 2- ) = n(Al) + n(ZnSO4), тогда:
Титрование по способу вытеснения (замещения) – применяют в тех же случаях, что и обратное титрование. При вытеснительном (заместительном) титровании к анализируемому раствору, содержащему ион определяемого металла, прибавляют избыток комплексоната другого металла, условная константа устойчивости которого в данной среде меньше таковой для определяемого металла. Обычно применяют комплексонат магния, константа устойчивости которого lgK(MgY 2- ) = 8,7 (табл.1) значительно меньше, чем для большинства металлов. При этом протекает реакция замещения, после чего вытесненные ионы магния титруют при рН=9 раствором ЭДТА с металлохромным индикатором эриохромом черным Т:
M n+ + MgY 2- MY n-4 + Mg 2+
Mg 2+ + H2Y 2- MgY 2- + 2H +
Чем больше разница в константах устойчивости MY n-4 и MgY 2- , тем полнее идет реакция замещения. Если вытеснение магния происходит медленно, необходимо анализируемый раствор выдержать некоторое время до окончания реакции или ускорить её нагреванием.
Таким способом нельзя определить ионы бария, так как K(BaY 2- ) 2- ) (табл.1). Однако, если к раствору, содержащему ионы бария, добавить достаточное количество аммиака и комплексонат цинка, то произойдет реакция:
После чего аммиакат цинка при рН=9 титруют комплексоном в присутствии металлохромного индикатора эриохрома черного Т. Такое течение реакции замещения становится возможным, так как в данных условиях K’(BaY 2- ) > K”(ZnY 2- ).
Уравнение материального баланса, связывающее количество определяемого вещества и титранта, в заместительном титровании аналогично прямому титрованию.
Пример 9. Навеску кристаллогидрата Al(NO3)3·xH2O массой 1,7030 г растворили в мерной колбе объёмом 200,0 мл и к аликвоте полученного раствора 20,00 мл прибавили избыток комплексоната Na2MgY. На титрование выделившихся ионов магния израсходовали 17,45 мл 0,02507 М раствора трилона Б. Рассчитать массовую долю (%) Al(NO3)3 в исходном препарате.
Al 3+ + MgY 2- AlY — + Mg 2+
Mg 2+ + H2Y 2- MgY 2- + 2H +
Из уравнения материального баланса имеем:
m(Al(NO3)3) = 0,02507·17,45·213,0·10 -3 ·10 = 0,9318 г
( Al(NO3)3) =
Косвенное титрование – применяется для определения ионов, не взаимодействующих с комплексоном непосредственно, например, катионов щелочных металлов и некоторых анионов, образующих малорастворимые соединения.
Таким образом определяют ионы натрия, осаждая их в виде натрийцинкуранилацетата – NaZn(UO2)3(CH3COO)9, который затем растворяют в кислоте и комплексонометрически определяют образовавшиеся ионы цинка. При этом n(Na + ) = n(Zn 2+ ) = n(H2Y 2- ).
Аналогично определяют и анионы. Например, фосфатный ион можно осадить в виде MgNH4PO4, а затем растворить его в кислоте и после ионообменного отделения фосфата определить магний с помощью трилона Б. При этом n(PO4 3— ) = n(H2Y 2- ).
Косвенное определение можно проводить и обратным титрованием. Например, при определении сульфатов к анализируемому раствору прибавляют точно известный избыток нитрата свинца и остаток последнего определяют комплексонометрически. Уравнение материального баланса при этом следующее: n(SO4 2- ) = n(Pb 2+ ) – n(H2Y 2- ).
Пример 10. Какая масса натрия содержалась в анализируемом растворе, если после осаждения его в виде натрийцинкуранилацетата полученный осадок отделили, растворили и на титрование образовавшихся ионов цинка затратили 20,85 мл 0,01 М (K = 0,9194) раствора трилона Б?
Zn 2+ + H2Y 2- ZnY 2- + 2H +
Уравнение материального баланса имеет вид:
откуда m(Na) = 0,01·0,9194·20,85·22,99·10 -3 = 0,4407 г
Работа 1. Определение точной концентрации рабочего раствора трилона Б.
Сущность работы: Определение основано на взаимодействии раствора трилона Б со стандартным раствором сульфата цинка в присутствии аммонийной буферной смеси (рН
9) по уравнению реакции:
Zn 2+ + H2Y 2- ZnY 2- + 2H +
Для определения конечной точки титрования применяется металлохромный индикатор эриохром черный Т.
Посуда и реактивы:
конические колбы для титрования на 100 мл – 2 шт.;
макробюретка на 25 мл – 1 шт.;
аммонийная буферная смесь (рН
сухая индикаторная смесь (тщательно растертые в ступке 0,5 г эриохрома черного Т и 50 г хлорида натрия);
раствор сульфата цинка с точно известной концентрацией.
Для работы следует получить в лаборантской водный раствор трилона Б с приближенной молярной концентрацией эквивалента 0,01-0,02 моль/л.
В конические колбы для титрования с помощью бюретки отбирают различные объемы (17-22 мл) стандартного раствора сульфата цинка. Затем аккуратно по каплям прибавляют 2 М раствор аммиака до появления белого осадка (гидроксид цинка) и его последующего растворения. К полученному раствору добавляют 10 мл аммонийной буферной смеси и сухую индикаторную смесь (на кончике шпателя) до получения фиолетовой окраски — очень интенсивная окраска не рекомендуется, так как при этом затрудняется наблюдение перехода окраски в конечной точке титрования. Далее титруют раствором трилона Б до перехода окраски в синюю (без примеси фиолетового), при этом последние капли титранта следует добавлять медленно, хорошо перемешивая раствор. Для облегчения определения конечной точки титрования можно приготовить раствор-свидетель, добавив к 50 мл дистиллированной воды 10 мл аммонийной буферной смеси, индикаторную смесь и немного раствора трилона Б до синей окраски. По показаниям бюретки определяют объём раствора трилона Б, пошедший на титрование, и полученные результаты заносят в таблицу:
Источник