6.4. Коагуляция лиофобных дисперсных систем
В процессе работы с коллоидными системами часто возникает обратная задача – разрушение коллоидных систем. Для этого выявляют факторы, обеспечивающих устойчивость системы и устраняют их. Например,
ионный фактор – избыток электролита
структурно-механический – добавление коротко-цепочечных ПАВ.
Часто можно вызвать коагуляцию изменением температуры.
Внешние признаки коагуляции:
повышение вязкости и т.д.
Коагуляция – самопроизвольный процесс (Gs ↓) .
Различают 2 стадии коагуляции:
скрытая коагуляция (частицы укрупняются, но не теряют седиментационную устойчивость)
явная коагуляция – система теряет устойчивость, и образуется осадок.
Причины коагуляции многообразны: изменение Т, воздействие электрических и магнитных полей, световое механическое воздействия, добавление электролитов и т.д.
Мы рассмотрим причины и некоторые особенности электролитной коагуляции.
6.4.1. Основные закономерности электролитной коагуляции
Различают 3 наиболее характерных вида потенциальных кривых для дисперсных систем с различной устойчивостью
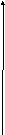


Рис. 6.4. Потенциальные кривые для дисперсных систем с различной степенью агрегативной устойчивости
Кривая 1 →на любом h Еприт > Еотт; не меняет это отношение и тепловое движение. Для системы характерна быстрая коагуляция с образованием агрегатов (в системе с жидкой и газообразной средой – коалесценция).
Кривая 2 – высокий потенциальный барьер и наличие вторичного минимума. Такое состояние отвечает обратимости коагуляции.
Кривая 3 — высокий потенциальный барьер при отсутствии вторичного минимума. Вероятность образования агрегатов мала. Система обладает большой агрегативной устойчивостью.
Правила электролитной коагуляции
1. Коагуляцию вызывает любой электролит, если его концентрация превышает некоторую критическую – порог коагуляции.
Порог коагуляции – это минимальное количество электролита, вызывающее коагуляцию 1 л золя.
Величина, обратная порогу коагуляции, называется коагулирующей способностью: число объёмов золя, коагулирующих под действием 1 моль (1 ммоль) иона-коагулятора.
Величина порога коагуляции зависит от ряда условий:
1. момент фиксирования
2. метод наблюдения
3. концентрации золя и др.
Наиболее распространенные методы определения порога коагуляции – измерение светорассеивания или титрование золя раствором электролита до начала явной коагуляции.
Коагуляцию вызывают ионы, обратные по знаку с зарядом ядра мицеллы.
При введении постороннего электролита в дисперсную систему уменьшается толщина диффузного слоя (ионы из диффузионного слоя переходят в адсорбционный) , уменьшается энергия отталкивания частиц, а следовательно, и U. Кривые 1, 2, 3 на рис.6.5 показывают изменение формы суммарной кривой U и величиныU при повышении концентрации постороннего электролита в системе. При достаточно высокой концентрации электролита толщина диффузного слоя уменьшается практически до нуля (изоэлектрическое состояние), исчезает потенциальный барьер (кривая 3), частицы слипаются при всяком столкновении друг с другом (происходит т.н. быстрая коагуляция ).
Таким образом, малые концентрации электролитов стабилизируют дисперсные системы термодинамически и кинетически, образуя на поверхности частиц двойной электрический слой. Образование ДЭС уменьшает избыточную поверхностную энергию и создает потенциальный барьер отталкивания частиц. Повышенные концентрации электролитов снижают потенциальный барьер отталкивания (в пределе до нуля), вызывая тем самым агрегацию частиц при их столкновении.
С увеличением концентрации противоионов адсорбционный слой ДЭС доукомплектовывается, толщина диффузного слоя δ уменьшается, и ζ↓ до 0. В изоэлектрическом состоянии в системе происходит коагуляция.
↑

φ

Рис.6.5. Влияние концентрации электролита на величину потенциального барьера отталкивания и распределение потенциала в ДЭС
Коагулирующая способность ионов зависит от радиуса иона R
Чем больше радиус иона R, тем меньше он в гидратированном состоянии, тем больше адсорбционная способность иона (при меньших концентрациях укомплектовывают адсорбционный слой и вызывают коагуляцию).
Коагулирующая способность ионов одинакового заряда увеличивается при увеличении радиуса иона в лиотропном ряду:
Li + + + + + Mg +2 +2 +2 +2
Анионы также можно разложить в ряд, но разница в их коагулирующей способности не так значительна.
В гомологических рядах электролитов с органическими ионами коагулирующая способность равномерно возрастает с введением групп –СН2— в соответствии с правилом Траубе.
Коагулирующая способность ионов зависит от их заряда (правило Шульце-Гарди (**) ).
Сравнение значений порогов коагуляции, определенных расчетным путем по теории ДЛФО и полученных экспериментально показывает неплохое сходство в их значениях.
γ 1 20 500 (эксперимент)
При электролитной коагуляции золя различают:
концентрационную коагуляцию – под действием индифферентного электролита: Со↑ → δ↓ → ζ↓ вследствие сжатия диффузного слоя и уменьшения ζ-потенциала до 0;
нейтрализационную коагуляцию: при добавлении неиндифферентного электролита потенциалопределяющие ионы связываются в малорастворимое соединение, при этом Со↑ → φо↓ → ζ↓.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Коагуляция и стабилизация лиофобных дисперсных систем
Все дисперсные системы в зависимости от механизма процессов их образования согласно классификации П. А. Ребиндера подразделяются на лиофильные и лиофобные. Лиофильные дисперсные системы являются термодинамически устойчивыми и образуются самопроизвольно. Лиофобные дисперсные системы представляют собой термодинамически неустойчивые системы, образующиеся несамопроизвольно в результате диспергирования или конденсации с пересыщением. Лиофобные дисперсные системы обладают избытком поверхностной энергии. Поэтому в них самопроизвольно протекают процессы укрупнения частиц, т.е. происходит снижение поверхностной энергии за счет уменьшения суммарной площади частиц дисперсной фазы.
Ребиндером и Щукиным был предложен критерий, позволяющий разделять все дисперсные системы на лиофильные и лиофобные:

где 


Левая и правая части уравнения (10.2) представляют собой энергию; причем произведение межфазного натяжения и квадрата размера частицы характеризует поверхностную энергию системы; тогда как произведение константы Больцмана и температуры — тепловую. Если тепловая энергия превалирует над поверхностной, т.е. 


Лиофобные дисперсные системы являются агрегативно неустойчивыми, т. е. в таких системах происходит самопроизвольное укрупнение частиц дисперсной фазы. Такое укрупнение частиц в дальнейшем будем называть коагуляцией. Различают термодинамические и кинетические факторы агрегативной устойчивости лиофобных систем. Поскольку движущей силой коагуляции является избыточная поверхностная энергия, то основными факторами, обеспечивающими устойчивость систем (при сохранении суммарной площади поверхности частиц дисперсной фазы), будут те, которые снижают межфазное (поверхностное) натяжение. Такие факторы относятся к термодинамическим. Чем меньше межфазное (поверхностное) натяжение, тем ближе система к термодинамически устойчивой. Кинетические факторы устойчивости, снижающие скорость коагуляции, связаны в основном с гидродинамическими свойствами среды.
Лиофобные системы являются агрегативно устойчивыми благодаря проявлению электростатического фактора стабилизации и коагулируют при введении в систему сравнительно небольшого количества любого электролита. Наименьшая концетрация, электролита, при которой начинается быстрая коагуляция, называется порогом коагуляции. В соответствии с рассмотренной теорией ДЛФО различают два механизма коагуляции — концентрационный и нейтрализационный.
Концентрационный механизм коагуляции обусловлен сжатием двойного электрического слоя в результате увеличения ионной силы раствора. Это приводит к уменьшению электростатического отталкивания, что в свою очередь снижает потенциальный барьер и облегчает взаимодействие частиц. Такой механизм коагуляции характерен для систем с высокозаряженными частицами (£ > 30 мВ). Для данного механизма характерным является то, что порог коагуляции обратно пропорционален заряду z противоиона, вызывающего коагуляцию, в шестой степени: СС =k 
Нейтрализационный механизм коагуляции более характерен для систем с частицами, обладающими малым электрическим потенциалом. Механизм заключается в снижении потенциала (р6 в результате специфической адсорбции ионов введенного неиндифферентного электролита на поверхности частиц.
Специфически адсорбирующиеся ионы, находясь в адсорбционном слое ДЭС, резко снижают cps — происходит нейтрализация потенциала ф0 уже в адсорбционном слое. Снижение ср5 также приводит к уменьшению энергии электростатического отталкивания, что облегчает протекание коагуляции.
Действие специфической адсорбции можно представить как образование на поверхности частиц менее растворимого или менее диссоциированного соединения. В результате чего уменьшается взаимодействие частиц с дисперсионной средой и, как следствие, — увеличивается межфазное натяжение, что приводит к потере агрегативной устойчивости дисперсной системы.
Стабилизацию лиофобных дисперсных систем проводят с целью повышения агрегативной устойчивости, т.е. для предотвращения коагуляции. В качестве стабилизаторов широко применяют поверхностно–активные вещества (ПАВ) и высокомолекулярные соединения (ВМС). Молекулы ПАВ и ВМС, адсорбируясь на поверхности частиц дисперсной фазы, способствуют уменьшению межфазного натяжения и образованию сольватного или двойного электрического слоя. При стабилизации поверхность частиц приобретает свойства вещества — стабилизатора.
Стабилизация существенно зависит как от силы закрепления молекул стабилизатора на поверхности частиц дисперсной фазы, так и от степени заполнения последней. Молекулы ВМС прочно закрепляются на поверхности частиц и при высоком заполнении поверхности служат надежными стабилизаторами. Избыток стабилизатора также может привести к агрегации, так как в избытке стабилизатора может формироваться второй слой молекул стабилизатора, ориентированного противоположным образом к первому слою, в таком случае агрегативная устойчивость системы понижается.

Особенно сильным стабилизирующим действием обладают ПАВ и ВМС, которые образуют на поверхности частиц двухмерную пленку, обладающую повышенными структурно–механическими свойствами. К таким веществам относятся длинноцепочечные ПАВ (соли и эфиры высших карболовых кислот) и ионные ВМС — полиэлектролиты (желатин, казеин, замещенные эфиры целлюлозы и др.).
Источник