- Способы отображения строения молекул. Формулы. Модели
- Способы изображения органических молекул.
- Теория строения органических соединений
- Углерод в органических веществах
- Основные положения теории строения органических соединений
- Формулы строения органических веществ
- Типы углеродных атомов в составе органических молекул
- Типы связей в молекулах органических веществ
- Гибридизация атомных орбиталей углерода
- sp 3 -Гибридизация
- sp 2 -Гибридизация
- sp-Гибридизация
- Изомерия
- Виды изомерии
- Структурная изомерия
- Пространственная изомерия
- 1. Геометрическая изомерия (или цис-транс-изомерия)
- 2. Оптическая изомерия
- Классификация органических соединений
- Углеводороды
- Кислородсодержащие органические вещества
- Азотсодержащие органические вещества
- Другие органические вещества
- Гомологи. Гомологический ряд
- Добавить комментарий Отменить ответ
Способы отображения строения молекул. Формулы. Модели



Теория строения органических соединений М.И. Бутлерова
Основные положения теории химического строения
В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
- атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен;
- порядок соединения атомов в молекуле называется химическим строением;
- свойства веществ определяются не только их составом, но и химическим строением;
- атомы в молекулах оказывают взаимное влияние друг на друга;
- исходя из строения молекулы можно предсказать свойства вещества, и, наоборот, на основании химических свойств можно предсказать строение вещества.
Углеводородные цепи могут быть как открытыми (алициклическими), так и замкнутыми (циклическими), как прямыми, так и разветвленными.
Определение
Гомологи — органические соединения, принадлежащие к одному классу веществ, обладающие сходным строением и свойствами, но отличающиеся друг от друга по составу на одну или несколько групп СНСН2 и отвечающие одной общей формуле.
Способы отображения строения молекул. Формулы. Модели
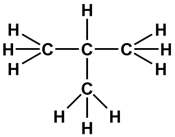
Структуру вещества, то есть порядок соединения атомов в молекуле, отображает структурная формула, в которой связи между атомами (или группами атомов) изображаются в виде черточек: одна черточка означает одну связь или одну общую электронную пару. Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки).
По количеству соседних углеродных атомов, атомы углерода в молекуле подразделяются на первичные(один «сосед»), вторичные (два «соседа»), третичные (три «соседа») и четвертичные (четыре «соседа»). Так, концевые атомы в молекуле углеводородов всегда первичные, в линейных молекулах промежуточные атомы — вторичные, а в разветвленных могут появляться третичные и (или) четвертичные атомы углерода.
Для отображения органических молекул используют молекулярные или брутто-формулы, которые представляют собой сокращенную форму записи количественного и качественного состава.
Например, запись СНС2Н6 означает, что молекула вещества состоит из 2 атомов углерода и 6 атомов водорода. Для каждого класса органических соединений можно вывести общую формулу,отвечающую количественному составу всех гомологов. Эту формулу называют общей формулой гомологического ряда.Вещества, принадлежащие к одному классу, отвечают одной общей формуле.
Сравним структурные формулы простейших углеводородов: метана, этана и пропана.
Молекулярная формула метана СН4, этана С2Н6, пропана С3Н8. Видно, что формула этана отличается от формулы метана на одну группу СН2. Аналогично, состав молекул пропана и этана также отличается на одну группу СН2. Следовательно, все эти вещества являются гомологами и относятся к гомологическому ряду метана. Прибавив к формуле пропана указанную гомологическую разницу СН2, получим формулу следующего представителя этого гомологического ряда — С4Н10 (бутан):
Для состава С4Н10 можно изобразить еще одну структурную формулу:
Следовательно, веществ состава С4Н10 должно быть два, каждому из этих веществ соответствует своя структурная формула. Если первое вещество называется бутаном или н-бутаном, то второе — изобутаном. Бутан и изобутан — изомеры, так как у них одинаковый количественный состав, но разный порядок соединения атомов. Подробно с явлением изомерии и изомерами можно познакомиться в теме «Виды изомерии».
Для пространственного отображения структуры молекул органических веществ используют стереохимические формулы.
Стереохимическая формула показывает пространственное расположение атомов в молекулах органических веществ.
Например, пространственное строение этана можно отобразить стереохимической формулой или с помощью проекций Ньюмена, отображающих конформации этана, то есть расположение (поворот) метильных радикалов относительно одинарной С–С-связи:
Более подробно проекции Ньюмена будут рассмотрены в теме «Виды изомерии».

Для наглядности отображения пространственного строения органических молекул используют также разные модели. Наиболее распространенными являются шаростержневые модели, в которых атомы имеют форму шаров, а связи представлены в виде палочек. Одинарная связь — одна палочка, двойная связь — две палочки. Более достоверно истинную структуру молекул отображаютмасштабные (полусферические) модели:
Источник
Способы изображения органических молекул.
Органическая химия.
2.1.Тема: «Теория строения органических соединений»
2.1.1. Основные положения теории строения органических соединений и классификация органических соединений.
1. Природные и синтетические органические вещества. Немного из истории органической химии. Общие свойства органических веществ (состав, тип химической связи, кристаллическое строение, растворимость, отношение к нагреванию в присутствии кислорода и без него).
2. Теория строения органических соединений А.М.Бутлерова. Развитие теории и ее значение.
3. Классификация органических веществ.
Свое название органические вещества получили потому, что первые из изученных веществ этой группы входили в состав живых организмов. Большинство известных сейчас органических веществ не встречаются в живых организмах, они получены (синтезированы) в лаборатории. Поэтому различают природные (натуральные) органические вещества (хотя большинство из них может быть сейчас получено в лаборатории), а органические вещества, не существующие в природе – синтетические органические веществами. Т.е. название «органические вещества» историческое и особого смысла не имеет. Все органические соединения являются соединениями углерода. К органическим веществам относятся соединения углерода, кроме изучаемых в курсе неорганической химии простых веществ, образованных Карбоном, его оксидов, угольной кислоты и ее солей. Другими словами: органическая химия – это химия соединений углерода.
Краткая история развития орг.химии:
Берцелиус, 1827, первый учебник органической химии. Виталисты. Учение о «жизненной силе».
Первые органические синтезы. Велер, 1824, синтез щавелевой кислоты и мочевины. Кольбе,1845, уксусная кислота. Бертло,1845, жир. Бутлеров,1861, сахаристое вещество.
Но как наука органическая химия началась с создания теории строения органических соединений. Существенный вклад в нее внесли немецкий ученый Ф.А.Кекуле и шотландец А.С.Купер. Но решающий вклад несомненно принадлежит русскому химику А.М.Бутлерову.
Среди всех элементов углерод выделяется своей способностью образовывать устойчивые соединения, в которых его атомы связаны друг с другом в длинные цепи различной конфигурации (линейные, разветвленные, замкнутые). Причина этой способности: примерно одинаковая энергия связи С-С и С-О (для других элементов энергия второй – намного больше). Кроме того, атом углерода может находиться в одном из трех видов гибридизации, образуя соответственно одинарные, двойные или тройные связи, причем не только между собой, но и с атомами кислорода или азота. Правда, гораздо чаще (практически всегда) атомы углерода соединены с атомами водорода. Если в состав органического соединения входит только углерод и водород, то соединения называются углеводородами. Все остальные соединения можно рассматривать как производные углеводородов, в которых некоторые атомы водорода замещены на другие атомы или группы атомов. Поэтому более точное определение: Органические соединения – это углеводороды и их производные.
Органических соединений очень много — более 10 млн. (неорганических около 500 тыс.). Состав, строение и свойства всех органических веществ имеют много общего.
Органические вещества имеют ограниченный качественный состав. Обязательно С и Н, часто О или N, реже галогены, фосфор, сера. Другие элементы входят в состав очень редко. А вот число атомов в молекуле может достигать млн, и молекулярная масса может быть очень большая.
Строение органических соединений. Т.к. состав – неметаллы. => Химическая связь: ковалентная. Неполярная и полярная. Ионная очень редко. => Кристаллическая решетка чаще всего молекулярная.
Общие физические свойства: невысокая температура кипения и плавления. Среди органических веществ есть газы, жидкости и легкоплавкие твердые вещества. Часто летучи, могут иметь запах. Обычно бесцветные. Большинство органических веществ нерастворимо в воде.
Общие химические свойства:
1) при нагревании без доступа воздуха все органические вещества «обугливаются», т.е. при этом образуется уголь (точнее сажа) и некоторые другие неорганические вещества. Происходит разрыв ковалентных связей, сначала полярных, потом и неполярных.
2) При нагревании в присутствии кислорода все органические вещества легко окисляются, и при этом конечными продуктами окисления являются углекислый газ и вода.
Особенности протекания органических реакций. В органических реакциях участвуют молекулы, в процессе реакции должны разорваться одни ковалентные связи и образуются другие. Поэтому химические реакции с участием органических соединений идут обычно очень медленно, для их проведения необходимо применять повышенную температуру, давление и катализаторы.В неорганических реакциях обычно участвуют ионы, реакции протекают очень быстро, иногда мгновенно, при нормальной температуре. Органические реакции редко приводят к высокому выходу продукции (обычно менее 50%). Они часто являются обратимыми, кроме того, может протекать не одна, а несколько реакций, конкурирующих между собой, а значит продуктами реакции будет смесь различных соединений. Поэтому и форма записи органических реакций тоже несколько другая. Т.е. используют не химические уравнения, а схемы химических реакций, в которых нет коэффициентов, но зато подробно указаны условия реакции. Принято также под уравнением записывать названия орг. веществ и тип реакции.
Но в целом органические вещества и реакции подчиняются общим законам химии, а органические вещества превращаются в неорганические или могут образовываться из неорганических. Что еще раз подчеркивает единство окружающего нас мира.
Основные принципы теории химического строения, изложенные молодым А.М.Бутлеровым на международном съезде естествоиспытателей в 1861 г.
1). Атомы в молекулах соединены между собой в определенном порядке, в соответствии с их валентностью. Последовательность соединения атомов называют химическим строением.
Валентность — это способность атомов образовывать определенное количество связей (ковалентных). Валентность зависит от числа неспаренных электронов в атоме элемента, потому что ковалентные связи образуются за счет общих электронных пар при спаривании электронов. Углерод во всех органических веществах четырехвалентен. Водород — 1, Кислород -П, азот – Ш, сера – П, хлор – 1.
Способы изображения органических молекул.
Молекулярная формула – условное изображение состава вещества. Н2СО3 — угольная кислота, С12Н22О11 – сахароза. Такие формулы удобны для расчетов. Но они не дают информацию о строении и свойствах вещества. Поэтому даже молекулярные формулы в органике пишут особым образом: СН3ОН. Но гораздо чаще пользуются структурными формулами. Структурная формула отражает порядок соединения атомов в молекуле (т.е. химическое строение).И в основе любой органической молекулы лежит углеродный скелет – это цепочка связанных между собой ковалентными связями атомы углерода.
Электронные формулы молекул – связи между атомами показаны парами электронов.



Структурные формулы отражают только порядок соединения атомов. Но молекулы органических соединений редко имеют плоское строение. Объемный образ молекулы важен для понимания многих химических реакций. Образ молекулы описывают с помощью таких понятий как длина связи и валентный угол. Кроме того, возможно свободное вращение вокруг одинарных связей. Наглядное представление дают молекулярные модели.
Источник
Теория строения органических соединений
| Органическая химия – это химия углерода и его соединений с другими элементами. |
В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов.
Количество известных органических соединений в настоящее время превышает 20 миллионов.
Углерод в органических веществах
Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода).
В органических веществах углерод имеет валентность IV (образует 4 связи).
- Атом углерода может образовывать одинарные, двойные и тройные связи.
В основе современной органической химии лежит теория строения органических соединений.
Основные положения теории строения органических соединений
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
- Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы.
Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии.
| Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение. |
| Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом | |||
| Например, простейшая формула метана CH4, а вот бензола – СН. |
Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле.
| Например, истинная формула бензола C6H6. |
Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле.
| Например, полная структурная формула бутана: |
Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом.
| Например, сокращенная структурная формула бутана: |
Типы углеродных атомов в составе органических молекул
Типы углеродных атомов в составе органических молекул
Атомы углерода
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь С–С, С–Н, С–О | Двойная связь С=С, С=О | Тройная связь С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 


В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp 3 , sp 2 и sp-гибридизация.
sp 3 -Гибридизация
В sp 3 -гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp 3 -гибридные орбитали:
Изображение с портала orgchem.ru
| Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому четыре гибридные орбитали углерода в состоянии sp 3 -гибридизации направлены в пространстве под углом 109 о 28’ друг к другу, что соответствует тетраэдрическому строению.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
sp 2 -Гибридизация
В sp 2 -гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
| Три sp 2 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому три sp 2 -гибридные орбитали атома углерода направлены в пространстве под углом 120 о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
| Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp 2 -гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей. |
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию) .
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы . Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
Классификация органических веществ по составу
Углеводороды
| Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода. |
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| Этан CH3-CH3 | Циклобутан | Этилен CH2=CH2 | Дивинил CH2=CН-СН=СH2 | Ацетилен СН≡СН | Бензол |
| Ациклические углеводороды | ||
| С неразветвленной цепью | С разветвленной углеродной цепью | |
| н-Бутан CH3-CH2-CH2-CH3 | Изобутан | |
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
Основные функциональные группы, содержащие кислород:
|
Кислородсодержащие органические вещества




CH3-OH
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2 -N | -C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
| Метиламин CH3-NH2 | Нитрил уксусной кислоты CH3-C≡N | Нитрометан CH3-NO2 | Амид уксусной кислоты CH3-C(NH2)=O | Аминоуксусная кислота CH2(NH2)-COOH | Пиррол |
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.).
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
| Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд. |
| Гомологи – это вещества, которые входят в один и тот же гомологический ряд. |
Группу –СH2– называют гомологической разностью.
| Например, 2-метилбутан и 2-метилпентан являются гомологами: | |
 |  |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник