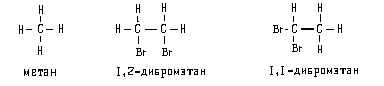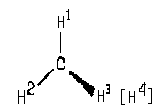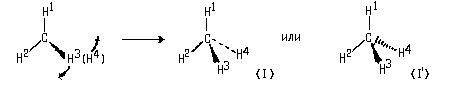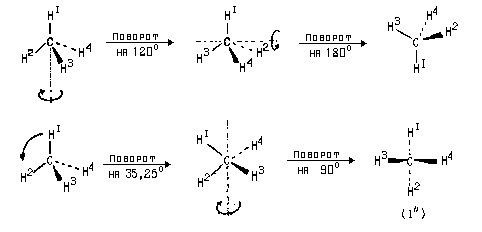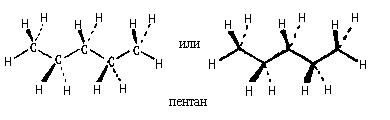Способы изображения молекул органических соединений
Современная органическая химия немыслима без предсавлений о пространственном строении молекул и его влиянии на ход химических реакций, что составляет предмет стереохимии. В стереохимии используются определенные способы изображения молекул, а также стереохимическая коменклатура. Цель настоящего пособия — познакомить читателя с основными понятиями, которыми оперирует стереохимия. Элементарные сведения по стереохимии изложены в разделах I-IX. В разделе X помещен дополнительный материал, знание которого также поможет успешному изучению курса органической химии.
I. Элементы симметрии.
Для описания пространственного строения молекул важно знание элементов симметрии. Термин «симметрия» интуитивно понятен. Обычно это слово ассоциируется с огрненным камнем, архитектурным сооружением и т.п. Симметричный объект содержит один или ннесколько элементов симметрии, для которых можно дать строгое математическое определение. Ниже приведены простейшие сведения об элементах симметрии.
Центр симметрии (центр инверсии),i
Центром симметрии объекта называется точка i , удовлетворяющая следующим условиям. Для любой точки А, принадлежащей объекту, всегда найдется точка А’, также принадлежащая данному объекту такая, что:
а)точки А, i , А’ лежат на одной прямой;
б)точки А и А’ равноудалены от точки i .
Примеры централъно-симметричных объектов:
 |  | 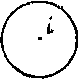 |
| квадрат | правильный шестиугольник | круг |
Плоскость симметрии
Плоскостью симметрии называется плоскость 
а)прямая, проведенная через точки А и А’, перпендикулярна плоскости 
б)точки А и А’ равноудалены от плоскости 
равнобедренный треугольник прямоугольник
(плоскости симметрии 
Простая ось симметрии n-го порядка Cn
Осью симметрии n-ного порядка называется ось, проходящая через данной объект, при повороте вокруг которой на угол 360°/n объект совмещается сам с собой.
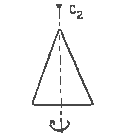 |  |
| равнобедренный треугольник: ось симметрии С2 | правильный шестиугольник : показаны две оси С2, лежащие в плоскости чертежа; ось С6 перпендикулярна плоскости чертежа |
Ось Симметрии С1 (поворот на 360°) называется тривиальным элементом симметрии. Существует также ось симметрии бесконечного порядка С . Поворот вокруг этой оси на любой угол приводит к coвмещению объекта с самим собой (ось, проходящая через центр круга и перпендикулярная его плоскости; любая ось, проходящая через центр шара).
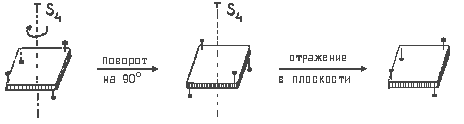
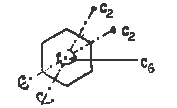
Зеркально-поворотная ось симметрии n — ого порядка Sn.
Это сложный элемент симметрии, включающий две операции: поворот вокруг оси на угол 360°/n и отражение в плоскости, перпендикулярной данной оси. При выполнении операций, соотвктствующих оси Sn, объект совмещается сам с собой.
Примером объекта, в котором имеется зеркально-поворотная ось, может служить деревянный квадрат, по углам которого вбиты четыре гвоздя: два сверху и два снизу. Ось S4 перпендикулярна плоскости квадрата и проходит через его центр. Одного поворота вокруг оси S4 на 90° недостаточно, чтобы данный объект совпал сам с собой. Для этого необходико последующее отражение в плоскости, перпендикулярной оси S4 и рассекающей квадрат пополам (нижняя часть квадрата при отражении переходит вверх, верхняя — вниз);
Помимо оси S4 в данном объекте присутствует также простая поворотная ось C2 (поворот на 180°), совпадающая с осью S4.
Следует земетить, что плоскость симметрии эквивалентна заркально-поворотной оси первого порядка (поворот на 360° и отражение в плоскости ); 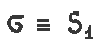
Аналогично, центр симметрии эквивалентен оси симметрии S2(поворот на 180 0 и отражение в плоскости, перпендикулярной оси):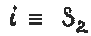
‘Гаким образом, элементы симметрии 
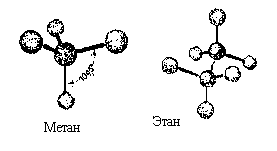
Обычный способ изображения молекул в органической химии — это структурные формулы.Они передают порядок связи,атомов:
В случае молекул, имеющих плоское или линейное строение, с помощью таких формул можно адекватно описать также геометрию молекул, например:
Если же в состав молекулы входят: sp 3 -гибридизованные атомы углерода, имеющие тетраэдрическое окружение, структурная формула не может передать реальную геометрию молекул, то есть расположение атомов в пространстве. Этой цели лучше всего отвечают пространственные модели.
Полусферические модели Стюарта — Бриглеба:
Шаро — стержневые модели:
Однако, часто возникает необходимость изобразить пространственное строение молекулы на плоскости. Понятно, что пользоваться рисунками моделей неудобно, да и не всем это под силу. В таких случаях прибегают к помощи различных проекционных формул, которые представляют собой, по существу, проекции шаро-стержневых моделей в том или ином ракурсе.
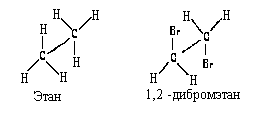
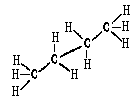
Дня этана и его производных можно использовать перспективные формулы. Это рисункишаро-стержневых моделей, в которых шары, символизирующие атомы, заменены на символы химических элементов. В перспективных формулах связь С-С как бы удаляется от наблюдателя:
Однако, этот способ не подходит для более сложных молекул, например, бутана. В таких сяучаях наглядность теряется:
Перспективные формулы используют чаше всего для изображения циклических молекул (см. ниже, раздел X). Обычно для изображения пространственного строения молекул на плоскости используют клиновидную проекцию, проекционные формулы Ньюмена и Фишера. Наиболее наглядной является клиновидная проекция.
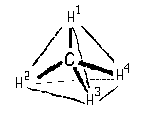
С принципом построения этой проекции познакомимся на примере молекулы метана.
Мысленно расположим молекулу так, чтобы связи СН 1 и СН 2 оказались в плоскости чертежа (две пересекающиеся прямые задают плоскость). Тогда атом Н 3 будет возвышаться над плоскостью чертежа, закрывая собой атом Н 4 , расположеный под плоскостью. Изобразим связь С-Н 3 с помощью клина, широким концом направленного в сторону атома Н 3 .
По существу, мы получим проекцию молекулы СН4 на плоскость чертежа, которая в данном случае является плоскостью симметрии молекулы. Для того, чтобы одновременно были видны атомы Н 3 и Н 4 , слегка исказим проекцию. Оставив неизменными связи углерода с Н 1 и Н 2 , немного сместим атом Н 3 вниз, а атом Н 4 — вверх. Связь СН 4 , расположенную под плоскостью чертежа, изобразим пунктиром (I) или штриховым клином, сужающимся в сторону удаленного атона ( I ‘):
Рисунки (I) и ( I ‘) являются клиновидными проекциями молекулы метана. При пользовании этими проекциями необходимо помнить, что связи, изображенные отрезком прямой, находятся в плоскости чертежа. Сплошные клинья символизируют связи, направленные к наблюдателю, а штриховые линии — связи, «уходящие» за плоскость чертежа.
Клиновидную проекцию можно поворачивать на любой угол относительно любой оси, например:
Проекция (I») соответствует такому расположению молекулы метана, при котором ни один из атомов водорода не лежит в плоскости чертежа.
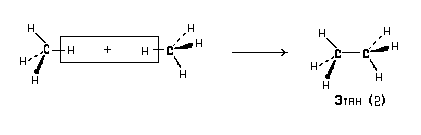
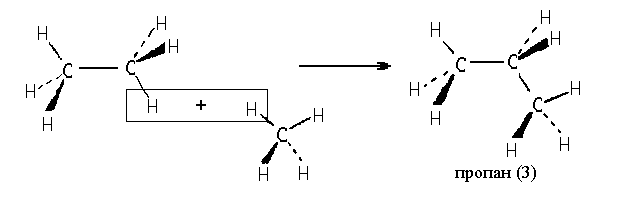
Клиновидную проекцию метана можно использовать для построения проекций других углеводородов, например:
Обратите внимание на то, что в проекциях (2) и (3) связи С-С находятся в плоскости чертежа. В этой же плоскости расположены только две связи С-Н. Иногда клиновидную проекцию этана изображают для такого расположения молекулы относительно плоскости чертежа, при котором ни одна из связей С-Н не находится в этой плоскости (2′):
Клиновидные проекции неразветвленных углеводородов обычно изображают в виде зигзагообразной цепи, все связи С-С и две концевые связи С-Н которой расположены в плоскости чертежа. При этом окружение каждой связи С-С должно быть таким же, как я в проекции молекулы этана (2). Сами же атомы углерода можно не изображать. Они подразумеваются в углах зигзага:
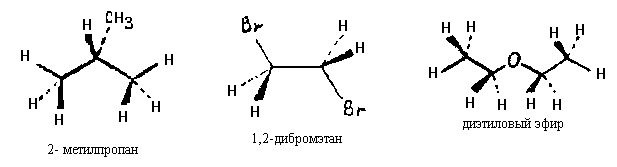
Разумеется, клиновидную проекцию можно использовать для изображения не только неразветвленнах углеводородов, но г других органических соединений, например:
В настоящее время широкое распространение получил сокращенный вариант проекций молекул в виде зигзагов, в углах и на концах которых подразумеваются атомы углерода. Связи С-Н при этом не изображают:
Связи заместителей с атомами углерода цепи помещают на продолжении биссектрисы соответствующего угла зигзага:


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Источник
Способы изображения молекул органических соединений
3. ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛ
Термин изомерия (от греч. isos – одинаковый, mers – часть) впервые был введен в 1830 г., когда стали известны вещества, имеющие одинаковый качественный и количественный состав, но обладающие различными физическими и химическими свойствами.
Изомерия – это явление, заключающееся в существовании соединений, имеющих одинаковую молекулярную формулу, но различающихся порядком связывания атомов в молекуле или расположением атомов в пространстве, и вследствие этого различающихся по физическим и химическим свойствам.
Такие соединения называются изомерами. Различают два основных вида изомерии – структурную (изомерия строения) и пространственную (стереоизомерия).
Структурные изомеры – это соединения, имеющие одинаковую молекулярную формулу, но отличающиеся друг от друга порядком связывания атомов в молекуле.
Структурная изомерия подразделяется на изомерию углеродной цепи, изомерию положения и изомерию функциональных групп.
Изомерия углеродной цепи. Обусловлена различной последовательностью связывания атомов, образующих углеродный скелет молекулы. Например, для алкана состава С4Н|0 можно написать два изомера:
Для органических соединений циклического строения изомерия цепи может быть вызвана величиной цикла.
Изомерия положения обусловлена разным положением функциональных групп, заместителей или кратных связей в молекуле.
Изомерия функциональных групп обусловлена присутствием в изомерах одинакового состава различных по природе функциональных групп.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ (СТЕРЕОИЗОМЕРИЯ)
Пространственные изомеры – это соединения, имеющие одинаковую молекулярную формулу, одинаковый порядок связывания атомов в молекуле, но отличающиеся друг от друга расположением атомов в пространстве.
Пространственные изомеры называют также стереоизомерами (от греч. stereos – пространственный).
Пространственная изомерия подразделяется на конфигурационную и конформационную.
Но прежде, чем перейти к рассмотрению этих видов стереоизомерии, остановимся на способах изображения пространственного строения молекул органических соединений.
Для изображения пространственного строения молекул, их конфигурации или конформаиии используют молекулярные модели и специальные стереоформулы.
Молекулярные модели – наглядное изображение молекул органических и неорганических соединений, позволяющее судить о взаимном расположении атомов, входящих в состав молекулы.
Наиболее часто используют три основных типа моделей: шаростержневые (модели Кекуле – Вант-Гоффа), скелетные (модели Драйдинга) и полусферические (модели Стюарта – Бриглеба). Модели позволяют судить не только о взаимном расположении атомов в молекуле, но они удобны и для рассмотрения валентных углов и возможности вращения вокруг простых связей. Модели Драйдинга учитывают и межатомные расстояния, а модели Стюарта – Бриглеба отражают и объемы атомов. Ниже на рисунке приведены модели молекул этана и этилена.
Стереоформулы. Для изображения пространственного строения молекулы на плоскости чаще всего используют стереохимические и перспективные формулы, а также проекционные формулы Ньюмена.
В стереохимических формулах химические связи, расположенные в плоскости чертежа, изображают обычной чертой; связи, находяшиеся над плоскостью – жирным клином или жирной чертой, а расположенные под плоскостью – штриховым клином или пунктирной линией:
Перспективные формулы описывают пространственное строение на плоскости с учетом рассмотрения молекулы вдоль одной из углерод-углеродных связей. По внешнему виду они напоминают лесопильные козлы:
При построении проекционных формул Ньюмена молекулу рассматривают в направлении одной С–С-связи таким образом, чтобы атомы, образующие данную связь, заслоняли друг друга. Из выбранной пары ближний к наблюдателю атом углерода изображают точкой, а дальний – окружностью. Химические связи ближнего атома углерода с другими атомами представляют линиями, берущими начало отточки в центре круга, а дальнего – от окружности:
Существуют проекционные формулы Фишера, которые применяют обычно для изображения на плоскости пространственного строения оптических изомеров.
Рассмотрим получение проекционной формулы Фишера для бутанола-2 (СН3–СН(ОН)–СН2–СН3). Для этого модель молекулы располагают таким образом, чтобы атом углерода, связанный с гидроксильной группой находился в плоскости чертежа, а заместители, расположенные горизонтально, были над плоскостью, расположенные вертикально – за плоскостью чертежа. При проецировании такой модели на плоскость получают проекционную формулу Фишера, в которой связи, находящиеся над плоскостью, изображают горизонтальной линией, а связи, находящиеся за плоскостью, – вертикальной линией. В точке пересечения этих линий находится атом углерода, который обычно не обозначается символом:
К конфигурационной относится оптическая и геометрическая изомерия.
В1815 г. Ж. Био открыл существование оптической активности для органических соединений. Было установлено, что некоторые органические соединения имеют способность вращать плоскость поляризации поляризованного света. Вещества, которые обладают такой способностью, называются оптически активными.
Если луч обычного света, в котором, как известно, электромагнитные колебания распространяются в разных плоскостях, перпендикулярных к направлению его распространения, пропустить через призму Николя, то выходящий свет будет плоскополяризованным . В таком луче электромагнитные колебания совершаются только в одной плоскости Эту плоскость называют плоскостью поляризации (рис. 3.2).
При прохождении поляризованного луча света через оптически активное вещество плоскость поляризации поворачивается на определенный угол а вправо или влево. Если вещество отклоняет плоскость поляризации вправо (при наблюдении навстречу лучу), его называют правовращающим , если влево – левовращающим . Правое вращение обозначают знаком (+), левое – знаком (–).
Оптическую активность измеряют с помощью приборов, называемых поляриметрами.
Явление оптической активности распространено среди органических веществ, особенно среди природных (гидрокси- и аминокислот, белков, углеводов, алкалоидов).
Оптическая активность большинства органических соединений обусловлена их строением.
Одной из причин возникновения оптической активности органических молекул является наличие в их структуре sp3-гибридизирован-ного атома углерода, связанного с четырьмя разными заместителями. Такой атом углерода называется хиральным или асимметрическим . Часто для него применяют более общее название – хиральный центр. В структурных формулах асимметрический атом углерода принято обозначать звездочкой – С*:
Соединения, содержащие один асимметрический атом углерода, существуют в виде двух изомеров, относящихся друг к другу как предмет к своему зеркальному отображению. Такие изомеры называются энантиомерами .
Для изображения пространственного строения оптических изомеров на плоскости могут быть использованы стереохимические формулы. Например, энантиомеры бутанола-2, изображенные с помощью стереохимических формул, имеют следующий вид:
Однако стереохимические формулы не всегда удобны для описания пространственного строения молекул. Поэтому чаше всего оптические изомеры изображают на плоскости с помощью проекционных формул Фишера . Например, так выглядят энантиомеры 2-бромбутана. изображаемые с помощью проекции Фишера.
Энантиомеры очень похожи друг на друга, но тем не менее не тождественны. Они имеют одинаковый состав и последовательность связывания атомов в молекуле, но отличаются друг от друга относительным расположением их в пространстве, т. е. конфигурацией. В том, что эти молекулы разные, легко убедиться при попытке наложения их моделей друг на друга.
Свойство молекул не совмещаться со своим зеркальным изображением называется хиральностью (от греч. cheir– рука), а также молекулы называют хиральными . Наглядным примером могут служить левая и правая руки, которые являются зеркальным отражением друг друга, но вместе с тем их нельзя совместить. Молекулы, которые совместимы со своим зеркальным изображением называют ахиральными .
Хиральность молекул является обязательным условием для проявления веществом оптической активности.
Как установить является ли молекула хиральной? Хиральность молекулы можно легко обнаружить путем построения модели молекулы и модели ее зеркального изображения с последующим их совмещением. Если модели не совмещаются – молекула хиральна, если совмещаются – ахиральна. Такой же вывод можно сделать и на основе стереохимических формул молекул по наличию или отсутствию элементов симметрии, так как причиной оптической активности органических соединений является их асимметрическое строение. Поскольку молекула представляет собой трехмерное образование, ее строение можно рассматривать с точки зрения симметрии геометрических фигур. Основным элементами симметрии являются плоскость, центр и ось симметрии. Если в молекуле отсутствует плоскость симметрии, то такая молекула хиральна.
Энантиомеры обладают одинаковыми физическими и химическими свойствами (температура кипения, температура плавления, растворимость, электропроводность и другие константы будут одни и те же), вращают плоскость поляризации поляризованного луча на один и тот же по величине угол, но имеются и различия.
Энантиомеры отличаются знаком вращения, один вращает плоскость поляризации поляризованного луча влево, другой – вправо; они с различной скоростью реагируют с другими хиральными соединениями, а также имеется различие в физиологическом действии. Например, лекарственный препарат левомицин – антибиотик широкого спектра действия. Если его эффективность принять за 100, то правовращающая форма составит только 2 % от эффективности левовращающей формы.
Значение величины угла поворота плоскости поляризации поляризованного света зависит от природы активного вещества, толщины слоя оптически активной среды, через которую проходит поляризованный свет, и длины его волны. Для растворов угол а зависит также от природы растворителя и концентрации оптически активного вещества. В меньшей степени оптическое вращение зависит от температуры.
Для сравнительной оценки оптической активности различных соединений используют значение удельного вращения [ α ]. Удельное вращение является константой оптически активного вещества. Оно характеризует оптическую активность раствора с концентрацией оптически активного вещества 1г/мл при толщине слоя 1 дм.
Удельное вращение вычисляют по одной из приведенных формул:
где α – измеренный угол вращения, град.; l – толшина слоя, дм; с – концентрация оптически активного вещества, г/100 мл раствора; ρ – плотность жидкого вещества.
Если молекула имеет один асимметрический атом, то она существует в виде двух изомеров, если же молекула имеет несколько асимметрических атомов углерода, то число возможных изомеров увеличивается. Число оптических изомеров определяют по формуле:
N = 2n, где N – число изомеров; п – число асимметрических атомов углерода.
Так при наличии в молекуле двух асимметрических атомов углерода число изомеров равно 22 = 4, трех – 23 = 8, четырех – 24 = 16 и т. д.
Например, бромяблочная кислота, содержащая два асимметрических атома углерода, существует в виде четырех стереоизомеров (I–IV).
Стереомеры I и II, а также III и IVотносятся друг к другу как предмет и его зеркальное изображение и являются энантиомерами.
Стереоизомеры I и III, I и IV а также II и III, II и IV не являются зеркальными отображениями друг друга, они отличаются конфигурацией при одном из асимметрических атомов углерода. Такие стереоизомеры называют диастереомерами . В отличие от энантиомеров диастереомеры имеют различные физические и химические свойства.
Для соединений, содержащих два хиральных атома углерода, связанных с одинаковыми заместителями, общее число стереоизомеров уменьшается до трех. Например, винная кислота должна существовать в виде четырех стереоизомеров (22 = 4), а известно лишь три. Это обусловлено появлением у одного из стереоизомеров такого элемента, как плоскость симметрии.
Стереомеры I и II являются энантиомерами. Стереоизомер III ( мезо-форма ) является оптически неактивным. Молекула мезовинной кислоты ахиральна. Каждый энантиомер винной кислоты по отношению к мезо-форме является диастереомером.
Номенклатура оптических изомеров
В номенклатуре наряду с названием соединения указывают также конфигурацию и направление вращения плоскости поляризованного света. Последнее обозначают знаком (+) для правовращающего изомера или знаком (–) для левовращающего изомера.
Для обозначения конфигурации оптических изомеров существуют D,L- и R,S-стереохимические системы.
D,L-система обозначения конфигурации. Установить абсолютную конфигурацию молекул оказалось для химиков довольно сложной задачей. Впервые это удалось лишь в 1951 г. методом рентгеноструктурного анализа. До этого времени конфигурацию оптических изомеров устанавливали методом сравнения со специально выбранным стандартным веществом. Такая конфигурация получила название относительной. В 1906 г. русским ученым М.А. Розановым в качестве стандарта для установления относительной конфигурации был предложен глицериновый альдегид.
Для правовращающего изомера выбрали формулу Фишера, в которой гидроксильная группа у хирального атома углерода находится справа, а для левоврашаюшего – слева. Конфигурация правовращающего изомера обозначается буквой D, а левоврашаюшего – L.
С использованием в качестве эталона сравнения глицеринового альдегида была разработана D. i-система стереохимической классификации хиральных соединений, т. е. отнесения соединений соответственно к D- или I-стереохимическому ряду.
D,L-система главным образом применяется в ряду многоатомных спиртов, гидрокси-, аминокислот и углеводов:
Для соединений с несколькими асимметрическими атомами углерода, таких как α -гидроксикислоты, α -аминокислоты, винные кислоты. конфигурацию условно определяют по верхнему асимметрическому атому углерода (по гидроксикислотному ключу), в то время как в молекуле углеводов конфигурацию устанавливают (условно) по нижнему асимметрическому атому углерода.
R,S-система обозначения конфигурации. D,L-система оказалась практически неприемлемой для соединений мало похожих на глицериновый альдегид. Поэтому Р. Каном, К. Ингольдом и В. Прелогом была предложена R,S-система обозначения абсолютной конфигурации оптических изомеров. R,S-система построена на определении старшинства заместителей у хирального центра.
Старшинство заместителей определяется величинами атомных номеров элементов. Чем больше атомный номер, тем старше заместитель. Например, в молекуле бромйодхлорметана старшинство заместителей уменьшается в ряду:
После установления старшинства заместителей модель молекулы ориентируют так, чтобы заместитель с наименьшим порядковым номером был направлен в сторону, противоположную глазу наблюдателя. Если старшинство трех остальных заместителей убывает по направлению часовой стрелки, то молекула имеет конфигурацию, обозначаемую буквой R (от лат. rectus – правый), а если старшинство заместителей убывает против часовой стрелки, конфигурацию обозначают буквой S (от лат. Sinister – левый). Например, для молекулы бромйодхлорметана:
Рассмотрим определение старшинства заместителей и конфигурации для более сложных молекул на примере молочной кислоты (рис. 3.4). Уже по первому слою (80, 6С, 1Н, 6С) становится понятно, что старшим заместителем является группа ОН, а младшим – водород. Для выяснения старшинства двух других заместителей СН3 и СООН с одинаковым атомным номером (6С) по первому слою, необходимо рассмотреть второй слой. Сумма атомных номеров второго слоя СН3-группы = 1 + 1 + 1 = 3, а группы СООН = 8 + 8·2 = 24. Значит -СООН-группа старше группы –СН3. Старшинство заместителей вокруг асимметрического атома углерода в молекуле молочной кислоты уменьшается в ряду: ОН > СООН > СН3 > Н
Рацематы. Смесь равных количеств энантиомеров оптически неактивна, ее называют рацемической смесью (рацематом). Рацематы отличаются от индивидуальных энантиомеров физическими свойствами, они могут иметь различную температуру плавления, растворимость; отличаются спектральными характеристиками.
На практике чаще приходится сталкиваться не с индивидуальными энантиомерами, а рацематами, которые образуются в результате химических реакций, протекающих с образованием хиральных молекул.
Для разделения рацематов на энантиомеры пользуются тремя методами:
- Механический метод. В результате кристаллизации некоторых оптически активных соединений могут образовываться две формы кристаллов, похожих друг на друга как предмет и его зеркальное отображение. Их можно отделить под микроскопом препаративной иглой (механически).
- Биохимический метод основан на том, что определенные виды микроорганизмов предпочитают одну из энантиомерных форм и поедают ее, вторая остается и может быть легко выделена.
- Химический метод. В основе химического метода лежит перевод энантиомеров при помощи оптически активных реагентов в диастереомеры, которые уже отличаются друг от друга по физическим свойствам. Диастереомеры гораздо легче разделить.
Например, следует разделить рацемическую смесь двух кислот (А + В). Для этого к смеси добавляют оптически активное основание (С). Между рацемической формой и оптически активным основанием протекает реакция
(А + В) + С -> АС + ВС.
АС и ВС – это диастереомеры. Они обладают различной растворимостью и методом последовательной кристализации можно выделить два диастереомера отдельно.
Но так как АС и ВС образованы слабой органической кислотой и основанием, то используют для их разложения минеральные кислоты.
АС + НС1 → А + С·НС1
ВС + НС1 → В + С·НС1
Таким образом получают чистые энантиомеры А и В.
Причиной возникновения геометрической изомерии является отсутствие свободного вращения вокруг ст-связи. Этот вид изомерии характерен для соединений, содержащих двойную связь, и для соединений алициклического ряда.
Геометрические изомеры это вещества, имеющие одинаковую молекулярную формулу, одинаковую последовательность связывания атомов в молекулах, но отличающиеся друг от друга различным расположением атомов или атомных групп в пространстве относительно плоскости двойной связи или плоскости цикла.
Причиной возникновения данного вида изомерии является невозможность свободного вращения вокруг двойной связи или с-связей, образующих цикл.
Например, бутен-2 СН3–СН=СН–СН3 может существовать в виде 2-х изомеров, которые различаются расположениями метильных групп в пространстве относительно плоскости двойной связи.
или 1,2-диметилциклопропан существует в виде двух изомеров, которые различаются расположением метильных групп в пространстве относительно плоскости цикла:
Для обозначения конфигурации геометрических изомеров используют цис-, транс-систему. Если одинаковые заместители расположены по одну сторону от плоскости двойной связи или цикла – конфигурацию обозначают цис-. если по разные стороны – транс-.
Для соединений, у которых при атомах углерода с двойной связью находятся различные заместители, применяют E,Z-систему обозначений.
E,Z-система является более обшей. Она применима к геометрическим изомерам с любым набором заместителей. В основе этой системы лежит старшинство заместителей, которое определяют у каждого атомауглерола отдельно. Если старшие заместители из каждой пары расположены по одну сторону от двойной связи, конфигурация обозначается буквой Z (от нем. zusammen – вместе), если по разные стороны – буквой E(от нем. entgegen – напротив).
Так для 1-бром-1-хлорпропена возможно два изомера:
Старшим заместителем у одного атома углерода является метальная группа (заместители 1Н и 6СН,). а у другого – атом брома (заместители 17С1 и 36Вг). В изомере I старшие заместители расположены по одну сторону от плоскости двойной связи, ему приписывают Z-koh-фигурацию, а изомеру II E-конфигурацию (старшие заместители расположены по разные стороны плоскости двойной связи).
Геометрические изомеры имеют разные физические свойства (температуру плавления и кипения, растворимость и т. д.), спектральные характеристики и химические свойства. Такое различие в свойствах позволяет довольно легко установить их конфигурацию с помошью физических и химических методов.
Конформационная (поворотная) изомерия обусловлена вращением атомов или атомных групп вокруг одной или нескольких простых ст-связей. В результате вращения вокруг С–С-связей молекулы могут иметь различные пространственные формы, которые называют конформациями.
Например, молекула этана вследствие вращения вокруг углерод-углеродной связи может принимать бесконечное множество конформаций. каждая из которых характеризуется определенным значением потенциальной энергии. Две крайние конформации называют заслоненной и заторможенной.
Для представления конформации на плоскости используют формулы Ньюмена и перспективные формулы.
В заслоненной конформации этана атомы водорода метильных групп, если смотреть вдоль связи углерод-углерод, расположены друг за другом. В заторможенной – атомы водорода одной метильной группы максимально удалены от атомов водорода другой. Между заслоненной и заторможенной конформацией молекула в процессе вращения принимает множество скошенных конформации.
Каждая из конформации молекулы этана характеризуется различной потенциальной энергией. Заслоненная конформация имеет максимальную энергию, а заторможенная – минимальную.
Энергетическая равноценность различных конформации объясняется существованием в молекуле так называемого торсионного напряжения (напряжения Питцера), которое обусловлено взаимодействием (отталкиванием) электронных облаков противостоящих связей. В заслоненной конформации противостоящие связи максимально сближены, поэтому взаимодействие между ними наибольшее. Разность энергий заслоненной и заторможенной конформации называется энергетическим барьером вращения. Для этана энергетический барьер невелик, он составляет около 12 кДж/моль и легко преодолевается молекулой при обычных температурах за счет энергии теплового движения.
При вращении вокруг С2–С3 связи в н -бутане возможны четыре крайние конформации, из которых две заторможенные и две заслоненные:
Заторможенная конформаиия, в которой метальные группы (объемные заместители) максимально удалены друг отдруга, получила название анти-конформации . Другая заторможенная конформация называется гош-конформаиией.
Заторможенная гош-конформация обладает несколько большей потенциальной энергией (за счет метил-метильного взаимодействия), чем онтм-конформация (в ней взаимодействие между метилами вообще отсутствует).
Хотя в молекуле н -бутана существует свободное вращение вокруг центральной С–С связи, однако в каждый момент времени большая часть молекул представлена наиболее энергетически выгодной конформацией.
Конформации с наименьшим запасом энергии называют конформерами или конформационными (поворотными) изомерами.
Так, н -бутан при 25 °С существует примерно на 70 % в форме анти- конформера и на 30 % гош-конформера.
В отличие от конфигурационных изомеров, конформеры превращаются друг в друга без разрыва химических связей и не поддаются разделению. Они обнаруживаются только физико-химическими методами.
Источник