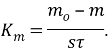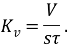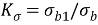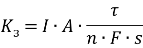- Скорость коррозии металлов. Методы оценки коррозионных процессов
- Критерии
- Расчетные формулы
- Основные факторы, влияющие на скорость коррозии
- Физико-химические свойства
- Влияние кислотности среды
- Состав и концентрация нейтральных растворов
- Замедлители коррозии
- Механическое воздействие
- Конструктивные факторы
- Методы оценки
- Лабораторные методы измерения и приборы контроля коррозии
- Библиографическое описание:
Скорость коррозии металлов. Методы оценки коррозионных процессов
Скорость коррозии – многофакторный параметр, который зависит как от внешних условий среды, так и от внутренних свойств материала. В нормативно-технической документации существуют определенные ограничения по допустимым значениям разрушения металла при эксплуатации оборудования и строительных конструкций для обеспечения их безаварийной работы. В проектировании не существует универсального метода определения скорости коррозии. Это связано со сложностью учета всех факторов. Наиболее надежным методом является изучение истории эксплуатации объекта.
Критерии

В настоящее время в проектировании техники используют несколько показателей скорости коррозии:
- По прямому способу оценки: уменьшение массы металлической детали на единицу поверхности – весовой показатель (измеряется в граммах на 1 м2 за 1 час); глубина повреждений (или проницаемость коррозионного процесса), мм/год; количество выделяющейся газовой фазы продуктов коррозии; продолжительность времени, в течение которого появляется первое коррозионное повреждение; число центров коррозии на единицу площади поверхности, появившихся за определенный срок.
- По косвенной оценке: сила тока электрохимической коррозии; электрическое сопротивление; изменение физико-механических характеристик.

Первый показатель по прямому методу оценки является наиболее распространенным.
Расчетные формулы
В общем случае весовые потери, определяющие скорость коррозии металла, находят по следующей формуле:
где q – уменьшение массы металла, г;
S – площадь поверхности, с которой произошел перенос материала, м2;
t – период времени, ч.
Для листового проката и изготовленных из него обечаек определяют глубинный показатель (мм/год):
m – глубина проникновения коррозии в металл.
Между первым и вторым показателями, описанными выше, существует следующая зависимость:
где ρ – плотность материала.
Основные факторы, влияющие на скорость коррозии

На скорость разрушения металла влияют следующие группы факторов:
- внутренние, связанные с физико-химической природой материала (фазовая структура, химический состав, шероховатость поверхности детали, остаточные и рабочие напряжения в материале и другие);
- внешние (окружающие условия, скорость движения коррозионно-активной среды, температура, состав атмосферы, наличие ингибиторов или стимуляторов и другие);
- механические (развитие коррозионных трещин, разрушение металла под действием циклических нагрузок, кавитационная и фреттинг-коррозия);
- конструктивные особенности (выбор марки металла, наличие зазоров между деталями, требования к шероховатости).
Физико-химические свойства
Наибольшее значение среди внутренних факторов коррозии имеют следующие:
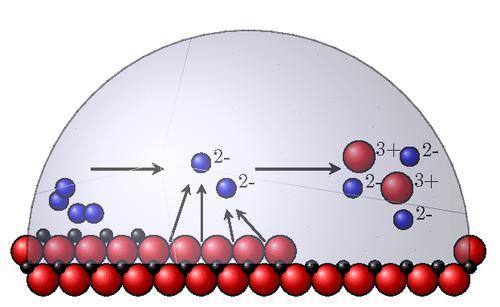
- Термодинамическая устойчивость. Для ее определения в водных растворах применяют справочные диаграммы Пурбе, по оси абсцисс которых откладывается pH среды, а по оси ординат – окислительно-восстановительный потенциал. Сдвиг потенциала в положительную сторону означает большую устойчивость материала. Ориентировочно она определяется как нормальный равновесный потенциал металла. В реальности материалы корродируют с различной скоростью.
- Положение атома в периодической таблице химических элементов. Металлы, наиболее подверженные коррозии, – это щелочные и щелочноземельные. Скорость коррозии снижается при увеличении атомного номера.
- Кристаллическая структура. Она оказывает неоднозначное влияние на разрушение. Крупнозернистая структура сама по себе не приводит к росту коррозии, но благоприятна для развития межкристаллитного избирательного разрушения границ зерна. Металлы и сплавы с однородным распределением фаз корродируют равномерно, а с неоднородным – по очаговому механизму. Взаимное расположение фаз выполняет функцию анода и катода в агрессивной среде.
- Энергетическая неоднородность атомов в кристаллической решетке. Атомы с наибольшей энергией расположены в углах граней микронеровностей и являются активными центрами растворения при химической коррозии. Поэтому тщательная механическая обработка металлических деталей (шлифовка, полировка, доводка) повышает коррозионностойкость. Данный эффект объясняется также формированием более плотных и сплошных оксидных пленок на гладких поверхностях.
Влияние кислотности среды

В процессе химической коррозии концентрация ионов водорода оказывает влияние на следующие моменты:
- растворимость продуктов коррозии;
- формирование защитных оксидных пленок;
- скорость разрушения металла.
При рН в интервале значений 4-10 единиц (кислый раствор) коррозия железа зависит от интенсивности проникновения кислорода к поверхности объекта. В щелочных растворах скорость коррозии сначала уменьшается из-за пассивации поверхности, а затем, при рН>13 увеличивается в результате растворения защитной оксидной пленки.
Для каждого вида металла существует своя зависимость интенсивности разрушения от кислотности раствора. Благородные металлы (Pt, Ag, Au) устойчивы к коррозии в кислой среде. Zn, Al быстро разрушаются как в кислотах, так и в щелочах. Ni и Cd устойчивы к щелочам, но легко корродируют в кислотах.
Состав и концентрация нейтральных растворов
Скорость коррозии в нейтральных растворах зависит в большей степени от свойств соли и ее концентрации:
- При гидролизе солей в коррозионной среде образуются ионы, которые действуют как активаторы или замедлители (ингибиторы) разрушения металла.
- Те соединения, которые увеличивают pH, повышают также скорость деструктивного процесса (например, кальцинированная сода), а те, которые снижают кислотность, – уменьшают ее (хлористый аммоний).
- При наличии хлоридов и сульфатов в растворе разрушение активизируется до достижения некоторой концентрации солей (что объясняется усилением анодного процесса под влиянием ионов хлора и серы), а затем постепенно снижается из-за уменьшения растворимости кислорода.
Некоторые виды солей способны образовывать труднорастворимую пленку (например, фосфорнокислое железо). Это способствует защите металла от дальнейшего разрушения. Данное свойство используется при применении нейтрализаторов ржавчины.
Замедлители коррозии
Замедлители (или ингибиторы) коррозии различаются по механизму действия на окислительно-восстановительный процесс:
- Анодные. Благодаря им образуется пассивная пленка. К данной группе относятся соединения на основе хроматов и бихроматов, нитратов и нитритов. Последний тип ингибиторов применяется для межоперационной защиты деталей. При использовании анодных замедлителей коррозии необходимо предварительно определить их минимальную защитную концентрацию, так как добавление в небольших количествах может привести к увеличению скорости разрушения.
- Катодные. Механизм их действия основан на снижении концентрации кислорода и соответственно, замедлении катодного процесса.
- Экранирующие. Данные ингибиторы изолируют поверхность металла с помощью образования нерастворимых соединений, отлагающихся в виде защитного слоя.
К последней группе относятся нейтрализаторы ржавчины, которые используются также для очистки от окислов. В их состав, как правило, входит ортофосфорная кислота. Под ее влиянием происходит фосфатирование металла – образование прочного защитного слоя нерастворимых фосфатов. Нейтрализаторы наносят пульверизатором или валиком. Через 25-30 минут поверхность приобретает бело-серый цвет. После высыхания состава наносят лакокрасочные материалы.
Механическое воздействие
Повышению коррозии в агрессивной среде способствуют такие типы механического воздействия, как:
- Внутренние (при формовании или термообработке) и внешние (под воздействием приложенной извне нагрузки) напряжения. В результате возникает электрохимическая неоднородность, происходит снижение термодинамической устойчивости материала и формируется коррозионное растрескивание. Особенно быстро происходит разрушение при растягивающих нагрузках (трещины образуются в перпендикулярных плоскостях) в присутствии анионов окислителей, например, NaCl. Типичным примером устройств, подверженных такому типу разрушения, являются детали паровых котлов.
- Знакопеременное динамическое воздействие, вибрации (коррозионная усталость). Происходит интенсивное снижение предела усталости, образуются множественные микротрещины, которые затем сливаются в одну крупную. Число циклов до разрушения в большей степени зависит от химического и фазового состава металлов и сплавов. Такой коррозии подвержены оси насосов, рессоры, лопатки турбин и другие элементы оборудования.
- Трение деталей. Быстрое корродирование обусловлено механическим износом защитных пленок на поверхности детали и химическим взаимодействием со средой. В жидкости скорость разрушения ниже, чем на воздухе.
- Кавитационное ударное воздействие. Кавитация возникает при нарушении сплошности потока жидкости в результате образования вакуумных пузырей, которые схлопываются и создают пульсирующее воздействие. В результате возникают глубокие повреждения локального характера. Данный тип коррозии часто наблюдается в химических аппаратах.
Конструктивные факторы
При конструировании элементов, работающих в агрессивных условиях, необходимо учитывать, что скорость коррозии возрастает в следующих случаях:
- при контакте разнородных металлов (чем больше разница электродного потенциала между ними, тем выше сила тока электрохимического процесса разрушения);
- при наличии концентраторов механических напряжений (канавки, пазы, отверстия и другие);
- при низкой чистоте обработанной поверхности, так как при этом возникают локальные короткозамкнутые гальванические пары;
- при значительной разнице температуры отдельных частей аппарата (образуются термогальванические элементы);
- при наличии застойных зон (щели, зазоры);
- при формировании остаточных напряжений, особенно в сварных соединениях (для их устранения необходимо предусмотреть термическую обработку – отжиг).
Методы оценки
Существует несколько способов оценки скорости разрушения металлов в агрессивных средах:
- Лабораторные – испытания образцов в искусственно смоделированных условиях, близких к реальным. Их преимуществом является то, что они позволяют сократить сроки исследования.
- Полевые – проводятся в естественных условиях. Занимают длительное время. Преимуществом такого метода является получение информации о свойствах металла в условиях дальнейшей эксплуатации.
- Натурные – испытания готовых металлических объектов в естественной среде.
Источник
Лабораторные методы измерения и приборы контроля коррозии
Рубрика: Технические науки
Дата публикации: 07.06.2016 2016-06-07
Статья просмотрена: 3759 раз
Библиографическое описание:
Яхяев, Н. Ш. Лабораторные методы измерения и приборы контроля коррозии / Н. Ш. Яхяев, А. К. Камолов. — Текст : непосредственный // Молодой ученый. — 2016. — № 12 (116). — С. 455-458. — URL: https://moluch.ru/archive/116/29791/ (дата обращения: 20.11.2021).
Для количественного выражения скорости коррозии служат показатели коррозии: массометрический, объёмный механический, токовый и др. Массометрический показатель скорости коррозии — это изменение массы метелла в результате коррозии отнесённое к единице его поверхности, в единицу времени вычисляется по формуле.
Где 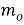
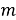
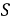
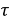
Методы определения скорости коррозии по потерям массы применяют для оценки равномерной. Этими методами невозможно оценивать неравномерную коррозию межкристаллитное и транскристаллитное коррозионные разрушения.
Объёмный показатель коррозии характеризует объем V выделенного или поглощенного в процессии коррозии газа, приведенный к нормальным условиям (T= 273 К, 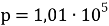
Где -объём поглощенного или выделенного газа, см 2 ; 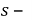
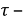
При переходе металла в продукты коррозии и кислых средах выделяется эквивалентное количество водорода. В нейтральных кислородсодержащих средах при образовании продуктов коррозии поглощенного эквивалентное количество кислорода. Объем выделенного водорода или поглощенного кислорода измеряется с помощью эвдиометра.
Глубинный показатель скорости коррозии учитывать уменьшение толщины металла вследствие коррозии, выраженное в линейных единицах и отнесенное к единице времени. Среднее значение глубины коррозионного поражения при равномерной коррозии можно вычислить с помощью массометрического показателя скорости коррозии 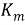
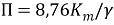
Где 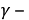
Это показатель удобен для сравнения скорости коррозии металлов с различным плотностями.
Механический показатель коррозии характеризует изменение какого — либо показателя механических свойств металла (%) за определенное время испытаний.
Например показатель изменения предела прочности определяют по формуле
Где 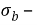
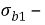
Токовый показатель коррозии позволяет количество прокорродировавщего металла по формуле Фараден, если известна сила коррозионного тока
Где 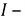
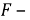
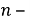
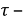
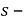
При качественной и количественной оценке коррозионной стойкости металлов рекомендуется пользоваться десятибалльной шкалой (ГОСТ 13819–68) (табл.1)
Десятибалльная шкала коррозионной стойкости металлов (ГОСТ 13819–68)
Группа стойкости
Скорость коррозии металлов, мм/год
Балл
От 0,001 до 0,005
Химический состав и механические свойства некоторых конструкционных материалов. Наибольшие применение для изготовления оборудования нефтяной и газовой промышленности получили стали и чугуны. Среди сталей наиболее часто встречаются углеродистые, низколегированные и нержавеющие.
Конструкционные углеродистые стали делятся на углеродистую сталь обыкновенного качества и сталь качественную.
Сталь углеродистая обыкновенного качества подразделяется в зависимости от назначения и гарантируемых характеристики на три группы: группа А- сталь с гарантируемыми механическими свойствами (применяется для несварных нагруженных элементов конструкций); группа Б- сталь с гарантируемым химическом составе (применяется для сварных элементов неответственных конструкций); группа В-сталь с гарантируемыми механическими свойствами и химическим составом (применяется для сварных элементов ответственных конструкций).
Химический состав углеродистой стали обыкновенного качества
Марки стали
Содержание элементов,%
Углерод
Марганец
Кремний
Лабораторные методы измерений
Лабораторные испытания — это обычно ускоренные испытания, проводимые в определенных, контролируемых условиях, которые могут отличаться от существующих на практике.
Лабораторные коррозионные испытания применяют: при изучении механизма; для оценки стойкости конструкционных материалов и эффективности различных методов защиты от коррозии.
Подготовка образцов. Для гравиметрических коррозионных испытаний размеры образцов ограничивают так, чтобы их можно было взвешивать на аналитических весах. Обычно размеры образцов принимают 40х20х2 или 50х20х2 мм. Для крепления образцов во время испытания в одном из краев пластины сверлят отверстий диаметром 5 мм.
Подготовленные образцы испытывают по методике предусмотренной программой смачивание поверхности образца после погружение его готовить не мене трех образцов. Увеличение число параллельно испытываемых образцов позволяет повысить надежность результатов, особенно в том случае, когда требуется установить относительно небольшое различие в характеристике материала.
Для получения надежной информации об изменении скорости коррозии во времени необходима устанавливать на испытание такое число комплектов образцов, чтобы обеспечивать по крайней мете три периода испытаний.
Удаление продуктов коррозии. Продукты коррозии удаляют после выдержки образцов в растворах, взаимодействующих преимущественно с продуктами коррозии
Визуальное наблюдение коррозионных поражений позволяет фиксировать изменение внешнего вида поверхности металла при этом отмечают время начала появления продуктов коррозии. Их распределение по поверхности металла можно регистрировать последовательным фотографированием.
Для наблюдение распределением катодных и анодных участков по поверхности металла в электролиты вводят специальные реагенты. С помощью K 3 Fe(CN)6 * 2H2O можно фиксировать анодные участки поверхности по синему окрашиванию прилегающего к ним раствора. Фенолфталеин, введенный в раствор, под действием щелочной реакции на катодных металлической поверхности окрашивается в разовый цвет.
Глубину точечного поражения определяют при помощи оптического микроскопа наведением его на резкость сначала по неповрежденной поверхности, а затем по дну питтинга.
Гравиметрический метод — один из наиболее распространенных методов определения скорости коррозии. Самый простой и доступный способ испытания в электролитах — это испытание в открытом сосуде. В лабораторных исследованных обычно используют минимум 150 мл раствора на 1 см 2 поверхности образца.
Подготовленные к испытаниям образцы подвешивают на стеклянных крючках или капроновой нити, опускают в сосуды со средой и испытывают при полном частичном или переменном погружении в неподвижный или перемешиваемый электролит, через который можно пропускать воздух, кислород азот или другой газ.
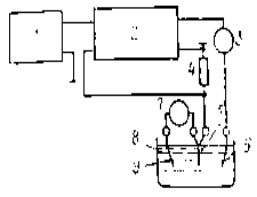
Рис. 1. Схема коррозионных испытаний образцов в открытом сосуде при полном (а), частичном (б), погружении и неподвижный и перемешиваемый (в) раствор; 1-испытаемый образец; 2-подвеска; 3- стеклянный стакан с коррозионным раствором; 4- мешалка.
Рис. 2. Схема работы потенциостата в режиме поддержания постоянного поляризующего тока: 1-источник задающего напряжения; 2-усилитель; 3- миллиамперметр; 4- катукна; 5- рабочий электролит; 6-вспомогательный электрод; 7- вольтметр; 8- электрохимическая ячейка; 9- электрод сравнения.
- Саакиян Л. С., Ефремон А. П. и др. Зашита нефтепромыслового оборудования от коррозии. М.:- Недра, 1985 г, 206 с.
- Кац Н. Г., Стариков В. П., Парфенов С. Н. Химическое сопротивление Материалов и защита оборудования нефтегазопереработки от коррозии. М.: Машиностроение. -2011 г.
- Жук Н. П. Курс теории коррозии и защита металлов: учеб. Пособие/ Жук Н. П. -2-е изд., стереотипное. Перепечатка издания 1976.-М:. ООО ТИД «Альянс», 2006.-472.
Источник