Способы изменения поверхностного натяжения
Вода является основным технологическим производственным сырьевым компонентом и необходимым веществом для поддержания жизни растений, животных и человека на Земле. Благодаря своему особому строению за счет сети водородных связей она обладает рядом особых известных физико-химических свойств [1]. Однако требования к воде, используемой в различных отраслях промышленности и в конкретных производствах, существенно различаются. Поэтому на большинстве промышленных объектов в настоящее время ведутся интенсивные исследования по изучению свойств воды, обработанных различными внешними физическими факторами (электрический ток, вакуумирование, электромагнитное поле и др.) [2].
Проведены исследования по изучению влияния механических воздействий на дистиллированную воду, в которых в качестве основного параметра выбран показатель рН, т.к. по этому показателю можно оценить объемную плотность положительного заряда. Для этого партию дистиллированной воды интенсивно перемешивали на магнитной мешалке при угловой скорости 1400 об/мин в течение разного времени, чтобы получить активированную воду. Активированная вода – такая вода, у которой структурная сетка водородных связей разрыхляется, молекулы воды обретают дополнительные степени свободы. При этом кроме изменения рН установлено изменение электропроводности и окислительно-восстановительного потенциала [3].
Особое внимание уделяется воздействию на воду и водные системы микроволн (МВ) в нетепловом режиме, т.е. без ее нагрева [4]. Для создания инновационных промышленных технологий необходимы работы по поиску доступных приемов управления физико-химическими и химическими свойствами воды.
Целью представленной работы являлась оценка величины изменения поверхностного натяжения растворов неионогенных ПАВ, приготовленных на воде, предварительно обработанной микроволнами с частотой 2,45 ГГц в бытовой микроволновой печи «Samsung». Такая частота является резонансной частотой для молекул воды, которые интенсивно поглощают энергию микроволн.
Вода при воздействии микроволн меняет свои свойства – наблюдается ее структурирование (активирование). При этом происходит образование дополнительных количеств перекиси водорода из растворенного кислорода и молекул активированной воды. Удельное количество энергии, передаваемое воде с помощью бытовой микроволновой печи, рассчитывалось исходя из ее максимальной мощности (700 Вт/ч) и составляло 0,39 Вт/50 мл воды. Связь O–O в молекуле перекиси водорода непрочная, поэтому соединение H2O2 неустойчиво и легко разлагается и диссоциирует с выделением активных анионов (О2)2–, которые далее могут легко окислять различные органические компоненты [4].
В качестве ПАВ взята смесь неионогенных ПАВ, состоящая из простых эфиров на основе пропиленгликоля (дипропиленгликоль – 60 %, трипропиленгликоль – 20 %, полипропиленгликоли – остальное), которая является кубовыми остатками ректификации производства пропиленгликоля.
Для испытаний использованы растворы двух видов:
1 – растворы ПАВ на дистиллированной воде без обработки МВ;
2 – растворы используемых ПАВ, приготовленные на воде, предварительно обработанной МВ.
Содержание поверхностно-активных веществ в серии исследуемых растворов изменялось в пределах 0,1–0,7 %, чтобы проследить наиболее точный диапазон изменения поверхностного натяжения водных растворов без обработки МВ и с обработкой МВ в динамике. Поверхностное натяжение исследуемых водных растворов определялось по известной методике с помощью стеклянного капиллярного вискозиметра типа Убеллоде с диаметром капилляра 0,68 мм. Капиллярные вискозиметры (типа Уббелоде) позволяют определять кинематическую вязкость жидкости в диапазоне от 0,6 до 104 мм2/с при температуре не выше 100 °С. Измерение вязкости сводится к определению времени истечения через капилляр заданного диаметра определенного количества жидкости из измерительного резервуара [3].
Результаты экспериментов в виде изотермы поверхностного натяжения представлены графически на рисунке и в таблице.
Из рисунка следует, что изотермы поверхностного натяжения двух типов рассматриваемых растворов имеют разный геометрический вид: поверхностное натяжение растворов ПАВ на воде, обработанной микроволнами, заметно ниже, чем у подобных растворов на обычной воде без их предварительной обработки микроволновой энергией. Это можно объяснить изменением основной структуры воды в нетепловом режиме за счет образования сетки водородных связей с повышенной энергией водородных связей, за счет внешнего воздействия микроволн [5–6]. Образовавшаяся сеточная структура воды выталкивает молекулы ПАВ на поверхность жидкости, тем самым увеличивая избыточную адсорбцию на границе раздела фаз. Вещество, поверхностно-активное на одной границе раздела фаз, может быть неактивным на другой, и наоборот, что в свою очередь может использоваться для очистки сточных вод промышленных предприятий.
Результаты эксперимента по определению поверхностного натяжения раствора
Поверхностное натяжение раствора (σ∙10–3, Н/м)
Источник
Свойства жидкостей. Поверхностное натяжение
Вещество, находящееся в жидком состоянии, характеризуется крайне плотным расположением молекул друг относительно друга. Отличаясь от твердых кристаллических тел, чьи молекулы формируют упорядоченные структуры по всему объему кристалла и ограничены в своих тепловых колебаниях фиксированными центрами, молекулы жидкости обладают значительной степенью свободы. Любая конкретная молекула жидкого вещества, как это происходит и в твердых телах, «зажата» соседними молекулами и может совершать тепловые колебания поблизости с некоторым положением равновесия. Несмотря на это, в какой-то момент, любая молекула может переместиться на соседнее вакантное место. Подобные перемещения в жидкостях происходят довольно часто, благодаря чему молекулы не привязаны к конкретным центрам, как в кристаллах, а имеют возможность перемещаться по всему объему жидкости. Именно на этом факте основывается текучесть жидкостей.
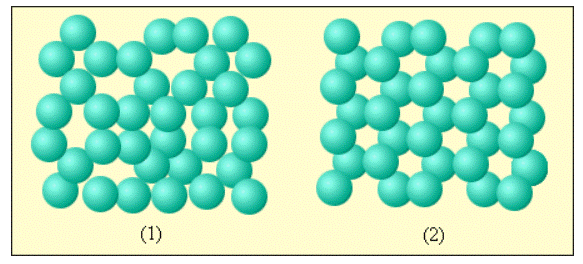
По причине сильного взаимодействия между близко расположенными молекулами они могут образовывать локальные, то есть неустойчивые, упорядоченные группы, включающие в себя несколько молекул. Данное явление носит название ближнего порядка (рис. 3 . 5 . 1 ).
Рисунок 3 . 5 . 1 . Пример ближнего порядка молекул жидкости и дальнего порядка молекул кристаллического вещества: 1 – вода; 2 – лед.
Свойства жидкостей
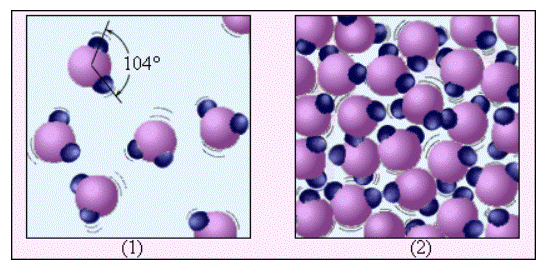
На рисунке 3 . 5 . 2 , на примере воды, проиллюстрировано различие между газообразным веществом и жидкостью. Молекула воды H 2 O включает в свой состав один атом кислорода и два атома водорода, которые расположены под углом 104 ° . В среднем, расстояние между молекулами пара в десятки раз больше, чем между молекулами воды. На рисунке 3 . 5 . 2 , в отличие от рисунка 3 . 5 . 1 , на котором молекулы воды представляют из себя шарики, дается представление о структуре молекулы воды.
Рисунок 3 . 5 . 2 . Водяной пар ( 1 ) и вода ( 2 ) . Молекулы воды увеличены примерно в 5 · 10 7 раз.
Сжимаемость жидкостей, то есть изменение объема вещества при изменении давления, по причине плотности расположения молекул в десятки и сотни тысяч раз меньше, чем сжимаемость газов. К примеру, чтобы изменить объем воды всего на 1 % необходимо повысить значение давления примерно в 200 раз. Подобное увеличение давления по сравнению с атмосферным достигается на глубине близкой к 2 к м .
Подобно твердым телам, жидкости имеют свойство менять свой объем при изменении температуры. В случае не самых больших интервалов температур относительное изменение объема Δ V V 0 пропорционально изменению температуры Δ T , что может быть записано в виде следующего соотношения:
В котором коэффициент β представляет собой температурный коэффициент объемного расширения. Данный коэффициент у жидкостей в десятки раз превышает значение такого же у твердых тел.
К примеру, у воды в случае, если температура равна 20 ° С β в ≈ 2 · 10 – 4 К – 1 , у стали β с т ≈ 3 , 6 · 10 – 5 К – 1 , у кварцевого стекла β к в ≈ 9 · 10 – 6 К – 1 .
Тепловое расширение воды обладает важным для жизни на Земле эффектом. В условиях температуры ниже 4 ° С вода начинает расширяется при снижении температуры β 0 . Максимальную плотность ρ в = 10 3 к г / м 3 вода приобретает при температуре 4 ° С .
Замерзая, вода расширяется, из-за чего лед продолжает плавать на поверхности замерзающего водоема. Температура замерзающей воды подо льдом эквивалентна величине в 0 ° С . У дна водоема, то есть слоях воды, обладающих большей плотностью, температура держится около 4 ° С .
Поверхностное натяжение
Наличие свободной поверхности в жидкостях является одной из самых интересных ее особенностей. В отличие от газов, жидкость не заполняет весь объем сосуда, в котором она находится. Между жидкостью и газом, возможно паром, возникает граница раздела, находящаяся в особых условиях по сравнению с остальной массой жидкости. В отличие от молекул в глубине жидкости, молекулы, располагающиеся в пограничном ее слое, окружены другими молекулами этой же жидкости не со всех сторон. В среднем воздействующие на одну из молекул внутри жидкости со стороны соседних молекул силы межмолекулярного взаимодействия взаимно скомпенсированы. Каждая отдельно взятая молекула в пограничном слое притягивается находящимися внутри жидкости молекулами. При этом, силами, которые оказывают воздействие на такую молекулу жидкости со стороны молекул газа можно пренебречь. Вследствие этого возникает некая направленная вглубь жидкости равнодействующая сила. Поверхностные молекулы втягиваются внутрь жидкости, с помощью действия сил межмолекулярного притяжения. Однако все молекулы, в том числе и принадлежащие пограничному слою, должны находиться в состоянии равновесия. Оно достигается за счет сокращения расстояния между молекулами в пограничном слое и ближайшими их соседями в жидкости. Как проиллюстрировано на рисунке 3 . 1 . 2 , в процессе уменьшения расстояния расстояния между молекулами появляются силы отталкивания. В случае, когда средняя величина расстояния между молекулами в жидкости равна r 0 , молекулы поверхностного слоя расположены плотнее, и по этой причине по сравнению с внутренними молекулами они имеют дополнительным запас потенциальной энергии, что можно увидеть на рисунке 3 . 1 . 2 .
Стоит обратить внимание на то, что более плотного поверхностного слоя не приводит к сколь-нибудь заметному изменению объема жидкости по причине чрезвычайно низкой сжимаемости.
Силы межмолекулярного взаимодействия совершают положительную работу, в случае, когда молекула перемещается с поверхности внутрь жидкости. И наоборот, чтобы достать некоторое количество молекул на поверхность из глубины жидкости, то есть повысить площадь поверхности жидкости, внешним силам необходимо произвести пропорциональную изменению Δ S площади поверхности положительную работу Δ A в н е ш :
Δ A в н е ш = σ ∆ S ,
где коэффициент σ носит название коэффициента поверхностного натяжения ( σ > 0 ) .
Из всего вышесказанного следует, что коэффициент поверхностного натяжения — это величина равная работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В С И коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный ( Д ж / м 2 ) или же в ньютонах на метр ( 1 Н / м = 1 Д ж / м 2 ) .
Таким образом, по сравнению с молекулами внутри жидкости молекулы поверхностного слоя жидкости обладают избыточной потенциальной энергией. Потенциальная энергия E р поверхности жидкости пропорциональна ее площади и выражается в виде следующей формулы:
E р = A в н е ш = σ S .
Из раздела механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии. Следовательно, свободная поверхность жидкости стремится уменьшить свою площадь. По данной причине свободная капля жидкости принимает шарообразную форму.
Жидкость ведет себя таким образом, будто по касательной к ее поверхности действуют сокращающие данную поверхность силы. Такие силы называются силами поверхностного натяжения.
Силы поверхностного натяжения влияют на поверхность жидкости таким образом, что она становится похожей на упругую растянутую пленку, с той лишь разницей, что упругие силы в пленке зависят от площади ее поверхности, то есть от степени деформированности пленки, а силы поверхностного натяжения, зависимости от площади поверхности жидкости не имеют.
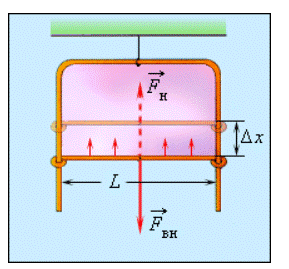
Некоторые жидкости, например, мыльная вода, имеют способность формировать тонкие пленки. Хорошо известные каждому человеку мыльные пузыри обладают правильной сферической формой, в чем также проявляется воздействие сил поверхностного натяжения. В случае, когда в мыльный раствор опускают проволочную рамку с одной подвижной стороной, вся она затягивается пленкой жидкости, как это показано на рисунке 3 . 5 . 3 .
Рисунок 3 . 5 . 3 . Подвижная сторона проволочной рамки в равновесии под действием внешней силы F в н → и результирующей сил поверхностного натяжения F н → .
Силы поверхностного натяжения действуют на уменьшение поверхности пленки. Ради равновесия подвижной стороны рамки к ней необходимо приложить внешнюю силу
F в н → = — F н → . Если воздействие силы F в н → спровоцирует перемещение перекладины на некоторое Δ x , то будет произведена работа Δ A в н = F в н Δ x = Δ E p = σ Δ S , где Δ S = 2 L Δ x является увеличением площади поверхности обеих сторон мыльной пленки. По той причине, что модули сил F в н → и F н → эквивалентны, справедливой будет запись:
F н ∆ x = σ 2 L ∆ x или σ = F н 2 L .
Исходя из этого, можно заявить, что коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
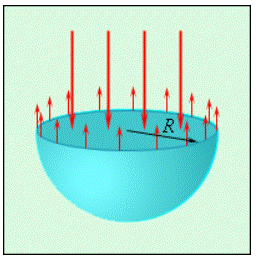
По причине воздействия сил поверхностного натяжения на капли жидкости и их действия внутри мыльных пузырей появляется некоторое избыточное давление Δ p . При мысленном разрезании сферической капли с радиусом R на две равные части каждая из половин должна находиться в равновесии под действием приложенных к границе разреза длиной 2 π R и сил избыточного давления, действующих на площадь π R 2 сечения (рис. 3 . 5 . 4 ) сил поверхностного натяжения. Условие равновесия может быть записано в следующем виде:
σ 2 π R = ∆ p πR 2 .
Исходя из этого, можно заявить, что избыточное давление внутри капли эквивалентно:
∆ p = 2 σ R (капля жидкости).
Рисунок 3 . 5 . 4 . Сечение сферической капли жидкости.
Из-за того, что пленка обладает двумя поверхностями, величина избыточного давления внутри мыльного пузыря в два раза выше, чем в капле:
∆ p = 4 σ R (мыльный пузырь).
Пренебрегая взаимодействием с молекулами газа, можно сказать, что поблизости с границей между твердым телом, жидкостью и газом форма свободной поверхности жидкости зависима от сил взаимодействия молекул жидкости с молекулами твердого тела.
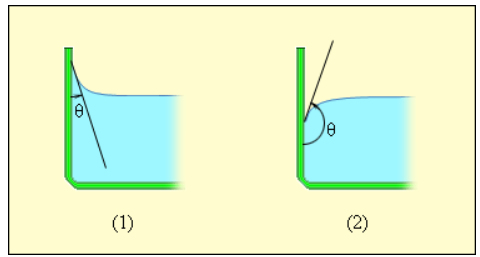
В случае, когда данные силы превышают силы взаимодействия между молекулами жидкости, жидкость смачивает поверхность твердого тела. В таком случае жидкость подходит к поверхности твердого тела под некоторым характерным для данной пары жидкость – твердое тело острым углом θ . Такой угол носит название краевого угла.
Краевой угол θ является тупым (рисунок 3 . 5 . 5 ), в случае, если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела. В подобном случае можно сказать, что поверхность твердого тела не смачивается жидкостью. В условиях полного смачивания θ = 0 , полного несмачивания θ = 180 ° .
Рисунок 3 . 5 . 5 . Краевые углы смачивающей ( 1 ) и несмачивающей ( 2 ) жидкостей.
Капиллярные явления
Капиллярными явлениями называют процесс подъема или опускания жидкости в трубках малого диаметра, другими словами, в капиллярах.
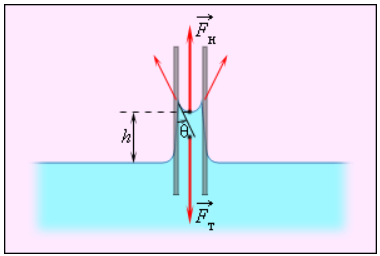
Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. На рисунке 3 . 5 . 6 проиллюстрирована опущенная нижним концом в смачивающую жидкость плотности ρ капиллярная трубка, обладающая некоторым радиусом r . При этом верхний конец капилляра является открытым. Подъем жидкости в капилляре будет происходить до тех пор, пока сила тяжести F т → , оказывающая воздействие на столб жидкости в капилляре, не станет эквивалентна по модулю результирующей F н действующих вдоль границы соприкосновения жидкости с поверхностью капилляра сил поверхностного натяжения: F т = F н , где F т = m g = ρ h π r 2 g , F н = σ 2 π r cos θ .
Из этого следует:
h = 2 σ cos θ ρ g r .
Рисунок 3 . 5 . 6 . Подъем смачивающей жидкости в капилляре.
При полном смачивании θ = 0 , cos θ = 1 . В таком случае:
При полном несмачивании θ = 180 ° , cos θ = – 1 и, соответственно, h 0 . Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Вода почти полностью смачивает чистую поверхность стекла. Ртуть же, строго наоборот, полностью не смачивает стеклянную поверхность. По этой причине уровень ртути в стеклянном капилляре опускается ниже, чем уровень в сосуде.
Источник