Энергия активации
Сильное изменение скорости реакции с изменением температуры объясняет теория активации . Согласно этой теории в химическое взаимодействие вступают только активные молекулы ( частицы ), обладающие энергией , достаточной для осуществления данной реакции . Неактивные частицы можно сделать активными , если сообщить им необходимую дополнительную энергию , — этот процесс называется активацией . Один из способов активации — увеличение температуры : при повышении температуры число активных частиц сильно возрастает , благодаря чему резко увеличивается скорость.
Энергия , которую надо сообщить молекулам ( частицам ) реагирующих веществ , чтобы превратить их в активные , называется энергией активации .
Ее определяют опытным путем , обозначают буквой Е a и обычно выражают в кДж / моль . Так , например , для соединения водорода и иода ( Н 2 + I 2 = 2 Н I ) Еа = 167,4 кДж / моль , а для распада иодоводорода (2 Н I = Н 2 + I 2 ) Еа = 186,2 кДж / моль .
Энергия активации Е a зависит от природы реагирующих веществ и служит характеристикой каждой реакции. Эти представления поясняются рисунком:
на примере реакции в общем виде А 2 + В 2 = 2 АВ . Ось ординат характеризует потенциальную энергию системы, ось абсцисс — ход реакции : исходное состояние → переходное состояние → конечное состояние . Чтобы реагирующие вещества А 2 и В 2 образовали продукт реакции АВ , они должны преодолеть энергетический барьер С . На это затрачивается энергия активации Еа , на значение которой возрастает энергия системы . При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группировка , называемая переходным состоянием или активированным комплексом ( в точке С ), последующий распад которого приводит к образованию конечного продукта АВ . Механизм реакции можно изобразить схемой
 |  |  |  | 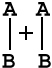 |
| исходные реагенты (начальное состояние системы) | активированный комплекс (переходное состояние) | продукты реакции (конечное состояние системы) |
Если при распаде активированного комплекса выделяется больше энергии , чем это необходимо для активации частиц , то реакция экзотермическая . Примером эндотермической реакции служит обратный процесс — образование из вещества АВ веществ А 2 и В 2 : 2 АВ = А 2 + В 2 . В этом случае процесс протекает также через образование активированного комплекса А2В 2 , однако энергия активации больше , чем для прямого процесса : Еа = Еа + ∆ H (∆ H — тепловой эффект реакции ). Для протекания эндотермических реакций требуется подвод энергии извне .
Как видно из рисунка 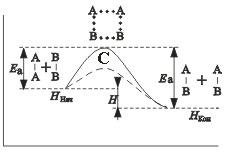
разность энергий конечного состояния системы ( H кон ) и начального ( H нач ) равна тепловому эффекту реакции :
Скорость реакции непосредственно зависит от значения энергии активации : если оно мало , то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой , но если энергия активации велика , то реакция идет медленно .
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью ( практически мгновенно ).
Источник
Способы изменения энергии активации
§ 9.3 Почему все возможные химические реакции еще не произошли? Энергия активации. Понятие о скорости химической реакции.
Рассмотрим реакцию, которая происходит в замкнутом сосуде между некими газообразными веществами А и Б по уравнению:
Для того, чтобы молекулы А и Б прореагировали между собой, они должны сначала столкнуться. Причем столкновение должно быть достаточно энергичным . Энергия, запасенная в молекулах А и Б, должна быть больше какой-то определенной величины — иначе они просто отталкиваются друг от друга, не вступая в реакцию (рис.9-5а). Если же энергия столкновения достаточна, образуется продукт В (рис. 9-5б).
Рис. 9-5. а) Молекулы реагентов не вступает в химическую реакцию после столкновения, так как энергия молекул недостаточна. б) Энергия молекул А и Б достаточна для того, чтобы столкновение между ними привело к химической реакции с образованием продукта В.
Мерой «энергичности» молекул может служить, например, скорость их движения, которая возрастает с повышением температуры газа. Кстати, тепло или холод мы воспринимаем именно как результат столкновений окружающих нас «быстрых» или «медленных» молекул атмосферы с нашей кожей.
Однако не все молекулы при данной температуре обладают одинаковой энергией и движутся с одинаковой скоростью. Существует распределение молекул по скоростям, а значит и по энергии. Только часть молекул движется с очень малой или очень большой скоростью, но большинство — с некоторой средней скоростью (рис. 9-6). Реагировать может только та часть молекул, в которых запасенная энергия выше некоторого определенного предела для каждой конкретной реакции (эта область заштрихована на рис.9-6).
Рис. 9-6. Распределение молекул по энергии при какой-то определенной температуре. По горизонтальной оси отложена энергия молекул. На вертикальной оси показано количество молекул данной энергии. Значение E min представляет собой некоторую минимальную энергию, которой должна обладать молекула, чтобы вступить в некую химическую реакцию. Количество таких «активных» молекул пропорционально заштрихованной площади под кривой.
Пояснить ситуацию может простой пример, который однажды уже приводился в §2.7 по другому поводу: по городским улицам движется множество машин, причем только небольшая их часть едет либо с очень маленькой, либо, наоборот, с очень большой скоростью. Основная же масса транспорта движется по городу с какой-то средней (не очень большой и не очень маленькой) скоростью. В реакционном сосуде молекулы тоже распределяются по скоростям (и по энергии) неравномерно. Необходимой для химической реакции энергией обладает только ЧАСТЬ сталкивающихся молекул.
** Расчеты показывают, что в обычных условиях молекулы газа сталкиваются между собой чрезвычайно часто. Однако, как мы видим, далеко не все столкновения молекул А и Б приводят к химической реакции между ними. Значительная часть молекул «ждет» удачного столкновения, чтобы переместиться в закрашенную на рис. 9-6 область. Такой способ приобретения молекулами энергии называется термической активацией молекул. Но этот способ — не единственный. Например, если молекула А только что образовалась в результате какой-нибудь экзотермической реакции и еще не успела отдать энергию в окружающую среду, она оказывается активированной для дальнейших реакций. Такой способ активации не требует столкновений с другими молекулами и называется химической активацией . Еще один способ активации молекул без столкновений — поглощение ими энергии света. Но, подчеркнем, в большинстве наблюдаемых нами реакций активированные молекулы находятся в меньшинстве по сравнению с основной массой «не активных» молекул.
Отсюда следует важный вывод: никакая химическая реакция не может происходить мгновенно (сразу между всеми молекулами), поскольку значительная их часть просто не обладает достаточной энергией для этого. Следовательно, каждая химическая реакция происходит с какой-то конечной СКОРОСТЬЮ. Под скоростью реакции мы будем понимать число молекул, которые вступают в химическое взаимодействие с другими молекулами за единицу времени. Удобно это число молекул выражать в МОЛЯХ и относить к единице объема смеси.
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
С математическим выражением для скорости химической реакции мы познакомимся в следующем параграфе. Пока же обсудим, что происходит с «энергичной» молекулой А в тот момент, когда она вступает в химическое взаимодействие с молекулой Б.
В это время с молекулами А и Б происходит настоящая катастрофа — старые химические связи уже почти разрушились, а новые, характерные для молекулы В, еще не успели вполне сформироваться. В такой момент вещество, заключенное в этих молекулах, неустойчиво и имеет высокую энергию. Подобное состояние в химической реакции называется ПЕРЕХОДНЫМ СОСТОЯНИЕМ (когда молекула представляет собой нечто «среднее» между молекулами А, Б и В ).
Графически переходное состояние реакции можно изобразить так, как показано на рис. 9-7. Здесь по вертикальной оси отложена СРЕДНЯЯ энергия молекул на разных стадиях химического превращения — когда они еще являются молекулами А и Б, затем когда уже превратились в переходное состояние и, наконец, когда стали молекулой В. Горизонтальная ось называется координатой реакции и отражает степень «похожести» вещества в процессе реакции на конечную молекулу В. Переходное состояние вещества занимает самую высокую позицию на оси энергии.
Рис.9-7. Энергетический профиль экзотермической реакции А + Б = В. Разница между средней энергией молекул А и Б и средней энергией переходных состояний (которые тоже рассматриваются как молекулы), называется энергетическим барьером или энергией активации Е а этой реакции. Энергетические барьеры существуют не только у экзо- , но и у эндо термических реакций.
Итак, мы видим, что начальное и конечное состояние вещества в химической реакции разделены неким энергетическим барьером. Его величину обычно выражают в кДж на моль А (или на моль Б). Этот барьер называется энергией активации реакции и обозначается символом Е а .
Энергия активации Е а — это та дополнительная энергия (к средней энергии Е сталкивающихся частиц), которая необходима, чтобы столкновение привело к химической реакции.
** Не следует путать значения Е а и Е min из рис. 9-6. Во-первых, по достижении молекулами энергии Е min скорость реакции еще настолько мала, что такую реакцию мы вряд ли могли бы наблюдать.
Во-вторых, энергия активации Е а — это разница между СРЕДНЕЙ энергией исходных веществ и СРЕДНЕЙ энергией того же вещества, уже находящегося в переходном состоянии (при этом переходные состояния тоже рассматриваются как МОЛЕКУЛЫ, пусть даже и необычные ). В отличие от E min , которую можно представить для отдельной молекулы, энергия активации Е а может быть определена только для АНСАМБЛЯ реагирующих молекул! Термин «энергия активации» для ОТДЕЛЬНОЙ молекулы не имеет никакого смысла.
Приведем пример. На рис. 9-8 показано распределение по скоростям молекул газообразного азота при трех различных температурах. Азот — очень инертное вещество, но все-таки его можно заставить вступать в химические реакции. Допустим, молекулы азота могут реагировать с неким элементом только тогда, когда они «разогнаны» до скорости 2000 м/сек и более.
Рис. 9-8. Распределение молекул газообразного азота по скоростям при трех различных температурах. Температура в кельвинах указана рядом с каждой кривой (кривые распределения взяты их книги Р. Дикерсона и соавт. «Основные законы химии», М.: «Мир», 1982, т. 1, стр. 143).
Поскольку энергия не берется «ниоткуда», при температуре 1273 К энергия переходного состояния вещества находится где-то в закрашенной (желтым цветом) области «энергичных» молекул. Разница между этой средней энергией переходных состояний и средней энергией исходных молекул называется энергией активации Е а .
Если мы повысим температуру реагирующей смеси до 2273 К, то кривая сдвигается вправо по шкале энергий (и шкале скорости молекул), но разница ΔЕ = Е а сохранится. Таким образом, энергия активации Е а практически не зависит от температуры.
Этого нельзя сказать о скорости реакции, которая с повышением температуры увеличивается. Действительно, теперь область энергичных» молекул закрашена не только желтым, но и оранжевым цветом. Эта площадь пропорциональна числу реагирующих молекул. Следовательно, при температуре 2273 К скорость реакции будет заметно выше, чем при температуре 1273 К.
Можно изобразить это и другим способом. На рис 9-9 показаны три ситуации: а) при низкой температуре вообще нет активированных молекул и химическая реакция не происходит; б) при повышении температуре реакция уже идет, но её скорость не велика; в) при высокой температуре реакция идет с заметной скоростью.
Рис. 9-9. При повышении температуры активационный барьер Е а и тепловой эффект реакции Q не изменяются, но возрастает скорость химической реакции.
До сих пор мы сравнивали ОДНУ И ТУ ЖЕ реакцию при разных температурах. Если же сравнить между собой РАЗЛИЧНЫЕ химические реакции, протекающие в одинаковых условиях, то выясняется следующее.
Для каждой химической реакции характерно свое собственное значение Е а (не зависящее от температуры). В большинстве случаев энергия активации химических реакций между нейтральными молекулами составляет от 80 до 240 кДж/моль. Чем НИЖЕ активационный барьер Еа какой-либо химической реакции, тем БЫСТРЕЕ она идет в данных условиях, потому что большее число молекул А и Б способны преодолевать барьер в единицу времени.
Если в другой химической реакции активационный барьер ВЫШЕ, то такая реакция в тех же условиях идет МЕДЛЕННЕЕ. Если барьер очень высок, в системе вообще нет молекул, способных преодолеть активационный барьер и реакция не происходит.
Итак, мы видим, что для протекания химической реакции молекулы исходных веществ должны сначала преодолеть активационный барьер Е а . Таким образом, активационный барьер может являться препятствием для самопроизвольного протекания даже очень «выгодных» с энергетической точки зрения экзотермических реакций.
Например, если бы не было активационного барьера, реакция горения метана в кислороде начиналась бы сразу после соприкосновения метана с воздухом. В этом случае не только природный газ (в нем 95% метана), но и нефть, бензин, уголь, бумагу, одежду, мебель, деревянные постройки и все, что в принципе может гореть, пришлось бы тщательно изолировать от воздуха. К счастью, на пути самопроизвольного протекания этих экзотермических реакций стоит активационный барьер Е а .
Когда мы подносим горящую спичку к открытой конфорке газовой плиты, мы заставляем какую-то часть молекул метана и кислорода «перескочить» активационный барьер, не преодолимый при комнатной температуре. В дальнейшем энергия активации для взаимодействия все новых и новых молекул метана и кислорода черпается уже из тепла самой экзотермической реакции.
9.9 . Возможна ли жизнь на планете земного типа, где энергия активации для любой химической реакции была бы равна нулю? Как вы думаете, какие явления, наблюдаемые на Земле, были бы невозможны на такой планете?
9.10 . Оцените (по принципу больше–меньше) энергии активации>: а) реакции окисления железа кислородом в присутствии воды; б) реакции окисления метана кислородом. Напишите уравнения этих реакций.
9.11 . Приведите по одному примеру: а) физического превращения и б) химического превращения, протекающих с очень высокими скоростями. Приведите по одному примеру таких превращений, протекающих с очень низкими скоростями.
9.12 . Прочитав этот параграф, наш хороший знакомый Юх задумался над тем, нельзя ли изобрести такой прибор, который мог бы снижать до нуля энергию активации любых химических реакций? Допустим, думал Юх, такой прибор уже создан в моей лаборатории и его предстоит испытать. Что произойдет во время испытания?
Юх взял лист бумаги и сделал набросок фантастического рассказа: «Едва я включил прибор, как в лаборатории вспыхнули шторы и начал тлеть деревянный лабораторный стол, на котором стояла установка. Хорошо, что перед испытанием я смочил одежду водой из пульверизатора, поэтому одежда пока не загоралась, но внезапно задымились кожаные ботинки. К счастью, мне самому ничего не грозило – ведь в атмосфере 21% кислорода, а при такой его концентрации горючие предметы не воспламеняются, если их влажность превышает 15%. И лес за окном, и зеленая трава пока тоже в безопасности! Но надо было спасать шторы и стол. Я бросился к водопроводному крану и с ужасом обнаружил, что железные трубы на моих глазах вспучиваются от ржавчины и рассыпаются в труху! В лабораторию хлынула вода из отверстий в стене, а за окном вдруг взметнулся столб пламени – это взорвался бензобак нашего автомобиля. Хорошо, что радиус действия прибора ограничен, успел подумать я и вдруг ощутил волчий голод. К счастью, моя мысль теперь работала с быстротой молнии — в мгновение ока я отключил прибор! Шторы и стол мгновенно погасли, а за окном перестали быть видны всполохи огня. Я с облегчением опустился на слегка обугленный стул. «
Найдите одну существенную и несколько мелких неточностей в фантастическом рассказе нашего уважаемого Юха, исправьте их и дополните рассказ другими деталями.
Источник




