- Агрегатные состояния вещества
- Переходы между агрегатными состояниями
- Агрегатные состояния вещества
- Твердые и жидкие тела
- Газ, испарение, конденсация и плавление
- Агрегатное состояние вещества — виды и условия перехода
- Общие понятия
- Твердые тела
- Изменение жидкостей
- Процесс парообразования
- Динамическое равновесие
- Газообразное состояние
- Сравнительная таблица
- Область применения
Агрегатные состояния вещества
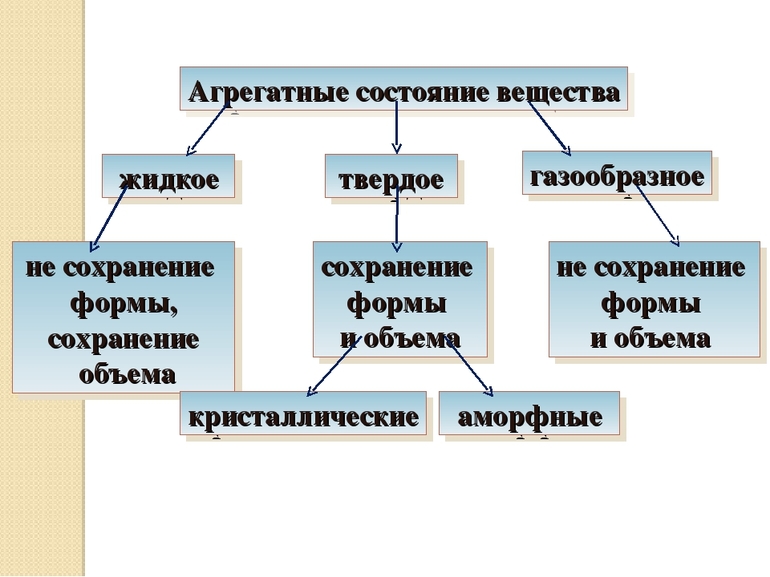
Агрегатное состояние — это состояние вещества, которое зависит от температуры и давления. В природе вещества встречаются в трёх агрегатных состояниях: твёрдом, жидком и газообразном.
Вещество, находящееся при стандартных условиях в твёрдом состоянии, называется твёрдым веществом, в жидком состоянии — жидким веществом или жидкостью, в газообразном — газообразным веществом или газом.
При одинаковых условиях (температуре и давлении) различные вещества могут находиться в разных агрегатных состояниях.
Пример. В стандартных условиях:
- железо, сера, алюминий — твёрдые вещества.
- вода, бензол, ртуть — жидкости.
- кислород, аргон, углекислый газ — газы.
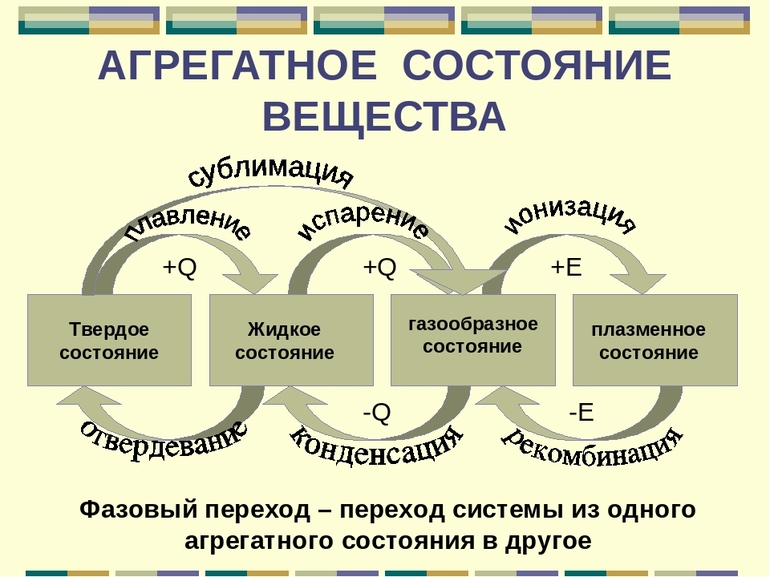
Переходы между агрегатными состояниями
Многие вещества при изменении условий могут переходить из одного агрегатного состояния в другое.
Пример. При температуре ниже 0 °C вода превращается в лёд, т. е. переходит из жидкого состояния в твёрдое.
Переход вещества из газообразного состояния в жидкое называется конденсацией. Переход вещества из жидкого состояния в газообразное называется испарением.
При увеличении температуры вещества испарение становится интенсивнее. И, наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Такая температура называется температурой кипения вещества. Испарение и кипение — это два способа перехода жидкости в газообразное состояние.
Испарение происходит с поверхности жидкости, а при кипении жидкость переходит в газообразное состояние, как с поверхности, так и внутри неё.
Когда говорят о веществах в газообразном состоянии, иногда помимо термина газ используется и слово пар. Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества.
Разница между газом и паром в том, что газ имеет температуру выше критической или равную ей, а пар — ниже.
Пример. Критическая температура воды равна примерно 374 °C. Вода в газообразном состоянии, которая имеет температуру ниже критической, например, 5 °C или 120 °С, будет именно паром, а не газом. А вот, например, кислород, гелий и азот – газы, так как они имеют температуру выше критической (у каждого из них критическая температура ниже -100 °C).
В быту под словом пар обычно подразумевают именно водяной пар.
Переход вещества из жидкого состояния в твёрдое называется кристаллизацией. Переход вещества из твёрдого состояния в жидкое называется плавлением.
Переход вещества из твёрдого состояния сразу в газообразное называется возгонкой или сублимацией. Переход из газообразного состояния в твёрдое называется десублимацией.
При всех этих явлениях частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое вещество.
Одни вещества могут иметь любое из трёх агрегатных состояний, другие — нет.
Пример. Вода может находиться в твёрдом состоянии (лёд), жидком (вода) и газообразном (водяной пар). Для сахара известны только два агрегатных состояния: твёрдое и жидкое.
При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует.
Взаимные переходы веществ из одного агрегатного состояния в другое в виде схемы:
Источник
Агрегатные состояния вещества
Агрегатные состояния вещества (от лат. “aggrego” означает “присоединяю”, “связываю”) – это состояния одного и того же вещества в твердом, жидком и газообразном виде.
При переходе из одного состояния в другое наблюдается скачкообразное изменение энергии, энтропии, плотности и прочих свойств вещества.
Твердые и жидкие тела
Твердые тела – это тела, которые отличаются постоянством своей формы и объема.
В твердых телах межмолекулярные расстояния маленькие, а потенциальную энергию молекул можно сравнить с кинетической.
Твёрдые тела подразделяются на 2 вида:
В состоянии термодинамического равновесия находятся только лишь кристаллические тела. Аморфные же тела по факту представляют собой метастабильные состояния, которые по строению схожи с неравновесными, медленно кристаллизующимися жидкостями. В аморфном теле происходит чересчур медленный процесс кристаллизации, процесс постепенного преобразования вещества в кристаллическую фазу. Разница кристалла от аморфного твердого тела состоит, в первую очередь, в анизотропии его свойств. Свойства кристаллического тела определяются в зависимости от направления в пространстве. Разнообразные процессы (например, теплопроводность, электропроводность, свет, звук) распространяются в разных направлениях твердого тела по-разному. А вот аморфные тела (например, стекло, смолы, пластмассы) изотропные, как и жидкости. Разница аморфных тел от жидкостей заключается лишь только в том, что последние текучие, в них не происходят статические деформации сдвига.
У кристаллических тел правильное молекулярное строение. Именно за счет правильного строения кристалл имеет анизотропные свойства. Правильное расположение атомов кристалла создает так называемую кристаллическую решетку. В разных направлениях месторасположение атомов в решетке различное, что и приводит к анизотропии. Атомы (ионы либо целые молекулы) в кристаллической решетке совершают беспорядочное колебательное движение возле средних положений, которые и рассматриваются в качестве узлов кристаллической решетки. Чем выше температура, тем выше энергия колебаний, а значит, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний определяется размер кристалла. Увеличение амплитуды колебаний приводит к увеличению размеров тела. Таким образом, объясняется тепловое расширение твердых тел.
Жидкие тела – это тела, имеющие определенный объем, но не имеющие упругой формы.
Для вещества в жидком состоянии характерно сильное межмолекулярное взаимодействие и малая сжимаемость. Жидкость занимает промежуточное положение между твердым телом и газом. Жидкости, также как и газы, обладают изотpопными свойствами. Помимо этого, жидкость обладает свойством текучести. В ней, как и в газах, нет касательного напряжения (напряжения на сдвиг) тел. Жидкости тяжелые, то есть их удельные веса можно сравнить с удельными весами твердых тел. Вблизи температур кристаллизации их теплоемкости и прочие тепловые свойства близки к соответствующим свойствам твердых тел. В жидкостях наблюдается до заданной степени правильное расположение атомов, но только лишь в маленьких областях. Здесь атомы также проделывают колебательное движение около узлов квазикристаллической ячейки, однако в отличие от атомов твердого тела они периодически перескакивают от одного узла к другому. В итоге движение атомов будет весьма сложное: колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Газ – это такое состояние вещества, при котором расстояния между молекулами огромны.
Силами взаимодействия между молекулами при небольших давлениях можно пренебречь. Частицы газа заполоняют весь объем, который предоставлен для газа. Газы рассматривают как сильно перегретые либо ненасыщенные пары. Особый вид газа – плазма (частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов почти одинаковые). То есть плазма – это газ из заряженных частиц, взаимодействующих между собой при помощи электрических сил на большом расстоянии, но не имеющих ближнего и дальнего расположения частиц.
Как известно, вещества способны переходить из одного агрегатного состояния в другое.
Испарение – это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости либо твердого тела вылетают молекулы, кинетическая энергия которых преобразовывает потенциальную энергию взаимодействия молекул.
Испарение является фазовым переходом. При испарении часть жидкости или твердого тела преобразуется в пар.
Вещество в газообразном состоянии, которое находится в динамическом равновесии с жидкостью, называется насыщенным паром. При этом изменение внутренней энергии тела равняется:
где m – это масса тела, r – это удельная теплота парообразования ( Д ж / к г ) .
Конденсация представляет собой процесс, обратный парообразованию.
Изменение внутренней энергии рассчитывается по формуле ( 1 ) .
Плавление – это процесс преобразования вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
При нагревании вещества растет его внутренняя энергия, поэтому увеличивается скорость теплового движения молекул. При достижении веществом своей температуры плавления кристаллическая решетка твердого тела разрушается. Связи между частицами также разрушаются, растет энергия взаимодействия между частицами. Теплота, которая передается телу, идет на увеличение внутренней энергии данного тела, и часть энергии расходуется на совершение работы по изменению объема тела при его плавлении. У многих кристаллических тел объем увеличивается при плавлении, однако есть исключения (к примеру, лед, чугун). Аморфные тела не обладают определенной температурой плавления. Плавление представляет собой фазовый переход, который характеризуется скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она остается неизменной в ходе процесса. Тогда изменение внутренней энергии тела равняется:
где λ – это удельная теплота плавления ( Д ж / к г ) .
Кристаллизация представляет собой процесс, обратный плавлению.
Изменение внутренней энергии рассчитывается по формуле ( 2 ) .
Изменение внутренней энергии каждого тела системы при нагревании или охлаждении вычисляется по формуле:
где c – это удельная теплоемкость вещества, Д ж к г К , △ T – это изменение температуры тела.
При рассматривании преобразований веществ из одних агрегатных состояний в другие нельзя обойтись без так называемого уравнения теплового баланса: суммарное количество теплоты, выделяемое в теплоизолированной системе, равняется количеству теплоты (суммарному), которое в данной системе поглощается.
Q 1 + Q 2 + Q 3 + . . . + Q n = Q ‘ 1 + Q ‘ 2 + Q ‘ 3 + . . . + Q ‘ k .
По сути, уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
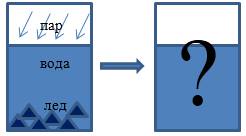
В теплоизолированном сосуде находятся вода и лед с температурой t i = 0 ° C . Масса воды m υ и льда m i соответственно равняется 0 , 5 к г и 60 г . В воду впускают водяной пар массой m p = 10 г при температуре t p = 100 ° C . Какой будет температура воды в сосуде после того, как установится тепловое равновесие? При этом теплоемкость сосуда учитывать не нужно.
Определим, какие процессы осуществляются в системе, какие агрегатные состояния вещества мы наблюдали и какие получили.
Водяной пар конденсируется, отдавая при этом тепло.
Тепловая энергия идет на плавление льда и, может быть, нагревание имеющейся и полученной изо льда воды.
Прежде всего, проверим, сколько теплоты выделяется при конденсации имеющейся массы пара:
Q p = — r m p ; Q p = 2 , 26 · 10 6 · 10 — 2 = 2 , 26 · 10 4 ( Д ж ) ,
здесь из справочных материалов у нас есть r = 2 , 26 · 10 6 Д ж к г – удельная теплота парообразования (применяется и для конденсации).
Для плавления льда понадобится следующее количество тепла:
Q i = λ m i Q i = 6 · 10 — 2 · 3 , 3 · 10 5 ≈ 2 · 10 4 ( Д ж ) ,
здесь из справочных материалов у нас есть λ = 3 , 3 · 10 5 Д ж к г – удельная теплота плавления льда.
Выходит, что пар отдает тепла больше, чем необходимо, только для расплавления имеющегося льда, значит, уравнение теплового баланса запишем следующим образом:
r m p + c m p ( T p — T ) = λ m i + c ( m υ + m i ) ( T — T i ) .
Теплота выделяется при конденсации пара массой m p и остывании воды, образуемой из пара от температуры T p до искомой T . Теплота поглощается при плавлении льда массой m i и нагревании воды массой m υ + m i от температуры T i до T . Обозначим T — T i = ∆ T для разности T p — T получаем:
T p — T = T p — T i — ∆ T = 100 — ∆ T .
Уравнение теплового баланса будет иметь вид:
r m p + c m p ( 100 — ∆ T ) = λ m i + c ( m υ + m i ) ∆ T ; c ( m υ + m i + m p ) ∆ T = r m p + c m p 100 — λ m i ; ∆ T = r m p + c m p 100 — λ m i c m υ + m i + m p .
Сделаем вычисления с учетом того, что теплоемкость воды табличная
c = 4 , 2 · 10 3 Д ж к г К , T p = t p + 273 = 373 К , T i = t i + 273 = 273 К : ∆ T = 2 , 26 · 10 6 · 10 — 2 + 4 , 2 · 10 3 · 10 — 2 · 10 2 — 6 · 10 — 2 · 3 , 3 · 10 5 4 , 2 · 10 3 · 5 , 7 · 10 — 1 ≈ 3 ( К ) ,
тогда T = 273 + 3 = 276 К
Ответ: Температура воды в сосуде после установления теплового равновесия будет равняться 276 К .
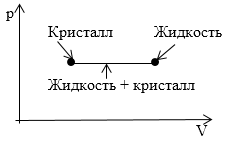
На рисунке 2 изображен участок изотермы, который отвечает переходу вещества из кристаллического в жидкое состояние. Что соответствует данному участку на диаграмме p , T ?
Ответ: Вся совокупность состояний, которые изображены на диаграмме p , V горизонтальным отрезком прямой на диаграмме p , T показано одной точкой, которая определяет значения p и T , при которых происходит преобразование из одного агрегатного состояния в другое.
Источник
Агрегатное состояние вещества — виды и условия перехода
Общие понятия
При нормальных внешних условия все вещества находятся в своем привычном состоянии: кислород — в газообразном, вода — в жидком, кристаллы — в твердом. Их изменение вызывает переход одного и того же вещества в разные состояния, которые называются агрегатными. Повышение или понижение температуры и/или давления окружающей среды влияет на характер взаимодействия между частицами, составляющими вещество (молекулами, атомами, ионами), и расстояние между ними.
Бывает три вида агрегатных состояний (АС):
Переход вещества из одного АС в другое называется фазовым и сопровождается скачкообразным изменением его физических и химических свойств — плотности, растворимости, кинетической и потенциальной энергии частиц и др. Всего существует шесть процессов, вызывающих изменение агрегатного состояния вещества:
- Плавление — преобразование твердого тела в жидкое (таяние льда).
- Обратный процесс — кристаллизация или затвердение (морозные узоры на стекле).
- Парообразование — переход вещества из жидкого АС в газообразное. Частные случаи — испарение происходит только с поверхности жидкости; кипение, при котором жидкость превращается в пар по всему объему.
- Обратный процесс — конденсация.
- Сублимация или возгонка — переход из твердого АС сразу в газообразное без жидкой стадии.
- Десублимация — обратное преобразование.
Сублимированию в той или иной мере подвержены все твердые тела, но в основном количество частиц, покинувших тело, настолько мало, что процесс практически незаметен. Примеры явной сублимации — графит и сухой лед (оксид углерода). Даже сильное нагревание не приводит их в жидкое состояние, а постепенно превращает в газ. Запахи твердых тел тоже обусловлены возгонкой — отрываясь от поверхности, молекулы скапливаются в пары, обладающие ароматом (камфара, нафталин). Молекулы некоторых органических веществ, например, белков, настолько большие, что не позволяют им принять газообразную форму.
Твердые тела
При нормальных условиях находятся в стабильной форме и сохраняют свой объем. По внутреннему строению и свойствам разделяются на кристаллические и аморфные. Первые отличаются строго упорядоченным положением частиц, между которыми установлены сильные взаимосвязи — ковалентные полярные и неполярные, ионные, металлические. Тип взаимодействия определяет физические свойства твердого тела. Это, как правило, металлы и их оксиды, обладающие хорошей тепло- и электропроводностью, прочные и упругие.
Свойства аморфных тел близки к жидкостным, так как их молекулы передвигаются между хаотично расположенными условными центрами. К ним относятся разнообразные смолы, пластмассы, стекло и другие неметаллы. Нагревание кристаллических веществ приводит к нарушению упорядоченного расположения частиц, увеличению расстояний между ними и рекристаллизации. При определенной температуре, которая называется температурой плавления, перестройка молекул приводит к превращению твердого тела в жидкость. Количество теплоты, которое нужно, чтобы расплавить некоторую массу вещества, вычисляют по формуле: Q = km, где k — удельная теплота плавления этого вещества, m — его масса.
Молекулярная кинетическая энергия остается неизменной, поэтому дальнейшее нагревание вещества не приводит к повышению его температуры до тех пор, пока все оно не превратится в жидкость. Если продолжать нагрев, то с поверхности расплавленного металла начнется испарение — беспорядочный отрыв отдельных молекул, который является началом перехода в газообразное состояние. При кристаллизации, начинающейся при снижении температуры, остывающее тело само отдает тепло в атмосферу.
Опытным путем установлено, что температуры плавления и кристаллизации у каждого металла равны друг другу, а их точно известное значение отличает кристаллические тела от аморфных. В отличие от металлов, аморфные вещества не плавятся, а размягчаются. Например, стекло при нагревании сначала становится мягким, его легко согнуть или растянуть.
Дальнейшее повышение температуры приводит к тому, что оно под действием силы тяжести растекается по сосуду, который занимает. Эта масса, поначалу очень густая, постепенно приобретает консистенцию воды. Таким образом процесс перехода аморфного тела в жидкое происходит не при фиксированной температуре, как у кристаллических тел, а растягивается на все время нагревания.
Изменение жидкостей
Жидкости — это тела, занимающие весь объем, в котором находятся, образующие поверхность, но не способные удерживать упругую форму. Для них свойственно сильное межмолекулярное взаимодействие и низкая сжимаемость, что определяет их положение между газообразным и твердым АС. Жидкости изотропны, текучи и обладают удельным весом, сравнимым с тем же показателем у твердых тел.
Правильное расположение внутренних частиц распространяется на небольшие области — они не только колеблются вокруг узлов так называемой квазикристаллической решетки, но и могут перескакивать между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве. Этим объясняется текучесть тел в жидком АС. Если понизить температуру до границ кристаллизации, то различные тепловые свойства жидкостей приблизятся к показателям твердых тел.
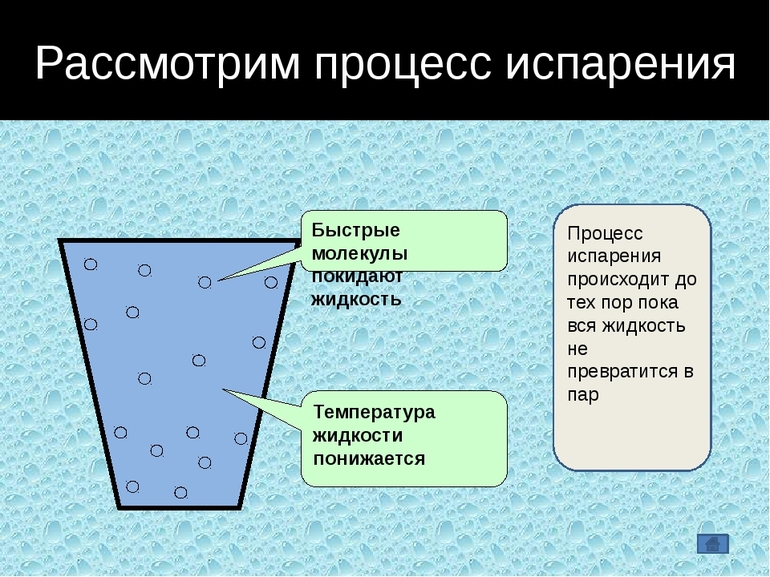
Процесс парообразования
Некоторые молекулы жидкости могут преодолеть силы поверхностного натяжения и перейти в парообразную форму, чем объясняется явление испарения, происходящее при любой температуре. Когда она повышается, процесс становится интенсивней и распространяется на весь объем. Появляется все больше пузырьков насыщенного пара, прорывающихся из глубины на поверхность.
При температуре кипения, имеющей определенное значение для каждого жидкого тела, давление пара внутри пузырьков превышает атмосферное, и начинается интенсивный переход жидкости в газообразное АС. При пониженном атмосферном давлении температура кипения той же жидкости становится ниже.
Динамическое равновесие
Когда жидкость находится в открытой емкости, то ее количество обязательно уменьшится вследствие испарения. Но если сосуд закрыть, то этого не произойдет. Сначала начнется процесс испарения и продолжится до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров.
Можно сказать, что замкнутая система придет в динамическое (подвижное) равновесие, так как процесс обмена молекул будет продолжаться и дальше, т. е. испарение и конденсация в замкнутой системе происходят одновременно и компенсируют друг друга. Пар, который находится в таком равновесии с соответствующей жидкостью, называется насыщенным. Изменение внутренней энергии вещества определяется по формуле: ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Динамическое равновесие у разных жидкостей наступает при разной плотности пара. Это зависит от силы межмолекулярного взаимодействия. Если они велики как, например, у ртути, то только незначительное число самых быстрых молекул может покидать поверхность жидкости, а равновесие наступает при малой плотности пара. У летучих жидкостей молекулы разлетаются очень быстро, поэтому нужна высокая плотность для наступления равновесия.
Газообразное состояние
При этом АС частицы химических элементов и их соединений связаны друг с другом слабо или не связаны вообще и заполняют весь предоставленный объем. Такое состояние вещества широко распространено в природе: воздушные массы атмосферы; скопления газов под землей; газообразная материя, растворенная в водах Мирового океана.
Все газы отличаются следующими свойствами:
- равномерно заполняют весь предоставленный объем, при этом не создавая поверхность;
- имеют малую плотность при высокой скорости диффузии;
- сравнительно легко сжимаются.
Эти характеристики определяются большими расстояниями между молекулами и их притяжением друг к другу. Газообразное АС веществ можно рассматривать, как перегретый или ненасыщенный пар. При сверхвысоких температурах газ частично или полностью ионизируется, при этом сохраняя общую электрическую нейтральность, потому что плотности отрицательных и положительных зарядов находятся примерно на одном уровне.
Так образуется плазма, которую некоторые ученые рассматривают, как четвертый вид АС вещества. В ней взаимодействие происходит между ионами и свободными электронами с помощью электрических сил, действующих на большом расстоянии. Вещества, которые при нормальных условиях являются газами, самопроизвольно переходить в жидкое состояние не могут.
Увеличение давления и понижение температуры приводит к уменьшению расстояний между молекулами и увеличению силы взаимодействия до такой степени, что вещество из газообразного состояния переходит в жидкое, т. е. изменяет свое АС. Этот процесс называется сжижением и характеризуется критической температурой. Она определяется в точке, после которой превращение газа в жидкость невозможно ни при каком давлении.
Для каждого газообразного вещества значение этой температуры свое. Оно бывает примерно равно комнатной, как у аммиака, хлора и углекислого газа, тогда для сжижения достаточно воздействовать на газ только давлением. У водорода и гелия, например, критическая температура намного ниже комнатной. Перед сжижением их сначала охлаждают до температуры чуть ниже критической, а затем доводят до жидкого АС повышенным давлением.
Сравнительная таблица
Различие между твердыми материалами, жидкостями и газами объясняется внутренними процессами, зависящими от агрегатного состояния вещества. В таблице приведены характерные для каждого класса особенности.
| Состояние вещества | Расположение и характер движения частиц | Энергия взаимодействия | Физические свойства |
| Твердое | Расстояния между частицами, колеблющимися около положения равновесия, сопоставимы с их размерами. | Потенциальная энергия превышает кинетическую. Взаимодействие между частицами сильное. | Сохраняют собственную форму и объем. Имеют точную температуру кристаллизации и плавления. Обладают твердостью, прочностью и упругостью. |
| Жидкое | Частицы расположены вплотную и сохраняют близкий порядок упорядоченности. Могут перескакивать из одного положения равновесия в другой. | Модуль кинетической энергии почти равен потенциальной. | Сохраняют объем, но не форму. Закипают при определенной температуре. Текучи, почти не поддаются сжатию. |
| Газообразное | Частицы расположены хаотично на расстояниях, сильно превышающих их собственные размеры. Хаотичное движение частиц с довольно большими скоростями приводит к постоянным столкновениям между ними. | Кинетическая энергия по модулю намного превышает потенциальную. Легко заполняют весь предоставленный объем и сжимаются. | Принимают форму тех предметов, в которых находятся. |
Можно отметить, что переход вещества из одного АС в другое зависит от соотношения потенциальной и кинетической энергии его частиц.
Область применения
Способность металлов плавиться и поддаваться обработке в жидком состоянии широко применяется в черной и цветной металлургии. В технологиях получения соли и других химических соединений используется процесс выпаривания, при котором нужное вещество получается после испарения жидкости. В разных областях промышленности и техники распространено применение жидких газов.
Инертные газы используются в осветительных приборах, жидкий кислород — в медицине в качестве средства анестезии, при сварке металлов в смеси с ацетиленом.
Жидкий водород — это ракетное топливо, а оксид серы уничтожает плесень. В рефрижераторах и промышленных холодильниках применяют жидкий аммиак, кроме того, сжиженные газы удобней транспортировать.
Источник