- Энергия в клетке. Использование и хранение
- Способы использования энергии организмами
- Способы получения энергии живыми организмами
- Превращение энергии живыми организмами
- Понятие о высокоэнергетических и низкоэнергетических фосфатах
- Использование энергии живыми организмами
- Фазы освобождения энергии из питательных веществ
- Биологическое окисление
Энергия в клетке. Использование и хранение
Всем привет! Эту статью я хотел посвятить клеточному ядру и ДНК. Но перед этим нужно затронуть то, как клетка хранит и использует энергию (спасибо spidgorny). Мы будем касаться вопросов связанных с энергией почти везде. Давайте заранее в них разберемся.
Из чего можно получать энергию? Да из всего! Растения используют световую энергию. Некоторые бактерии тоже. То есть органические вещества синтезируются из неорганических за счет световой энергии. + Есть хемотрофы. Они синтезируют органические вещества из неорганических за счет энергии окисления аммиака, сероводорода и др. веществ. А есть мы с вами. Мы — гетеротрофы. Кто это такие? Это те, кто не умеет синтезировать органические вещества из неорганических. То есть хемосинтез и фотосинтез, это не для нас. Мы берем готовую органику (съедаем). Разбираем ее на кусочки и либо используем, как строительный материал, либо разрушаем для получения энергии.
Что конкретно мы можем разбирать на энергию? Белки (сначала разбирая их на аминокислоты), жиры, углеводы и этиловый спирт (но это по желанию). То есть все эти вещества могут быть использованы, как источники энергии. Но для ее хранения мы используем жиры и углеводы. Обожаю углеводы! В нашем теле основным запасающим углеводом является гликоген.
Он состоит из остатков глюкозы. То есть это длинная, разветвленная цепочка, состоящая из одинаковых звеньев (глюкозы). При необходимости в энергии мы отщепляем по одному кусочку с конца цепи и окисляя его получаем энергию. Такой способ получения энергии характерен для всех клеток тела, но особенно много гликогена в клетках печени и мышечной ткани.
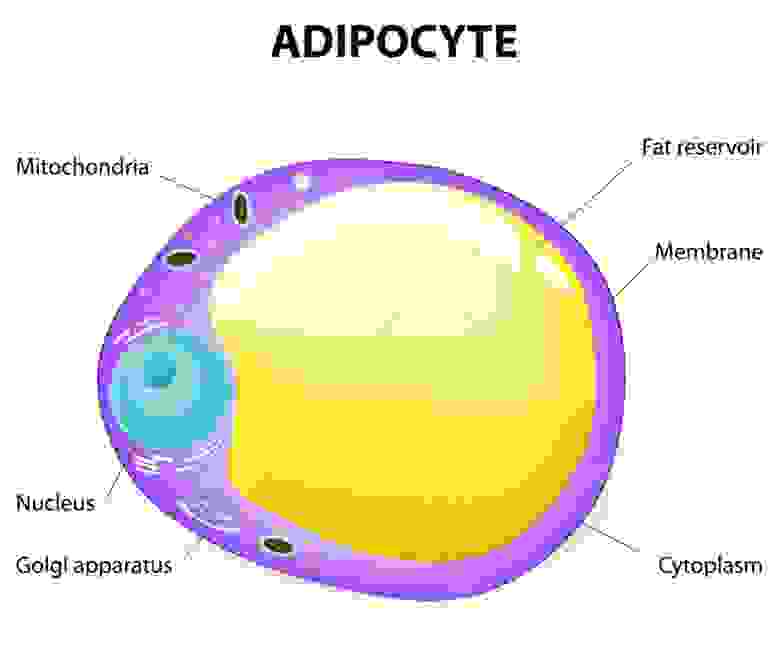
Теперь поговорим о жире. Он хранится в специальных клетках соединительной ткани. Имя им — адипоциты. По сути это клетки с огромной жировой каплей внутри.
При необходимости, организм достает жир из этих клеток, частично расщепляет и транспортирует. По месту доставки происходит окончательное расщепление с выделением и преобразованием энергии.
Довольно популярный вопрос: «Почему нельзя хранить всю энергию в виде жира, или гликогена?»
У этих источников энергии разное назначение. Из гликогена энергию можно получить довольно быстро. Его расщепление начинается почти сразу после начала мышечной работы, достигая пика к 1-2 минуте. Расщепление жиров протекает на несколько порядков медленней. То есть если вы спите, или медленно куда-то идете — у вас постоянный расход энергии, и его можно обеспечить расщепляя жиры. Но как только вы решите ускориться (упали сервера, побежали поднимать), резко потребуются много энергии и быстро ее получить расщепляя жиры не получится. Тут нам и нужен гликоген.
Есть еще одно важное различие. Гликоген связывает много воды. Примерно 3 г воды на 1 г гликогена. То есть, для 1 кг гликогена это уже 3 кг воды. Не оптимально… С жиром проще. Молекулы липидов (жиры=липиды), в которых запасается энергия не заряжены, в отличие от молекул воды и гликогена. Такие молекулы называется гидрофобными (дословно, боящимися воды). Молекулы воды же поляризованы. Примерно так это выглядит.
По сути, положительно заряженные атомы водорода взаимодействуют с отрицательно заряженными атомами кислорода. Получается стабильное и энергетически выгодное состояние.
Теперь представим молекулы липидов. Они не заряжены и не могут нормально взаимодействовать с поляризованными молекулами воды. Поэтому смесь липидов с водой энергетически невыгодна. Молекулы липидов не способны адсорбировать воду, как это делает гликоген. Они «кучкуются» в так называемые липидные капли, окружаются мембраной из фосфолипидов (одна их сторона заряжена и обращена к воде снаружи, вторая — не заряжена и смотрит на липиды капли). В итоге, у нас есть стабильная система, эффективно хранящая липиды и ничего лишнего.
Окей, мы разобрались с тем, в каких формах хранится энергия. А что с ней происходит дальше? Вот отщепили мы молекулу глюкозы от гликогена. Превратили ее в энергию. Что это значит?
Сделаем небольшое отступление.
В клетке происходит порядка 1.000.000.000 реакций каждую секунду. При протекании реакции одно вещество трансформируется в другое. Что при этом происходит с его внутренней энергией? Она может уменьшаться, увеличиваться или не меняться. Если она уменьшается -> происходит выделение энергии. Если увеличивается -> нужно взять энергию из вне. Организм обычно совмещает такие реакции. То есть энергия, выделившаяся при протекании одной реакции идет на проведение второй.
Так вот в организме есть специальные соединения, макроэрги, которые способны накапливать и передавать энергию в ходе реакции. В их составе есть одна, или несколько химических связей, в которых и накапливается эта энергия. Теперь можно вернуться к глюкозе. Энергия выделившаяся при ее распаде запасется в связях этих макроэргов.
Разберем на примере.
Самым распространенным макроэргом (энергетической валютой) клетки является АТФ (Аденозинтрифосфат).
Выглядит примерно так.
В его состав входит азотистое основание аденин (одно из 4, используемых для кодирования информации в ДНК), сахар рибоза и три остатка фосфорной кислоты (поэтому и АденозинТРИфосфат). Именно в связях между остатками фосфорной кислоты накапливается энергия. При отщеплении одного остатка фосфорной кислоты образуется АДФ (АденозинДИфосфат). АДФ может выделять энергию, отрывая еще один остаток и превращаясь в АМФ (АденозинМОНОфосфат). Но эффективность отщепленная второго остатка намного ниже. Поэтому, обычно, организм стремится из АДФ снова получить АТФ. Происходит это примерно так. При распаде глюкозы, выделяющаяся энергия тратится на образование связи между двумя остатками фосфорной кислоты и образование ATP. Процесс многостадийный и пока мы его опустим.
Получившийся АТФ является универсальным источником энергии. Он используется везде, начиная от синтеза белка (для соединения аминокислот нужна энергия), заканчивая мышечной работой. Моторные белки, осуществляющие мышечное сокращение используют энергию, запасенную в АТФ, для изменения своей конформации. Изменение конформации это переориентация одной части большой молекулы относительно другой. Выглядит примерно так.
То есть химическая энергия связи переходит в механическую энергию. Вот реальные примеры белков, использующих АТФ для осуществления работы.
Знакомьтесь, это миозин. Моторный белок. Он осуществляет перемещение крупных внутриклеточных образований и участвует в сокращении мышц. Обратите внимание, у него имеется две «ножки». Используя энергию запасенную в 1 молекуле АТФ он осуществляет одно конформационное изменение, по сути один шаг. Самый наглядный пример перехода химической энергии АТФ в механическую.
Второй пример — Na/K насос. На первом этапе он связывает три молекулы Na и одну АТФ. Используя энергию АТФ, он меняет конформацию, выбрасывая Na из клетки. Затем он связывает две молекулы калия и, возвращаясь к исходной конформации, переносит калий в клетку. Штука крайне важная, позволяет поддерживать уровень внутриклеточного Na в норме.
А если серьезно, то:
Пауза. Зачем нам АТФ? Почему мы не можем использовать запасенную в глюкозе энергию напрямую? Банально, если окислить глюкозу до CO2 за один раз, мгновенно выделится экстремально много энергии. И большая ее часть рассеется в виде тепла. Поэтому реакция разбивается на стадии. На каждой выделяется немного энергии, она запасается, и реакция продолжается пока вещество полностью не окислиться.
Подитожу. Запасается энергия в жирах и углеводах. Из углеводов ее можно извлечь быстрее, но в жирах можно запасти больше. Для проведения реакций клетка использует высокоэнергетические соединения, в которых запасается энергия распада жиров, углеводов и тд… АТФ — основное такое соединение в клетке. По сути, бери и используй. Однако не единственное. Но об этом позже.
Источник
Способы использования энергии организмами
Биоэнергетика — это раздел биофизики, связанный с изучением механизмов преобразования энергии в живых объектах в процессах их жизнедеятельности.
Основу биоэнергетики составляет термодинамика — наука о законах превращения энергии из одного вида и формы в другой. Термодинамика не дает ответа на вопрос, какова природа или механизм того или иного явления. Она исследует исключительно энергетическую сторону процессов и способна ответить на вопрос, возможно ли протекание данного процесса с точки зрения энергетики. В основе термодинамики лежит несколько простых принципов, приложимых к любым химическим процессам, где бы они ни происходили — в живых или в неживых системах.
- Первый принцип, или первый закон термодинамики [показать] .
Первый закон термодинамики был обоснован в результате обобщения многовекового опыта всего, человечества. Впервые наиболее обобщенно он был сформулирован в работах М. В. Ломоносова (1744), Гесса (1840), Мейера и Джоуля (1842), Гельмгольца (1847).
Первый закон термодинамики устанавливает, что общая сумма энергии материальной системы остается постоянной величиной независимо от изменений, происходящих, в самой системе; изменение энергии системы возможно только в результате обмена энергией с окружающей средой.
Таким образом, первый закон термодинамики (который иногда называют законом сохранения энергии) является количественным выражением закона сохранения энергии, который гласит, что энергия не исчезает и не возникает, а только переходит из одной формы в другую в эквивалентных количествах.
Допустим, имеется замкнутая систма, которая обменивается энергией со средой. Из закона сохранения энергии следует, что, зная энергию, переданную окружающей средой системе, а также энергию, переданную системой окружающей среде, можно вычислить изменение внутренней энергии системы. Под внутренней энергией системы следует понимать общую сумму всех видов энергии в данной системе (механической, тепловой, химической, электрической и пр.).
Если между системой и средой произошел обмен энергией и совершилась работа, то изменение внутренней энергии системы dU можно найти из уравнения: dU = dQ + dA, (2) где dQ — количество переданного тепла; dА — количество совершенной работы.
Уравнение (2) математически выражает первый закон термодинамики: изменение внутренней энергии системы равно алгебраической сумме тепла, переданного в процессе, и совершенной работы.
Второй закон термодинамики можно кратко сформулировать следующим образом: «Энтропия вселенной возрастает». Энтропия — это неупорядоченное состояние внутренней энергии (которая не способна производить работу). Второй закон можно выразить и иначе: «Физические и химические процессы в замкнутой системе происходят таким образом, что энтропия системы стремится к максимуму».
Следовательно, энтропия — это мера хаотичности или неупорядоченности. Поскольку почти все превращения энергии сопровождаются потерей некоторого количества тепла, обусловленной беспорядочным движением молекул, энтропия окружающей среды при этом повышается. Живые организмы и составляющие их клетки высокоорганизованны и поэтому их энтропия невелика. Они сохраняют это «низкоэнтропийное» состояние за счет повышения энтропии внешней среды.
Когда мы едим конфеты и превращаем содержащуюся в них глюкозу в двуокись углерода и воду, которые выделяются во внешнюю среду, мы повышаем энтропию среды. Стремление к состоянию с максимальной энтропией — движущая сила всех процессов. Выделение организмом тепла или поглощение тепла из окружающей среды приводит систему «организм — среда» к состоянию с максимальной энтропией.
Кроме того, имеется так называемая свободная энергия. Ее можно рассматривать как ту часть общей энергии системы, которая способна производить работу в изотермических условиях (без изменения температуры). Энтропия и свободная энергия связаны известной зависимостью; увеличение энтропии при необратимом процессе сопровождается уменьшением количества свободной энергии. Все физические и химические процессы протекают с уменьшением свободной энергии до тех пор, пока не достигается состояние равновесия, при котором свободная энергия системы минимальна, а энтропия максимальна. Свободная энергия — это полезная энергия, а энтропия служит мерой энергии, которую уже нельзя использовать.
Термодинамика не дает ответа на вопрос, какова природа или механизм того или иного явления. Она исследует исключительно энергетическую сторону процессов и способна ответить на вопрос, возможно ли протекание данного процесса с точки зрения энергетики.
Для того, чтобы описать протекание процесса превращения энергии в любом объекте окружающего мира, необходимо вначале представить данный объект с позиции термодинамики, т.е. в виде системы, которая классифицируется по признаку возможности обмена энергии и вещества с другими объектами или с окружающей средой. Таким образом, различают:
- закрытые системы — обмен энергией возможен, обмен веществом невозможен
- изолированные системы — обмен энергией и обмен веществом невозможен
- открытые системы — обмен энергией и обмен веществом возможен
Живой организм представляет собой типично открытую поточную систему, непрерывно обменивающуюся с окружающей средой и веществом, и энергией. Это значит, что с пищей, водой, при газообмене в организм из окружающей среды поступают разнообразные химические соединения. По химическому составу они отличаются от данного организма. В организме эти соединения подвергаются глубоким изменениям и превращениям, уподобляются его химическому составу и входят в морфологические структуры организма, но лишь временно. Через определенный период усвоенные вещества подвергаются разрушению, осовбождая скрытую в них энергию, а продукты распада удаляются во внешнюю среду. При этом разрушенную молекулу мгновенно заменяет новая, не нарушая целостности структурных компонентов организма.
Поток вещества и энергии, наблюдаемый в организме, обусловливает самообновление и самовоспроизведение. Т.о., изменение энергетического баланса в системе «организм-окружающая среда» является непременным условием существования живого организма. Если в организме прекратятся процессы превращения энергии, то в нем прекратится и жизнь.
Способы получения энергии живыми организмами
Источник всей биологической энергии на нашей планете является солнечный свет. Лучистая энергия солнечного света возникает из ядерной энергии: при очень высоких температурах в недрах Солнца атомы водорода превращаются в атомы гелия, что сопровождается освобождением энергии первоначально в виде гамма-лучей. Реакция протекает согласно уравнению 4Н -> Не 4 + 2е + hv, где Н — постоянная Планка, а v — длина волны гамма-излучения. В конечном счете в результате взаимодействия гамма-лучей с электронами снова выделяется энергия в виде фотонов световой энергии, которая испускается Солнцем.
Энергия солнечного света достигая поверхности земли улавливается зелеными растениями, которые превращают ее в химическую энергию, запасаемую в форме химических связей, соединяющих атомы в определенных молекулах, например в глюкозе, синтезируемой растением. Этот первый этап преобразования энергии называется фотосинтезом: зеленые растения осуществляют его при помощи пигмента хлорофилла, который позволяет клеткам превращать лучистую энергию в химическую. Эта химическая энергия используется затем для синтеза углеводов и других веществ из двуокиси углерода и воды, что способствует росту растений или частично передается на следующий уровень (рис.1.).
Передача энергии на следующий уровень происходит при поедании растения животным или разложение его бактериями. При этом химическая энергия углеводов и других молекул в результате окисления этих молекул преобразуется в биологически полезную энергию, количество которой соответствует количеству энергии, израсходованной на синтез этих веществ (первый закон термодинамики); однако часть этой энергии превращается в тепло, т. е. не может быть использована в дальнейшем (второй закон термодинамики). Биологически полезная энергия, полученная в результате окисления той же глюкозы, запасается в форме макроэргических связей аденозинтрифосфата (АТФ).
Сущность жизни — это нескончаемый поток энергии: в клетке, от одной клетки к другой или от одного организма к другому.
Живые клетки обладают сложными и эффективными системами для превращения одного вида энергии в другой.
Превращения энергии происходят главным образом в двух структурах — в хлоропластах, имеющихся у зеленых растений, и в митохондриях, имеющихся в клетках как растений, так и животных.
Изучением превращений энергии в живых организмах занимается биоэнергетика.
Люди, подобно другим животным, получают энергию из продуктов, которыми они питаются. Часть нашей пищи, например горох, картофель, яблоки или груши, мы получаем непосредственно от растений. Свинина, говядина, рыба, крабы или раки — продукты животного происхождения, однако животные, дающие нам эти продукты, в свою очередь получили энергию, поедая различные растения. В конечном итоге всю пищу и энергию животные получают от растений.
Т.о., по способу получения энергии организмы делят на фототрофы (источник энергии — свет) и хемотрофы (источник энергии — окислительно-восстановительные реакции). Растения получают энергию в виде электромагнитного излучения Солнца, а животные используют энергию, заключенную в ковалентных связях органических молекул, которые поступают в организм с пищей [показать] .
| Таблица 1. Классификация живых организмов по особенностям метаболизма | ||
| Источник энергии | Тип организма | Представители |
| Солнечный свет | Фототрофный | Фотосинтезирующие органы высших растений, водоросли, бактерии |
| Окислительно-восстановительные реакции: | Хемотрофный | Клетки животных, бактерий, нефотосинтезирующие клетки бактерий |
| донор – органические вещества, акцептор – О2 | Хемоорганотрофный (аэробный) | То же |
| донор и акцептор – органические вещества | Хемоорганотрофный (анаэробный) | – // – |
| донор – неорганические вещества, акцептор – О2 | Хемолитотрофный (аэробный) | Бактерии |
| донор и акцептор – неорганические вещества | Хемолитотрофный (анаэробный) | То же |
| донор – органические вещества, акцептор – смешанный (органические вещества и О2) | Хемоорганотрофный (факультативно анаэробный) | Клетки высших животных, бактерии |
| Смешанный: | ||
| свет и окислительно-восстановительные реакции | Миксотрофный | Фотосинтезирующие клетки растений в разные фазы – световую и темновую |
| свет и окислительно-восстановительные реакции органических веществ | Миксоорганотрофный | То же |
| свет и окислительно-восстановительные реакции неорганических веществ | Миксолитотрофный | Фотосинтезирующие бактерии |
Метаболические системы организмов
Живые организмы используют разные источники питательных веществ и энергии. В связи с чем их можно разделить
- по отношению к источникам питания
- Автотрофные (от греч. autos – сам и trophe – пища, питание), или самопитающиеся организмы. Используют низкомолекулярные неорганические соединения (СО2, Н2О, соединения азота и серы) в качестве исходного питательного материала для биосинтеза органических веществ. В зависимости от формы потребляемой энергии автотрофные организмы подразделяют на фотосинтезирующие и хемосинтезирующие.
- Гетеротрофные (от греч. heteros – другой и trophe — пища) организмы (питающиеся за счет других), используют в качестве источника питания уже готовые, т.е. синтезированные другими организмами органические вещества.
- Миксотрофные (от лат. mixtus – смешанный) – это организмы, способные как к синтезу органических веществ, так и к использованию их в готовом виде. Например, эвглена зеленая на свету является автотрофом, а в темноте – гетеротрофом, т.е. способна использовать как энергию солнечного света, так и (в темноте) энергию химических связей в молекулах различных соединений.
- фототрофы — фототрофные организмы, которые в качестве источника энергии для биосинтеза используют энергию Солнца
- хемотрофы — хемотрофные организмы, которые способны к преобразованию и использованию энергии окислительно-восстановительных реакций, т.е. энергии, выделяемой при окислении различных соединений.
В окислительно-восстановительных реакциях используется энергия донора электронов, которая извлекается клеткой при переходе электронов к химическому акцептору, т. е. к окислителю. Оба вещества в этих процессах всегда участвуют вместе и образуют пару донор-акцептор, или окислительно-восстановительную пару.
- хемоорганотрофы — живые организмы, которые в окислительно-восстановительных процессах образуют пару донор-акцептор из органических веществ
- хемолитотрофы — живые организмы, которые образуют пару донор-акцептор из неорганических веществ
Разнообразие живых организмов дополняет их отношение к кислороду как акцептору электронов.
- Аэробные организмы (от греч. aer – воздух) — организмы, использующие в качестве акцептора электронов кислород
- Анаэробные микроорганизмы — организмы, не нуждающиеся в кислороде
Часто клетки высших организмов и бактерии имеют оба типа энергетики — анаэробный и аэробный. Поэтому такие клетки и организмы называют факультативными анаэробами, хотя степень факультативности, или зависимости от кислорода, у них различна. Например, высшие организмы без него долго обходиться не могут. Имеются и облигатные анаэробы, в частности микроорганизмы, для которых кислород вообще не нужен и даже ядовит.
Кроме того в науке существует и другое мнение в вопросе, что дает пища: энергию или отрицательную энтропию [показать] ?
Что дает пища: энергию или отрицательную энтропию?
Крайне интересно и поучительно будет узнать, что говорил о жизни один из величайших физиков-теоретиков Эрвин Шрёдингер. В своей книжке «Что такое жизнь с точки зрения физики», вышедшей в 1944 году, Шрёдингер презрел общепринятое убеждение, что мы и все остальные организмы питаемся энергией. Он настаивал: «То, чем кормится организм, — отрицательная энтропия».
Это высказывание вызвало протесты многих ученых, отвечая на которые он признал, что энергетическая составляющая пищи все же имеет значение. Однако теперь мы остались без четкого ответа. Чем же мы питаемся — энергией или «отрицательной энтропией»? Почему более чем за полвека, на протяжении которых книжка Шрёдингера переиздавалась не менее 18 раз, никто так и не предложил своего варианта ответа? Я (Гильберт Линг) вижу основную причину этой нерешительности в логике теории мембранных насосов, прямо противоречащей предположению Шрёдингера.
Как читатель уже отлично знает, согласно теории мембранных насосов, клетка содержит лишь свободные вещества и свободную воду, а это — уже максимум энтропии и дальнейший ее рост невозможен. В этом случае живая клетка, согласно теории мембранных насосов, содержит не больше «отрицательной энтропии», чем погибшая. А если учесть, что погибшая клетка склонна к большей жесткости (трупное окоченение), можно даже подумать, что в погибшей клетке больше отрицательной энтропии (упорядоченности), чем в живой. Однако Шрёдингер твердо верил, что именно отрицательная энтропия «бережет нас от смерти».
Выходит, что либо Шрёдингер не прав, либо теория мембранных насосов. Ранее было показано, что определенно не права теория мембранных насосов. Значит ли это, что мы, в самом деле, потребляем именно отрицательную энтропию?
И да, и нет. Дело вот в чем. Ранее были представлены данные, доказывающие, что адсорбированное состояние клеточного К + и клеточной воды — неотъемлемая черта покоящегося живого состояния. Адсорбция ограничивает свободу их перемещения и создает тем самым отрицательную энтропию, что полностью согласуется с акцентом Шрёдингера на необходимости высокой отрицательной энтропии для существования жизни. Но нельзя ведь потреблять саму по себе отрицательную энтропию и прямо направлять ее к молекулам воды и ионам К + , к примеру, чтобы они адсорбировались. Однако мы можем добиться этого косвенно.
Благодаря потрясающим достижениям биохимии нам стало известно, что распад каждой молекулы глюкозы до СO 2 и воды в результате гликолиза и окислительного фосфорилирования сопровождается синтезом 36 молекул АТФ. Адсорбция АТФ кардинальными центрами основных внутриклеточных белков (например, миозина в мышечных волокнах) влечет за собой тотальную адсорбцию воды и К + с утратой ими свободы перемещения и соответствующим ростом отрицательной энтропии.
Итак, мы потребляем не отрицательную энтропию как таковую. Мы потребляем пищу, содержащую доступную для использования энергию, благодаря чему образуется АТФ. АТФ, в свою очередь, адсорбируясь на белке, вызывает адсорбцию большей части внутриклеточного К + и, что самое важное, — адсорбцию почти всей внутриклеточной воды с образованием множества поляризованных, ориентированных слоев. При этом отрицательная энтропия существенно растет (а по абсолютной величине — снижается) и поддерживается на высоком уровне клетками в состоянии покоя. При циклической работе клетки, когда с каждым новым циклом протоплазма возвращается в исходное состояние покоя, энергия пищи тратится на ресинтез АТФ, затрачиваемой во время каждого цикла физиологической активности для восстановления этого исходного состояния.
Источник: Линг Г. Физическая теория живой клетки: незамеченная революция. — СПб.: Наука, 2008. — 376 с
Превращение энергии живыми организмами
В живом мире различают три основных вида превращения энергии (рис. 2):
- Лучистая энергия солнечного света улавливается имеющимся в зеленых растениях зеленым пигментом хлорофиллом и превращается в процессе так называемого фотосинтеза в химическую энергию, которая используется для синтеза из двуокиси углерода и воды углеводов и других сложных молекул. Энергия солнечного света, представляющая собой одну из форм кинетической энергии, превращается таким образом в один из типов потенциальной энергии. Химическая энергия запасается в молекулах углеводов и других питательных веществ в форме энергии связей между входящими в их состав атомами.
- Химическая энергия углеводов и других молекул превращается в процессе клеточного дыхания в биологически доступную энергию макроэргических фосфатных связей. Такого рода превращения энергии осуществляются в митохондриях.
- Превращение энергии макроэргических фосфатных связей (АТФ) в различные формы энергии, используемые клетками для совершения разнообразных работ (рис. 73, таб.1): механической работы, электрической, осмотической и т.д. Часть энергии при этом теряется, рассеиваясь в форме тепла.
| Превращение | Где оно происходит |
| Химической энергии в электрическую | Нервные клетки; головной мозг |
| Звуковой энергии в электричеcкую | Внутреннее ухо |
| Световой энергии в химическую | Хлоропласты |
| Световой энергии в электрическую | Сетчатка глаза |
| Химической энергии в осмотическую | Почки |
| Химической энергии в механическую | Мышечные клетки, ресничный эпителий |
| Химической энергии в лучистую | Органы свечения светляка |
| Химической энергии в электрическую | Органы вкуса и обоняния |
Понятие о высокоэнергетических и низкоэнергетических фосфатах
Энергия, высвобождаемая в катаболических процессах, аккумулируется в соединениях, как правило, являющихся ангидридами фосфорной кислоты (АТФ). Эта энергия используется для осуществления большинства клеточных процессов, протекающих с затратой энергии, т.е. для обеспечения различных физиологических видов работ.
Когда говорят о богатых энергией связях (макроэргических связях), то в этом случае энергию связи определяют как разницу свободных энергий соединения, содержащего эту связь, и соединений, получающихся после ее разрыва. Так, протекание реакции АТФ + Н2O->АДФ + Фв связано с уменьшением свободной энергии на 30,2 кДж/моль (или на 7,3 ккал/моль) при pH 7,0, температуре 37 °С, избытке ионов магния и 1,0 М концентрации исходного вещества и продуктов реакции.
Макроэргическими принято считать те связи, при гидролизе которых изменения свободной энергии системы (-ΔG) составляют более 21 кДж/моль (или более 5 ккал/моль).
К соединениям, обладающим богатой энергией связью, помимо АТФ, относятся также УТФ, ЦТФ, ГТФ, ТТФ, креатинфосфат, некоторые тиоэфиры (например, ацил-КоА), фосфоенолпируват, 1,3-дифосфоглицерат и некоторые другие соединения. Однако образование этих макроэргических соединений в большинстве случаев зависит от энергии, поставляемой АТФ.
Не следует путать величину свободной энергии гидролиза фосфоангидридной связи, которая используется при описании биохимических процессов, с энергией связи, под которой понимается энергия, необходимая для ее разрыва. При гидролизе фосфоангидридной связи в физиологических условиях наряду с освобождением энергии протекают дополнительные процессы, связанные с образованием новых соединений (например, неорганических фосфатов), сольватацией продуктов и т.д.
| Таблица 2. Свободная энергия гидролиза некоторых «высокоэнергетических» и «низкоэнергетических» соединений в стандартных (ΔG 0 ) и физиологических (ΔGф) условиях среды (кДж/моль) | |||
| Соединение | Продукты гидролиза | –ΔG 0 | –ΔGф |
| «Высокоэнергетические» соединения | |||
| Фосфоенолпируват | Пируват + Н3РО4 | 61,7 | 66,7 |
| 1,3-Дифосфоглицерат | 3-Фосфоглицерат + Н3РО4 | 49,2 | 41,7 |
| Креатинфосфат | Креатин + Н3РО4 | 42,5 | – |
| АТФ | АДФ + Н3РО3 | 30,4 | 50,0 |
| Ацетил-КоА | Ацетат + НS–КоА | 30,4 | – |
| АДФ | АМФ + Н3РО4 | 28,3 | 50,0 |
| Н4Р2О7 | 2Н3РО4 | 28,3 | 50,0 |
| Глюкозо-1-фосфат | Глюкоза + Н3РО4 | 20,8 | – |
| «Низкоэнергетические» соединения | |||
| Фруктозо-6-фосфат | Фруктоза + Н3РО4 | 15,8 | – |
| АМФ | Аденозин + Н3РО4 | 14,1 | – |
| Глюкозо-6-фосфат | Глюкоза + Н3РО4 | 13,8 | 23,8 |
| α-Глицеролфосфат | Глицерин + Н3РО4 | 9,2 | – |
В табл. 2 приведены энергетические характеристики гидролиза некоторых биофосфатов. Следует отметить, что АТФ находится лишь в середине энергетической шкалы, однако сравнительно высокая термодинамическая неустойчивость позволяет этой молекуле выполнять функции ключевого энергетического посредника в обмене веществ. Большая энергоемкость и термодинамическая неустойчивость фосфоангидридных связей в АТФ по сравнению с другими биофосфатами объясняются особенностями ее химического строения.
Существует несколько вариантов освобождения энергии при гидролизе фосфоангидридных связей АТФ (выделенные жирным шрифтом соединения являются «высокоэнергетическими», остальные – «низкоэнергетическими»):
- АТФ + Н2О —>АДФ + Н3РО4;
- АТФ + Н2О —> АМФ + Н4Р2О7;
- Н4Р2О7 + Н2О —> 2Н3РО4;
- АДФ + Н2О —> АМФ + Н3РО4.
Наиболее часто встречается вариант 1 – отщепление от АТФ концевого фосфата, который затем гидратируется полярными молекулами воды или участвует в фосфорилировании другого соединения. Другой путь (вариант 2) – дифосфатное расщепление АТФ – используется в биохимических процессах реже.
Также редко встречаются процессы, протекающие за счет гидролиза дифосфата (вариант 3), так как при этом освобождается только тепловая энергия. Пока еще не известны биохимические реакции, в которых используется энергия гидролиза АДФ (вариант 4), хотя данный процесс по количеству высвобождаемой энергии соизмерим с реакцией 1. Известно лишь, что гидролиз АДФ до АМФ и фосфата сопровождается выделением тепловой энергии. Обращает на себя внимание тот факт, что изменение свободной энергии в процессе гидролиза фосфатной связи АТФ, АДФ и дифосфата в физиологических условиях превышает значения ΔG 0 для аналогичных процессов в стандартных условиях. Для других соединений наблюдаются меньшие различия и не обязательно в сторону увеличения изменения свободной энергии.
Таким образом, аккумуляторами и источниками энергии в биосистемах являются ангидриды фосфорной кислоты, в результате сопряжения реакций гидролиза которых с эндергоническими процессами обеспечивается протекание анаболических процессов в живой природе.
Использование энергии живыми организмами
Энергия, получаемая организмом в процессе метаболизма, идет на совершение им биологической работы. Это может быть световая, электрическая, механическая, химическая и другие формы энергии. При этом значительное количество полученной энергии расходуется организмом в форме тепла.
- Механическая энергия — форма энергии, характеризующая движение макротел и способность совершать механическую работу по перемещению макротел. Механическая энергия разделяется на кинетическую, определяемую скорость движения тел, и потенциальную, определяемую расположением макротел друг относительно друга.
- Электрическая энергия — энергия взаимодействия электрически заряженных частиц, вызывающая движение этих частиц в электрическом поле.
- Осмотическая энергия — энергия для передвижении молекул против градиента концентраций.
- Регуляторная энергия —
- Химическая энергия — энергия взаимодействия атомов в молекуле. По существу, всякая химическая энергия — это энергия электронов, движущихся по внешним орбитам атомов и молекул.
При преобразовании энергии и осуществлении биологических функций энергия в конце концов рассеивается в окружающую среду в бесполезной для организма форме — в форме тепла.
- Тепловая энергия — энергия хаотического теплового движения всех атомов и молекул вещества. Показателем теплового движения частиц является температура. Средняя кинетическая энергия Еh одноатомной частицы вещества связана с абсолютной температурой Т следующим образом: Еh=3/2rT, (1) где r = 1,380 · 10 -16 эрг/град — постоянная Больцмана.
Тепловая энергия, образно говоря, является самым обесцененным видом энергии, так как определяется хаотическим движением частиц. Все остальные виды энергии определяются более упорядоченным видом движения частиц.
Фазы освобождения энергии из питательных веществ
В ходе извлечения энергии из различных субстратов можно условно выделить три фазы.
- Первая фаза — подготовительная. Она необходима для перевода биополимеров, поступающих с пищей или находящихся внутри клетки, в удобную для извлечения энергии форму — мономеры. Осуществляется эта фаза с помощью гидролаз в кишечнике или внутри клетки. Внутри клетки гидролиз происхоит с участием ферментов цитоплазмы и лизосом. Энергетической ценности эта фаза не представляет, так как освобождается лишь до 1 % энергии субстратов, но и она рассеивается в форме теплоты.
- Вторая фаза — частичный распад мономеров до ключевых промежуточных продуктов, главным образом до ацетил-КоА и нескольких кислот цикла Кребса — оксалоацетата, 2-оксоглутарата. Во второй фазе большое число исходных субстратов сокращается до трех. Для нее характерно частичное (до 20%) освобождение энергии, заключенной в исходных субстратах, происходящее в анаэробных (бескислородных) условиях. Часть этой энергии аккумулируется в фосфатных связях АТФ, а часть рассеивается в виде теплоты. Превращение мономеров протекает в гиалоплазме, а заключительные реакции — в митохондриях.
- Третья фаза — окончательный распад веществ до СO2 и Н2O с участием кислорода. Эта фаза — аэробного биологического окисления веществ протекает с полным освобождением энергии. Особенность превращения веществ на этом этапе состоит в том, что из трех метаболитов предыдущей фазы, после так называемого цикла Кребса, остается только водород, связанный с переносчиками (НАД или ФАД). Водород — универсальное энергетическое топливо, которое используется в дыхательной цепи для образования АТФ и воды. Примерно 80% всей энергии химических связей веществ освобождается в данной фазе. Эта энергия окисления субстратов сосредоточивается в фосфатных связях АТФ и часть ее выделяется в виде теплоты. Все реакции этой фазы локализуются в митохондриях.
Освобождение энергии в живой клетке осуществляется постепенно, благодаря этому на различных этапах ее выделения она может аккумулироваться в удобной для клетки химической форме, в виде АТФ. Весь энергетический аппарат клетки устроен как бы из трех блоков, имеющих разное функциональное назначение (т. е. осуществляющих три группы процессов):
блок I-процессы образования субстратов окисления —>S·H2—>блок Н-процессы генерации водорода—>КН2
Здесь SH2 — субстрат окисления; КН2 — водород, связанный с коферментом. Задача ферментативных процессов первого блока — образование необходимых субстратов окисления, соответствующих имеющемуся в клетке окислительному ферменту. Одновременно происходит частичная аккумуляция энергии расщепляемых субстратов в фосфатных связях АТФ. Дальнейшие превращения субстратов связаны с процессами биологического окисления.
Биологическое окисление
Реакции биологического окисления катализируются ферментами. Окисление может быть связано:
- с отщеплением водорода от окисляемого субстрата (дегидрирование);
- с потерей электрона;
- с присоединением кислорода.
Все три типа реакций равнозначны и имеют место в живой клетке.
Процесс окисления не протекает изолированно, он сопряжен с реакцией восстановления, т. е. с присоединением водорода или электрона. Оба вещества — окисляемое и восстанавливаемое, образуют окислительно-восстановительную пару, или редокс-пару.
Окислительную или восстановительную способность разных соединений характеризует их сродство к электрону. Чем легче субстрат отдает электроны, тем сильнее его восстанавливающая способность. Наоборот, высокое сродство к электрону характеризует их окисляющую способность. Способность любой окислительно-восстановительной пары к реакциям восстановления характеризуется стандартным окислительно-восстановительным потенциалом, или редокс-потенциалом. Он выражается значением электродвижущей силы (в вольтах), возникающей в полуэлементе, в котором окислитель и восстановитель присутствуют в концентрации 1,0 моль/л при 25°С и pH 7,0 и находятся в равновесии с электродом, который может обратимо принимать электроны от восстановителя. Стандартный редокс-потенциал отражает восстанавливающую активность редокс-пары и обозначается знаком Е0. В качестве нулевого стандарта принят редокс-потенциал газообразного водорода при давления 101,3 кПа (1 атм), концентрации ионов Н + в растворе 1,0 моль/л, т. е. при рН0, температуре 25°С. Стандартный редокс-потенциал этой окислительно-восстановительной пары согласно уравнению Н2 ↔ 2Н + + 2е — условно принят за нуль. При физиологическом значении pH 7,0, при котором измеряются стандартные редокс-потенциалы всех окислительно-восстановительных пар, редокс-потенциал системы Н2/2Н + + 2е — равен -0,42 В. Отрицательное значение его указывает на выраженные восстановительные свойства. Чем более отрицателен редокс-потенциал, (тем сильнее выражена способность данной редокс-пары отдавать электроны, т. е. играть роль восстановителя. Напротив, чем более положителен редокс-потенциал, тем более выражена способность данной редокс-пары принимать электроны, т. е. играть роль окислителя. Например, редокс-потенциал пары НАД • Н + Н + /НАД + равен — 0,32 В, что говорит о высокой способности ее отдавать электроны, а редокс-потенциал пары 1/2O2/H2O имеет большую положительную величину +0,81 В, поэтому у кислорода наивысшая способность принимать электроны.
Значения редокс-потенциалов позволяют предсказать направление потока электронов при биологическом окислении и рассчитать изменение энергии при переносе электронов от одной редокс-пары к другой.
Субстраты окисления, как уже указывалось, образуются в ходе катаболизма белков, углеводов и липидов. Эти субстраты подвергаются дегидрированию как наиболее распространенному типу биологического окисления, происходящего с участием находящихся в клетке дегидрогеназ. Если акцептором водорода в реакциях дегидрирования служит не кислород, а другой субстрат, то такие реакции называют анаэробным окислением; если же акцептором водорода является кислород и образуется вода, то такие реакции биологического окисления называют тканевым дыханием.
Анаэробное окисление есть не что иное, как процесс генерации водорода (второй блок в приведенной выше схеме энергетического аппарата клетки). В этих реакциях участвуют никотинамидзависимые дегидрогеназы, где акцептором отщепляемого от органического субстрата водорода служат НАД + и НАДФ + , и флавинзависимые дегидрогеназы, где акцептором водорода служат ФМН и ФАД. Субстраты дегидрирования образуются вне митохондрий, но затем транспортируются внутрь митохондрий, где совершаются окислительные превращения веществ.
Источник