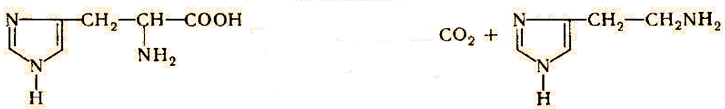КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ И ЕЕ ТИПЫ



Ковалентная модификация ферментов – тип регуляции ферментативной активности под действием других ферментов, осуществляющийся за счет присоединения к белковой молекуле небольших химических групп, что вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Является быстрым механизмом регуляции активности ферментов внешними сигналами. Ковалентная модификация является основным механизмом при рецептор-зависимом ответе клеток на внешние воздействия, тогда как аллостерические эффекторы изменяют активность ферментов в ответ на изменение внутриклеточных условий.
Фосфорилирование – наиболее распространенный тип ковалентной модификации, является АТФ-зависимым процессом и осуществляется с помощью ферментов протеинкиназ. В большинстве случаев фосфорилированная форма фермента более активна, чем нефосфорилированная. Фосфорилирование модифицирует белки добавлением отрицательно заряженных остатков фосфорной кислоты к гидроксильным группам остатков серина, треонина и, реже, тирозина.
Рис. 4.3.1. Фосфорилирование/дефосфорилирование.
Возвращение фермента в исходное состояние осуществляется ферментами протеинфосфатазами, которые отщепляют неорганический фосфат от молекулы белка.
В некоторых случаях фосфорилирующие и дефосфорилирующие белки сами являются модифицируемыми ферментами. Активность протеинкиназ и протеинфосфатаз находится под гормональным контролем и регулируется нервной системой.
К ковалентной модификации ферментов помимо фосфорилирования относятся также аденилирование, уридилирование, ацетилирование, АДФ-рибозилирование.
Ковалентную модификацию аденилированием и уридилированием можно рассмотреть на примере регуляции активности фермента глутаминсинтетазы. Глутаминсинтетаза выполняет одну из ключевых функций в обмене азота у бактерий E. Coli. При выращивании Е. coli на среде, в которой источником азота служит не NH4 + , а другие соединения, в клетках наблюдается высокий уровень глутаминсинтетазной активности. Добавление в ростовую среду солей NH4 + вызывает быстрое (в течение минуты) десятикратное снижение активности фермента, которое нельзя объяснить подавлением его синтеза. Попытки объяснить данное явление привели к открытию фермента, катализирующего инактивацию глутаминсинтетазы in vitro в присутствии АТФ, Mg 2+ и глутамина. Далее было установлено, что разные формы фермента содержат различные количества ковалентно связанной АМФ. Далее было установлено, что инактивирующий белок является аденилилтрансферазой, катализирующей ковалентное присоединение АМФ к определенной тирозильной группе в каждой из 12 субъединиц глутаминсинтетазы. Однако полное превращение происходит только в экстремальных условиях, например когда клетки, выращенные в условиях недостатка NH4 + , попадают в среду, богатую этим соединением. Обычно глутаминсинтетаза находится в промежуточных состояниях аденилирования, в которых аденилированными являются лишь некоторые из 12 субъединиц.
Активность отдельной субъединицы в составе олигомера зависит от состояния соседних субъединиц (аденилированы они или не аденилированы), вероятно, из-за аллостерического влияния, которое передается через межсубъединичные контакты.
При переносе Е. coli из среды, богатой NH4 + , в бедную этим соединением среду происходит быстрая реактивация глутаминсинтетазы, что указывает на обратимость процесса аденилирования. Было установлено, что активность аденилилтрансферазой регулируется с помощью уридилирования и деуридилирования. Уридилирование происходит в результате катализируемого специфичной уридилилтрансферазой ковалентного присоединения УМФ к одному или двум тирозильмым остаткам каждой субъединицы аденилилтрансферазы. Деуридилирование катализируется уридилил-отщепляющим ферментом. Уридилирующий и деуридилирующий ферменты образованы одним полипептидом, который, подобно аденилилтрансферазе, проявляет бифункциональные свойства.
Примером ковалентной модификации белков с помощью ацетилирования является модификация гистонов. Ацетилирование гистонов играет важную роль в модуляции структуры хроматина при активации транскрипции, увеличивая доступность хроматина для транскрипционного аппарата. Гистоны целенаправленно модифицируются на тех промоторах, которые требуется активировать. Ацетилированию и деацетилированию подвергаются определенные остатки лизина, что осуществляется с помощью ферментов ацетилтрансфераз и деацетилаз. Предполагается, что ацетилированные гистоны менее прочно связаны с ДНК и поэтому ацетилирование может облегчать доступ и связывание факторов транскрипции с их элементами узнавания на ДНК. Ацетилирование остатков лизина в N-концевых «хвостиках» гистонов H2A, H2B, H3 и H4 нейтрализует их положительный заряд и соответственно блокирует ассоциацию с витками нуклеосомной ДНК. Это, в свою очередь, декомпактизует структуру как самой нуклеосомы, так и хроматина в целом и освобождает внешнюю поверхность витков ДНК для взаимодействий с регуляторными факторами.

Еще одним способом химической модификации ферментов с помощью присоединения небольших химических групп является АДФ-рибозилирование. АДФ-рибоза может вызывать неэнзиматическое АДФ-рибозилирование ряда белков. К ним относятсябелки регулирующие репарацию ДНК, белки-регуляторы трансляции и агрегации тромбоцитов. Моно-АДФ-рибозилирование – посттрансляционный процесс модификации белков, ответственный за токсический эффект некоторых бактериальных токсинов. Действие коклюшного или холерного токсинов вызывает моно-АДФ-рибозилирование белков плазматической мембраны и может изменять работу сигнальных систем или активность мембранного транспорта в результате нарушения функционирования G-белков. Схематически действие холерного токсина можно описать следующим образом (Рис. 4.3.2). В норме ГТФ, связанный с Gsα быстро гидролизуется (синяя стрелочка), так, что активация аденилатциклазы и увеличение цАМФ происходит столь долго, сколько гормон связан с рецептором. В присутствии холерного токсина Gsα необратимо модифицируется АДФ- рибозилированием, так, что она может связывать ГТФ, но не может его гидролизовать (красные стрелочки). В результате постоянной активации происходит нерегулируемый рост уровня цАМФ.
Рис. 4.3.2. Механизм действия холерного токсина
При нормальных условиях АДФ-рибозилированию могут подвергаться актин, десмин, интегрин-α-7.
Рис. 4.3.3. АДФ-рибоза
Аденилатциклаза
Аденилатциклаза (АТФ -пирофосфатлиаза циклизирующая) фермент, класса лиаз, катализирует гидролиз АТФ с образованием цАМФ и пирофосфата.
Рис. 4.3.4. структура цАМФ
Аденилатциклаза обнаружена практически во всех тканях животных, а также у бактерий. В клетках животных он локализован в плазматических мембранах, у бактерий – в мембранах и цитоплазме. Наиболее существенная роль цАМФ состоит в активации цАМФ – зависимых протеинкиназ (протеинкиназы А).
Рис. 4.3.5. Первичная структура аденилатциклазы
Рис. 4.3.6. Расположение аденилатциклазы в мембране
Фосфолипаза С
Фосфолипаза С является ключевым ферментом фосфоинозитидной мессенджерной системы. Многочисленные внеклеточные сигнальные молекулы (гормоны, нейромедиаторы, факторы роста, иммуноглобулины, антигены и др.), при взаимодействии со своими рецепторами вызывают активацию фосфолипазы С (ФЛC). При взаимодействии лиганда с рецептором активурующий ФЛC сигнал может передаваться специальным G-белком (Gq). Активированная ФЛC катализирует расщепление мембранного фосфолипида фосфатидилинозитол-4,5-дифосфата (ФИФ2) на инозитолтрифосфат (ИФ3) и диацилглицерол (ДАГ). Диацилглицерол связывается и стимулирует протеинкиназу С (ПKC), ИФ3 взаимодействует с активируемым им Са 2+ каналом (ИФ3 рецептором), в результате чего происходит выход ионов кальция из эндоплазматического ретикулума, которые участвуют в активации Са 2+ — кальмодулин-зависимых протеинкиназ, протеинкиназы С и многочисленных кальций-чувствительных белков. Таким образом, в отличие от других ферментов, катализирующих образование вторичных мессенджеров, ФЛС использует компоненты самой мембраны.
Рис. 4.3.7. Действие фосфолипазы С на фосфатидилинозитол-4,5-дифосфат
Протеинкиназы, типы
Протеинкиназами называют ферменты, катализирующие перенос фосфата от АТФ к специфическому аминокислотному остатку (серину, треонину, тирозину и т.д.). Протеинкиназы эукариот представляют собой суперсемейство гомологичных белков. Важнейшими представителями этого семейства являются серин-треониновые протеинкиназы и тирозиновые протеинкиназы.
Источник
2.2. Химическая модификация фермента
Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Протекает при участии протеинкиназ по ОН-группам серина и треонина, а в ряде случаев – тирозина. Активным ферментом может быть или фосфорилированная или дефосфорилированная форма.
Регуляция активности путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Например, фермент протеинкиназа в неактивной форме построена как тетрамер. Для активации протеинкиназы необходима диссоциация субъединиц.
Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются неактивными и лишь после секреции из клетки переходят в активную форму путем удаления части белковой молекулы. Так происходит активация протеолитических ферментов.
2.3. Аллостерическая регуляция
Во многих случаях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Конечный продукт подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Он связывается с аллостерическим центром молекулы фермента. Это ингибирование по принципу обратной связи, или ретроингибирование.
2.6. Классификация и номенклатура ферментов
Современные классификация и номенклатура ферментов разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в Москве.
В основу классификации легли 3 принципа:
1. Химическая природа фермента.
2. Химическая природа субстрата, на который действует фермент.
3. Тип катализируемой реакции.
Ферменты делят на шесть классов.
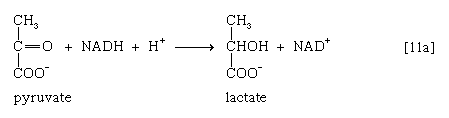
1. Оксидоредуктазы — ферменты, катализирующие реакции окисления—восстановления:
— аэробные дегидрогеназы, или оксидазы, катализируют перенос протонов (электронов) непосредственно на кислород;
— анаэробные дегидрогеназы ускоряют перенос протонов (электронов) на промежуточный субстрат, но не на кислород.
Наиболее распространены оксидоредуктазы, содержащие в качестве активной группы никотинамидадениндинуклеотид, или НАД + . Кроме НАД + пиридинферменты содержат в качестве кофермента никотинамидадениндинуклеотидфосфат (НАДФ + ). Коферментами оксидоредуктаз являются также флавопротеины (ФП) — флавинмононуклеотид, ФМН, и флавинадениндинуклеотид, ФАД.
2. Трансферазы — ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
Фосфотрансферазы- перенос остатка фосфорной кислоты. Фосфорные эфиры органических соединений обладают повышенной химической активностью. Донором фосфатных остатков в большинстве случаев является АТФ.
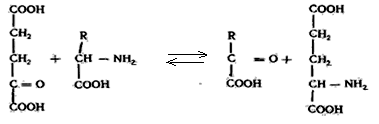
Аминотрансферазы ускоряют реакцию переноса аминогруппы от аминокислоты на a-кетокислоту.
Протеинкиназы ускоряют перенос остатка фосфата с АТФ на белки, изменяя их биологическую активность.
Гликозилтрансферазы ускоряют реакции переноса гликозильных остатков.
Ацилтрансферазы катализируют перенос ацилов (остатков карбоновых кислот).
3. Гидролазы катализируют расщепление внутримолекулярных связей органических веществ при участии молекулы воды.
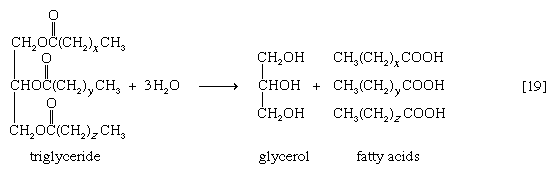
Эстеразы катализируют гидролиз сложных эфиров спиртов с органическими и неорганическими кислотами. Например, липаза ускоряет гидролиз триацилглицеринов (жиров):
Фосфатазы катализируют гидролиз фосфорных эфиров:
Гликозидазы катализируют гидролиз гликозидов. Из гликозидаз, действующих на полисахариды, наиболее известны амилазы.
Пептидгидролазы ускоряют гидролиз пептидных связей в белках и пептидах.
4. Лиазы — ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов негидролитическим путем. Эти реакции сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т. д..
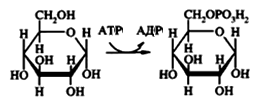
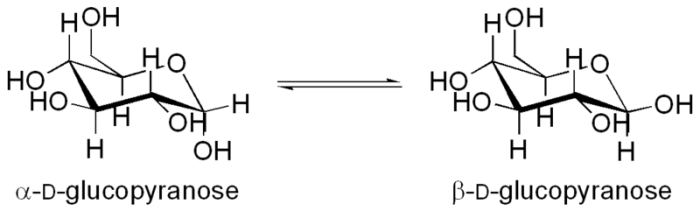
5. Изомеразы — ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров. Мутаротаза ускоряет реакцию превращения α-D-глюкопиранозы в β-D-глюкопиранозу:
6. Лигазы (синтетазы) — ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ либо других веществ.
Одной из важнейших карбоксилаз является пируваткарбоксилаза:
Международная комиссия подготовила Классификацию ферментов (КФ). Код каждого фермента содержит четыре цифры, разделенные точками. Первая цифра указывает номер класса, вторая означает подкласс и характеризует вид субстрата. Например, у трансфераз указывает на природу переносимой группы, у гидролаз — на тип гидролизуемой связи. 3 цифра – уточняет природу участвующих в реакции соединений или групп. Четвертая цифра – номер фермента в данном подподклассе.
Пепсин – пептид-пептидогидролаза; КФ 3.4.4.1.
Источник