- 29. Формы обмена генетическим материалом у бактерий
- 30. Что такое конъюгация, мех-м
- 31. Что такое трансдукция, м-м
- 32. Что такое плазмиды их биологические особенности
- 33. Основные классы плазмид.
- 34. Бактериофаги. Их химический состав и морфология.
- Способы генетического обмена у бактерий генетический анализ при конъюгации
- Конъюгация бактерий. F-фактор бактерии.
- Способы генетического обмена у бактерий генетический анализ при конъюгации
29. Формы обмена генетическим материалом у бактерий
1.Конъюгация — обмен хромосомными и плазмидными генами путем установления контакта между донорной и реципиентной клетками с помощью донорных ворсинок.
Механизм конъюгации контролируется конъюгативными (донорными) плазмидами.
2.Трансдукция — перенос генов от донорной клетки в реципиентную с помощью фагов.
3.Сексдукция — перенос генов от донорной клетки в реципиентную с помощью F-фактора (полового фактора).
4.Трансформация — поглощение компетентными клетками внеклеточной ДНК.
5.Трансфекция — поглощение протопластами свободной фаговой ДНК.
30. Что такое конъюгация, мех-м
1.Конъюгация — обмен хромосомными и плазмидными генами путем установления контакта между донорной и реципиентной клетками с помощью донорных ворсинок.
Для успешного установления контакта двух клеток в клетке-доноре должна присутствовать конъюгативная (половая, трансмиссивная) плазмида. F-плазмида
31. Что такое трансдукция, м-м
Трансдукция (от лат.transductio — перемещение) — процесс переносабактериальнойДНКиз одной клетки в другуюбактериофагом. Общая трансдукция используется в генетике бактерий длякартирования геномаи конструированияштаммов. К трансдукции способны как умеренные фаги, так и вирулентные, последние, однако, уничтожают популяцию бактерий, поэтому трансдукция с их помощью не имеет большого значения ни в природе, ни при проведении исследований.
Неспецифическая- случайный перенос фрагментов ДНК от одной бактерии к другой
Спец-я – осущ. Только фагами, облад способностью включаться в строго опред участки хромосомы бактер кл-ки и трансдуцировать опр гены
32. Что такое плазмиды их биологические особенности
Плазмиды- наипростейшие живые существа, лишенные белковой оболочки и представленные только совокупностью организованных генов, определяющих их специфические свойства, наследственность, а также дополнительные признаки, которыми они наделяют клетку носителя.
Плазмиды подразделяются на конъюгативные , т.е. способные к самопереносу, и неконъюгативные, перенос которых осуществляется конъюгативными плазмидами. Передача плазмид среди бактерий происходит как по вертикали, так и по горизонтали, обеспечивая их эпидемическое распространение.
33. Основные классы плазмид.
F-плазмиды Донорные функции
R-плазмиды Устойчивость к лекарственным препаратам
Col-плазмиды Синтез колицинов
Ent-плазмиды Синтез энтеротоксинов и факторов адгезии
Hly-плазмиды Синтез гемолизинов
Биодегративные плазмиды Разрушение различных органических соединений
34. Бактериофаги. Их химический состав и морфология.
Бактериофаги (от бактерии и греч. phagos — пожиратель; буквально — пожиратели бактерий), фаги, бактериальные вирусы, вызывающие разрушение (лизис) бактерий и других микроорганизмов. Б. размножаются в клетках, лизируют их и переходят в др., как правило, молодые, растущие клетки.
Строение и химический состав.
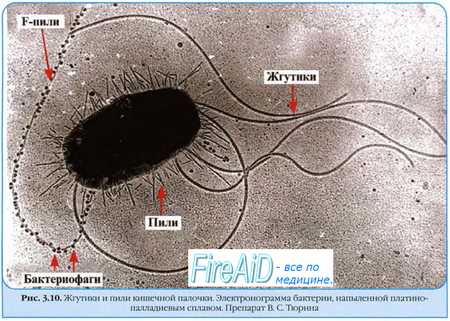
Б. состоят из головки округлой, гексагональной или палочковидной формы диаметром 45—140 нм и отростка толщиной 10—40 и длиной 100—200 нм (рис.). Другие Б. не имеют отростка; одни из них округлы, другие — нитевидны, размером 8х800 нм. Содержимое головки состоит преимущественно из дезоксирибону клейновой кислоты (ДНК) (длина её нити во много раз превышает размер головки и достигает 60—70 мкм, эта нить плотно скручена в головке) или рибонуклеиновой кислоты (РНК) и небольшого количества (около 3%) белка и некоторых других веществ. Отросток имеет вид полой трубки, окруженной чехлом, содержащим сократительные белки, подобные мышечным. У ряда Б. чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих Б. имеется базальная пластинка с несколькими шиловидными или другие формы выступами. От пластинки отходят тонкие длинные нити, которые способствуют прикреплению фага к бактерии. Оболочки головки и отростка состоят из белков. Общее количество белка в частице фага 50—60% , нуклеиновых кислот — 40—50% . Каждый Б. обладает специфическими антигенными свойствами, отличными от антигенов бактерии-хозяина и других фагов. Имеются антигены, общие для ряда фагов (особенно содержащих РНК). Б. делят на вирулентные, вызывающие лизис клетки с образованием новых частиц, и умеренные (симбиотические), которые адсорбируются клеткой и проникают в неё, но лизиса не вызывают, а остаются в клетке в латентной (скрытой) неинфекционной форме (профаг). Культуры, содержащие латентный фаг, называются лизогенными. Лизогения передаётся потомству бактерии. Лизогенная культура может содержать 2—3 и более фагов; она, как правило, устойчива против находящихся в ней фагов (лишь небольшая часть клеток лизируется и освобождает зрелые фаги). Воздействуя на лизогенную культуру ультрафиолетовыми или рентгеновскими лучами, перекисью водорода и некоторыми другими веществами, можно значительно увеличить количество клеток, освобождающих фаг (т. н. индукция Б.). Лизогения широко распространена среди всех видов бактерий и актиномицетов. В ряде случаев многие свойства лизогенной культуры (токсичность, подвижность бактерий и др.) зависят от наличия в ней определённых профагов. Описано много мутаций Б., сопровождающихся изменением их литической активности, строения частиц и «колоний», устойчивости против неблагоприятных воздействий и другие свойств. Б. играют большую роль в изменчивости и эволюции микробов, причём механизмы воздействия их на клетку разные Б. могут резко изменять азотфиксирующую способность азотобактера, токсичность и антигенные свойства патогенных бактерий и др.
Источник
Способы генетического обмена у бактерий генетический анализ при конъюгации
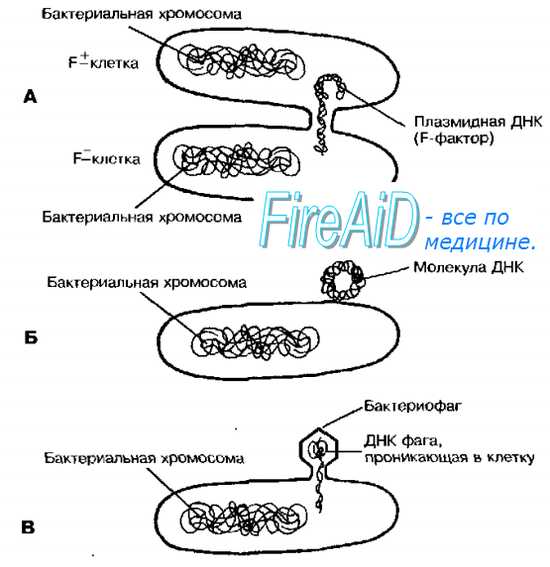
Длительное время считали, что бактерии — изолированные генетические системы, и каждая особь имеет одного (и только одного) родителя, то есть их изменчивость вызвана лишь мутациями. Никто не мог себе представить, что, подобно гаметам высших организмов, бактерии способны обмениваться генетическим материалом и, по аналогии с половым размножением, давать начало потомству с новыми свойствами. Однако Лёдерберг и Тёйтем (1946), высевая на минеральную среду, предварительно смешав два типа мутантов Escherichia coli (один нуждался в биотине и метионине, другой — в треонине и лейцине), показали, что у бактерий генетические рекомбинанты со способностью к синтезу всех четырёх факторов роста возникают с частотой 10″6, хотя теоретическая вероятность реверсии по двум генам составляет 10-14-10-16 на генерацию. Это противоречие было снято установлением факта прямой передачи генетического материала от донорной клетки к реципиентной (конъюгация). Помимо конъюгации, передача генетического материала у бактерий может осуществляться также с помощью трансформации и трансдукции (рис. 4-16).
Конъюгация бактерий. F-фактор бактерии.
Конъюгация — прямой перенос фрагмента ДНК от донорских бактериальных клеток к реципиентным при непосредственном контакте этих клеток. Биологическая значимость этого процесса стала проясняться после внедрения в медицинскую практику антибиотиков. Устойчивость к антибиотикам можно получить в результате мутации, что происходит один раз на каждые 106 клеточных делений. Однако, однажды изменившись, генетическая информация может быстро распространяться среди сходных бактерий благодаря конъюгации, поскольку каждая третья из близкородственных бактерий способна именно к этому типу генетического переноса. Для реализации процесса необходим F-фактор — плазмида, кодирующая информацию, необходимую для конъюгации.
Конъюгация требует наличия двух типов клеток: доноров (F + ), обладающих F-фактором, и реципиентов (F — ), не обладающих им. При скрещивании клеток F — и F + фактор фертильности передаётся с частотой, близкой к 100%.
Фактор переноса содержит гены специальных и необходимых при конъюгации структур — F-пилей и ряд других генов, вовлечённых в процесс взаимодействия с F — -клетками.
Первый этап конъюгации — прикрепление клетки-донора к реципиенту с помощью F-пилей. Затем между клетками формируется конъюгационный мостик, через который передаётся F-фактор, а также и другие плазмиды, автономно пребывающие в цитоплазме донора. При попадании F-фактора в реципиентную клетку она становится F+ и приобретает способность передавать фактор фертильности другим F — -клеткам. Подобный механизм обеспечивает приобретение популяционно. устойчивости к антибактериальным агентам.
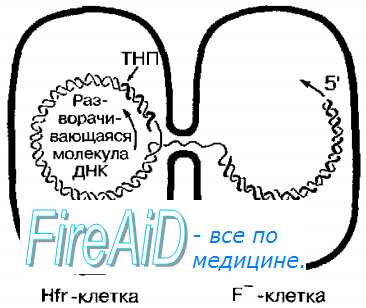
В популяции клеток, содержащих F-плазмиду, только те, в которых она интегрирована в бактериальную хромосому (Hft + -клетки), способны быть донорами хромосомной ДНК. При перенос генетического материала бактериальная ДНК реплицируется, начиная от места включения F-фактора, одна цепь ДНК переносится в реципиентную F’-клетку двигаясь 5′-концом вперёд тогда как другая остаётся в Hfr + -клетке, то есть донор сохраняет своё генетическое постоянство. После начала конъюгации хромосомный материал переносится, начиная от генов, близких к начальной точке транспорта (рис. 4-17).
В бактерии-реципиенты обычно попадают первые из переносимых генов, размер которых зависит от времени, в течение которого проходила конъюгация, и очень редко — все гены. Позже всех переносится участок плазмиды, содержащий ген переноса кодирующий F-пили. Поскольку полная трансмиссия — явление редкое, реципиентная клетка при Hfr-конъюгации обычно остаётся F-. Вслед за процессом переноса в клетке-реципиенте происходит гомологичная рекомбинация между донорской ДНК и собственной ДНК реципиента.
Процесс конъюгации может происходить только при соблюдении ряда условий.
• На поверхности реципиентных бактерий должны быть рецепторы пилей, имеющие существенное сродство ( к F-пилям, что позволяет образовать стабильную связь между пилями и рецепторами.
• Для эффективной конъюгации у F-фактора должна быть точка начала репликации, распознаваемая репликативными системами хозяина.
• Эффективность Hfr-конъюгации зависит от величины гомологии ДНК. Перенос негомологичного хромосомного материала донора не приведёт к его интеграции с ДНК реципиента.
Источник
Способы генетического обмена у бактерий генетический анализ при конъюгации
Микроорганизмы рода Lactobacillus широко распространены в природе, а некоторые виды являются важнейшими представителями микробиоты организма человека [1]. Лактобациллы длительное время привлекают внимание ученых – биохимиков, микробиологов, медиков, экологов, ввиду их потенциального значения для поддержания гомеостаза системы «человек-окружающая среда», сохранения здоровья населения, профилактики и лечения многих заболеваний различной этиологии. Актуальным вопросом является получение новых знаний о биологических свойствах и молекулярно-генетической структуре лактобацилл; создание новых пробиотических препаратов на их основе с помощью разных методических подходов к культивированию [2].
Главным конечным продуктом метаболизма лактобацилл является D- и L-молочная кислота. У гомоферментативных лактобацилл лактат составляет 90 % всех продуктов брожения. У представителей гетероферментативных видов в качестве конечных продуктов также образуется молочная кислота и углекислый газ [3]. Благодаря продукции органических кислот, перекисей и бактериоцинов многие штаммы лактобацилл проявляют выраженную антагонистическую активность в отношении патогенных микроорганизмов [4]. Биохимические и морфологические свойства лактобацилл являются в настоящее время основным и единственным критерием межродовой и видовой идентификации этих микроорганизмов. Однако при идентификации лактобацилл только с использованием стандартных микробиологических тестов могут возникнуть трудности. Так, например, идентификация близкородственных видов на основании физиолого-биохимических свойств затруднена вследствие общности свойств [5]. Идентификация молочнокислых бактерий только на основании морфологических, культуральных, физиолого-биохимических признаков в настоящее время является недостаточной, поскольку под воздействием различных факторов многие виды обладают высоким уровнем фенотипической изменчивости [6]. Молекулярно-генетические методы идентификации зарекомендовали себя как надежные и независящие от внешних факторов [7]. Целью настоящей работы являлась идентификация генетически близких видов лактобацилл, выделенных из желудочного кишечного тракта здоровых людей, с использованием анализа нуклеотидной последовательности гена 16S rRNA.
Материалы и методы исследования
Штаммы бактерий и методы культивирования. Объектами исследования являлись молочнокислые бактерии рода Lactobacillus, зарегистрированные в коллекции промышленных микроорганизмов «Института микробиологии и вирусологии» и по паспортным данным принадлежащих к Lactobacillus plantarum №22 и Lactobacillus cellobiosus №20. Культуры выращивали на среде MRS (Hi-Media, India), в течение 2-х суток при 35°С.
Определение и анализ нуклеотидных последовательностей генов 16SrRNA. Геномную ДНК выделяли методом Kate Wilson [11]. Концентрацию ДНК измеряли спектрофотометрическим методом с использованием спектрофотометра Nano Drop 1000 при длине волны 260 нм, а также проводили качественную оценку ДНК электрофоретическим методом.
Матрицы для секвенирования синтезировали с помощью ПЦР, используя универсальные праймеры 8f-5’–AgAgTTTgATCCTggCTCAg-3 и 806R-5’- ggACTACCAgggTATCTAAT-3 [12], что позволяло амплифицировать ген 16S rRNA почти полностью. Реакционная смесь (30 мкл) содержала 3 мкл 10х реакционного буфера (Fermentas), 2,5 мM MgCl2, 0,2 мM каждого дезоксирибонуклеозидтрифосфата (дНТФ), по 10 пмоль каждого из праймеров, 1единицу Taq –полимеразы Maxima Hot Start Taq DNA Polymerase (Fermentas) и 150 нг геномной ДНК в качестве матрицы.
ПЦР проводили в термоциклере Mastercycler pro S (Eppendorf). Реакцию начинали инкубированием смеси при 95 °С в течение 7 минут, затем следовало 30 циклов, состоящих из инкубаций: 95 °С – 30 секунд, 55 °С – 40 секунд , 72 °С – 1 мин. Завершающую элонгацию проводили при 72 °С в течение 10 минут.
Продукты амплификации разделяли в 1,5 % агарозном геле. Гели окрашивали этидиум бромидом. Электрофорез проводили в камере для горизонтального электрофореза Bio-RAD Basic, и источником тока «Consort EV-243». В качестве электродного буфера использовали 1хТАЕ-буфер. Документирование полученных результатов проводили, используя систему документаций гелей Gel Doc. Размеры молекул анализируемых образцов ДНК определяли путем сопоставления их электрофоретической подвижности маркеров – фрагмент ДНК известной молекулярной массы. В качестве маркера молекулярных масс использовали O’GeneRuler™ 100bp Plus DNA Ladder производства (Fermentas).
ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфолирирования с помощью щелочной фосфатазы (SAP-shimp alkaline phosphatase) и эндонуклеазы I [13].
Секвенирование фрагментов гена 16S rRNA идентифицируемых бактерий проводили на автоматическом секвенаторе 3730хl DNA Analyzer (Applide Biosystems, США) с использованием набора Big Dye Terminator v3.1 Cycle Sequencing Kit (Applide Biosystems, США), придерживаясь рекомендаций производителя. Результаты секвенирования обрабатывали в программе SeqMan (Applide Biosystems). Поиск гомологичных нуклеотидных последовательностей генов 16S rRNA осуществляли с помощью программы BLAST (Basic Local Alignment Search Tool) в базе данных Gene Bank Национального центра биотехнологической информации США (htpp://www.ncbi. nlm. nih.gov). Идентификация была осуществлена относительно инвентарных номеров Genе Bank первых трех нуклеотидных последовательностей имеющих максимальное совпадение. Филогенетический анализ проводили с использованием программного обеспечения MEGA4 [14]. Выравнивание нуклеотидных последовательностей проводили, используя алгоритм ClustalW [15]. Для построения филогенетических деревьев использовали метод «объединения соседей» Neiighbor-Joining (NJ) [16]. Дополнительно в анализ были включены нуклеотидные последовательности близкородственных видов филогенетической группы Lactobacillus buchneri и Lactobacillus plantarum, депонированных в Международных базах данных.
Результаты исследования и их обсуждение
Филогенетический анализ нуклеотидных последовательностей генов 16S rRNA. В нашем исследовании генетическая идентификация 2-х штаммов была осуществлена методом определения прямой нуклеотидной последовательности фрагмента 16S rRNA гена, с последующим сравнением нуклеотидной идентичности с последовательностями, депонированными в международной базе данных Gene Bank, а также построением филогенетических деревьев с нуклеотидными последовательностями референтных штаммов.
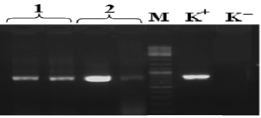
В результате выделения ДНК были получены образцы с высокой концентрацией ДНК от 80 до 150 нг/мкл, соотношение длин волн 260/280 в среднем составило 2,12. Методом ПЦР был амплифицирован фрагмент 16S rRNA гена, молекулярной массой размером около 800 п.н. Результаты амплификации образцов с отрицательным контролем отображены на рис. 1.
Продукты ПЦР амплификации были использованы для определения нуклеотидной последовательности.
Оценка нуклеотидной идентичности анализируемых последовательностей фрагмента 16S rRNA гена с референтными последовательностями филогенетически близких видов представлена в таблице.
Для исключения методической погрешности анализа 16S rRNA гена [17], дополнительно было проведено построение филогенетических деревьев (рис. 2, 3).
После удаления последовательности праймеров в неперекрывающихся областях были получены нуклеотидные последовательности размером 650 п.н. При выравнивании было выявлено, что нуклеотидные последовательности фрагмента 16S rRNA гена референтных штаммов Lactobacillus farraginis (Gene Bank AB690214.1), Lactobacillus hilgardii (Gene Bank KC351904.1), Lactobacillus pentosus (АВ362673), Lactobacillus plantarum (AJ640078), имели размер 560 и 550 п.н. соответственно. В связи с этим, для формирования однородной выборки размером 550 п.н. была удалена часть нуклеотидных последовательностей у исследуемых штаммов.
Рис. 1. Электрофорерограмма ПЦР – продуктов, полученных при амплификации фрагмента гена 16S rRNA: 1 – штамм №22, 2 – штамм №20, (в двух повторностях), М – маркер молекулярной массы O’GeneRuler™ 100bp Plus DNA (Fermentas) (100 -1000 п.н. шаг 100 п.н.), (К-) – отрицательный контроль постановки ПЦР, (К+) – положительный контроль постановки ПЦР
Результаты идентификации нуклеотидной последовательности в международной базе данных
Источник