Способы борьбы с контаминацией
Африканская чума свиней – высококонтагиозная вирусная болезнь свиней, склонная к природной очаговости, характеризующаяся высокой летальностью.
С 2007 г. вспышки АЧС регистрируются на территории Европейской части Российской Федерации. Инфекция широко распространяется среди домашних свиней и диких кабанов, нанося огромный экономический ущерб.
Лабораторная диагностика АЧС осуществляется с помощью иммунологических и культуральных методов. В настоящее время для обнаружения АЧС также широко применяется метод ПЦР [1].
Одним из главных достоинств метода ПЦР является его высокая чувствительность. При хорошей пробоподготовке с помощью ПЦР можно определять единичные копии возбудителя инфекций. Однако данное преимущество оборачивается не менее существенной проблемой – появлением ложноположительных результатов. Это может происходить по нескольким причинам, наиболее значимой из которых является контаминация продуктами амплификации.
Основным способом решения описанной проблемы является разделение ПЦР лабораторий на несколько зон. Персонал, осуществляющий обработку биологического материала и постановку ПЦР не должен проводить электрофорез и регистрацию результатов ПЦР-анализа. В лаборатории необходимо регулярно проводить обработку рабочих поверхностей хлорсодержащими препаратами, а после работы использовать УФ излучение с длиной волны 254 или 300 нм [2].
Устранение контаминации на пост-ПЦР этапе сводится к добавлению в пробирки с ампликонами псоралена или изопсоралена, что приводит к образованию ковалентных связей с ДНК. Использование таких молекул в ПЦР в качестве матрицы невозможно.
Однако описанные способы устранения контаминации имеют один серьезный недостаток – они способны полностью уничтожить лишь низкие концентрации ампликонов.
Наиболее надежным вариантом устранения контаминации в ПЦР-лаборатории является использование Урацил-ДНК-гликозилазы (КФ 3.2.2.27), далее УДГ.
Фермент УДГ способен разрушать полученные в ПЦР ампликоны, содержащие урацилы. Таким образом, в случае повторного попадания в ПЦР, такие молекулы не будут амплифицироваться. Причем для того, чтобы предотвратить контаминацию, достаточно удаления хотя бы одного остатка урацила из каждой цепи ДНК ампликона. В то же время ДНК человека и ДНК, выделенная из других живых организмов, не содержит урацилов и, соответственно, не будет служить «мишенью» для УДГ.
В связи с этим целью нашей работы было на примере тест-системы для диагностики АЧС продемонстрировать возможность внедрения УДГ для снижения риска возникновения контаминации в ПЦР-лаборатории.
Материалы и методы исследования
Для тестирования использовалась ранее разработанная в лаборатории тест-система «АЧС», выявляющая вирус африканской чумы свиней (African swine fever virus) в биологическом материале, продуктах свиноводства и изделиях свиного происхождения методом ПЦР (AmpliSens, ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, г. Москва). Тест-система разработана и выпускается в двух форматах – Eph (с электрофоретической детекцией) и FRT (с гибридизационно-флуоресцентной детекцией в режиме «реального времени»).
Эксперименты проводились на положительных контрольных образцах (ПКО), входящих в состав тест-системы «АЧС». ПКО в данной системе представлял собой инактивированные конструкции генома вируса АЧС.
Для оценки эффективности работы УДГ в ПЦР были наработаны ампликоны АЧС и внутреннего контрольного образца (ВКО). Детекция проводилась двумя способами – электрофоретическим и в режиме реального времени (Real-time). Полученные ампликоны служили матрицей в последующих экспериментах. В приготовленную реакционную смесь добавляли фермент УДГ из расчета 0,2 U на 1 реакцию. После внесения фермента УДГ пробы инкубировали при комнатной температуре 5 минут. Контролем служили реакционные смеси без добавления фермента УДГ.
Амплификацию проводили на приборах RotorGene Q (Qiagen, Германия), ДТ-96 и Терцик (ДНК-технология, РФ).
Результаты исследования и их обсуждение
Ранее в нашей лаборатории в клетках E. coli был получен рекомбинантный фермент УДГ из Североатлантической трески (Gadus morhua). Выбор фермента данного организма был не случаен, поскольку, исходя из литературных данных [3], этот фермент обладает способностью необратимо и полностью инактивироваться при нагревании до 50 °С за 10 минут. Полная и необратимая потеря ферментативной активности при 45–55 °С является необходимым условием для использования УДГ в ПЦР-диагностике поскольку это позволяет избежать «выщепления» остатков урацила из образующихся в процессе амплификации молекул ДНК, и, как следствие, изменения аналитических характеристик набора, что особенно важно для количественных тестов.
Полученный в лаборатории фермент УДГ был охарактеризован по активности с помощью методики, описанной Liu B. et al. [4]. Согласно данной методике, 1 единица активности (U) определялась как количество фермента, который за 1 минуту при 37 °С катализирует высвобождение 60 пмоль урацила из урацилсодержащей ДНК. Такое определение ферментной активности для УДГ является общепризнанным и используется как коммерческими компаниями, производящими ферменты, так и научными лабораториями.
В качестве контроля при определении активности полученного нами рекомбинантного фермента УДГ использовали УДГ зарубежных производителей New England Biolab и Roche Custom Biotech (США).
В ходе проведенных экспериментов был изменен состав реакционной смеси, входящей в тест-систему «АЧС»: вместо дТТФ в смесь включили дУТФ. Было показано, что аналитические характеристики набора при этом не изменились. Это связано с тем, что ДНК-полимераза, используемая в тест-системе «АЧС», содержит мутации, которые позволяют ферменту встраивать дУТФ в растущую цепь ДНК с такой же эффективностью, как и дТТФ.
Известно, что эффективность работы фермента УДГ во многом зависит именно от характеристик ампликона. При использовании АТ-богатой матрицы фермент разрушает ампликоны более эффективно; более длинный ампликон разрушается легче, чем короткий.
Поскольку контаминация (в случае Real-time ПЦР) обычно характеризуется попаданием в пробирку для амплификации порядка 1000–5 000 копий ампликона, для оценки эффективности работы фермента УДГ в ПЦР качестве матрицы добавляли 1 000, 10 000 и 100 000 копий ампликона.
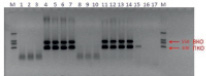
Метод ПЦР с электрофоретической детекцией является более контаминационно опасным, поскольку необходимым этапом здесь является открытие пробирки и извлечение продукта амплификации; поэтому для оценки эффективности работы фермента УДГ в ПЦР с электрофоретической детекцией в качестве матрицы добавляли 10^11 и 10^12 копий ампликонов АЧС и ВКО (рис. 1).
Рис. 1. Электрофореграмма. Разрушение ампликонов при использовании 0,2 U/reac. фермента УДГ (обозначение образцов: 1–3 – ампликоны 10^12 копий с добавлением фермента УДГ, 4–7 – ампликоны 10^12 копий без фермента УДГ, 8–10 – ампликоны 10^11 копий с добавлением фермента УДГ, 11–14 – ампликоны 10^12 копий без фермента УДГ, 15 – положительный контроль амплификации, 16–17 – отрицательные контроли амплификации)
На примере тест-системы «АЧС» было показано, что в случае длинных матриц (300–600 н.п.), характерных для тест-систем с электрофоретической детекцией, фермент УДГ разрушает до 10^12 молекул ампликонов, попавших в реакцию. В случае тест-систем с детекцией в режиме реального времени фермент способен разрушить до 100 000 молекул ампликонов, что позволяет эффективно бороться с контаминацией. Разрушение меньшего числа ампликонов связано с тем, что в данном случае ампликоны (ген АЧС и ВКО) составляют около 80 н.п. Таким образом, фермент УДГ достаточно эффективно работает в ПЦР с различными способами детекции.
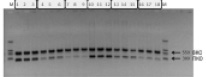
Рис. 2. Электрофореграмма. Оценка влияния 0,2 U/reac. фермента УДГ на чувствительность тест-системы «АЧС» (обозначение образцов:1–3 – 10^5 копий/мл АЧС с добавлением фермента УДГ, 4–6 – 100 000 копий/мл АЧС с добавлением фермента УДГ, 7–9 – 1 000 копий/мл АЧС с добавлением фермента УДГ; 10–12 – 10^5 копий/мл АЧС без фермента УДГ, 13–15 – 10^4 копий/мл АЧС без фермента УДГ, 16–18 – 10^3 копий/мл АЧС без фермента УДГ)
Поскольку для использования в пре-ПЦР формате фермент УДГ не должен оказывать негативного влияния на аналитические характеристики тест-системы путем ингибирования ПЦР, были проведены эксперименты по оценке влияния фермента УДГ на чувствительность тест-системы «АЧС».
Заявленная аналитическая чувствительность тест-системы составляет порядка 2000 копий/мл. Тестирование проводили на инактивированных конструкциях генома вируса АЧС с концентрациями 1 000 коп/мл, 10 000 коп/мл и 100 000 коп/мл.
В результате было показано, что фермент УДГ в концентрации 0,2U на 25 мкл реакционной смеси не оказывает негативного влияния на аналитические характеристики тест-системы, заявленная чувствительность сохраняется как формате Eph (рис. 2), так и в формате FRT.
Для оценки ингибирования ПЦР продуктами распада ампликонов тестирование проводили на инактивированных конструкциях генома вируса АЧС. В ПЦР добавляли 0,2 U фермента УДГ и ампликоны в концентрации порядка 100 000 копий из расчета на 1 реакцию. Контролем служили реакционные смеси без добавления ампликонов.
В результате было показано, что продукты распада ампликонов не оказывают негативного влияния на амплификацию тестируемой мишени, что свидетельствует о том, что аналитические характеристики набора не изменяются.
В результате проведенных экспериментов был изменен нуклеотидный состав реакционной смеси, входящей в тест-систему «АЧС», что позволило внедрить фермент УДГ в данную тест-систему. Подобрана оптимальная концентрация УДГ, которая не оказывает негативного влияния на аналитические характеристики тест-системы.
Таким образом, на примере ДНК вируса африканской чумы свиней показано, что фермент УДГ эффективно работает в ПЦР с различными способами детекции вне зависимости от характеристик ампликона, что позволяет эффективно бороться с контаминацией в ПЦР-лаборатории.
Работа поддержана Фондом содействия развитию малых форм предприятий в научно-технической сфере в рамках программы «УМНИК».
Источник
Способы борьбы с контаминацией
Проблема контаминации клеточных культур различными вирусами возникла с момента применения культур клеток для производства вирусных вакцин. Источником случайных вирусных агентов в вирусных вакцинах могут быть инфицированные доноры ткани, а также материалы и условия культивирования (сыворотка, трипсин, загрязнения в процессе производства).
В настоящее время для производства живых вирусных вакцин против многих вирусных болезней широко применяют первичные культуры клеток различных животных. Однако первичные культуры клеток могут быть контаминированы различными посторонними вирусами, патогенность которых для человека и животных не всегда известна. Контаминация вирусами тканей и полученных из них культур клеток доказана практически для всех животных.
Наиболее часто загрязненными оказывались культуры клеток почек обезьян. В тканях обезьян обнаружено более 50 вирусов, которые могут контаминировать клеточные культуры. Накопленный опыт показывает, что большинство вирусов, загрязняющих культуры клеток животных, оказались непатогенными для человека. Ряд вакцин (желтая лихорадка, корь, грипп) готовили с применением коммерческих куриных эмбрионов, содержащих вирусы лейкозосаркоматозного комплекса кур. Несмотря на длительное применение таких вакцин, не отмечено возрастание онкогенных заболеваний среди привитых.
С целью уменьшения риска эндогенного загрязнения исходного клеточного материала различными вирусами и другими патогенными возбудителями для приготовления первичных культур часто используют ткани животных, выращенные в контролируемых условиях. Так, методом, гарантирующим чистоту живых эмбриональных вакцин в отношении вирусов лейкосаркоматозного комплекса птиц, является использование в производстве этих препаратов эмбрионов безлейкозных линий кур. Хотя выращивание животных-доноров тканей в специальных питомниках ведет к значительному снижению количества вирусов-контаминантов, однако не решает проблемы контаминации в целом.
Клетки почек некоторых домашних животных являются хорошим субстратом для изготовления медицинских вирусных препаратов в связи с предположением, что они менее инфицированы вирусами, потенциально патогенными для человека, нежели ткани приматов, и потому еще, что указанные животные могут быть выращены в контролируемых условиях, при которых можно предотвратить контакт со многими вирусами.
В качестве примера можно привести вакцину против кори, вирус для которой выращивают в первичной культуре клеток куриных эмбрионов, получаемых от кур, свободных от вирусов лейкоза птиц. Для этой цели используют также первичную культуру клеток почек собак, выращенных в контролируемых условиях. Вакцину против краснухи готовят в культурах клеток почек собак и тканей эмбрионов уток.
Преимущество использования гетерологичных первичных культур (и, возможно, клеточных линий) для приготовления вирусных вакцин состоит не только в уменьшении риска, связанного с загрязнением патогенными микроорганизмами, но и оправдано с точки зрения предотвращения непредвиденного повышения реактогенности или реверсий вакцинного штамма в случае изготовления живых вакцин. Например, в медицине в течение многих лет готовят ряд вакцин с использованием куриных эмбрионов (КЭ), содержащих вирусы лейкоза птиц, однако за долгую историю применения этих препаратов для иммунизации людей не выявлено каких-либо неблагоприятных эффектов. Нет доказательств передачи людям болезней с препаратами, полученными с использованием культур клеток животных.
Контаминантами первичных культур клеток являются вирусы, обнаруживаемые у данного вида животных в естественных условиях. Существует прямая зависимость между частотой инфицированное™ животных данным вирусом и частотой его обнаружения в первичных культурах. Вирус диареи, широко циркулирующий среди крупного рогатого скота, часто обнаруживают в первичных культурах клеток этого вида животных, а также в качестве контаминанта некоторых вакцин. PC-вирус крупного рогатого скота часто удавалось обнаруживать в культурах клеток этого вида животных. В постоянной линии клеток почки свиньи при электронно-микроскопическом исследовании обнаружены эндогенные онкорнавирусы типа А, В и С, тога-, адено- и парамиксовирусы. В культуре клеток куриного эмбриона обнаружены рео- и аденовирусы.
Из клеточных культур вирусные контаминанты могут попасть в живые вирусные вакцины. Таким образом, например, вакцина против ньюкаслской болезни была загрязнена вирусом инфекционного бронхита кур, а вакцина против болезни Ауески — вирусом пограничной болезни овец.
Источник
Контаминация лаборатории. Как проверить, одолеть и спать спокойно?
Контаминация – что это?
Контаминация – это проблема, о которой не всегда принято говорить, но которая существует и затрагивает все лаборатории, работающие с ПЦР. Контаминация происходит за счет загрязнения рабочих зон, оборудования и одежды сотрудников различными типами ДНК и РНК и приводит к ложноположительным результатам ПЦР. Это серьезная проблема для лабораторий любого профиля и критическая – для клинических и криминалистических организаций. Каждый год в PubMed появляется около 100 статей о проблеме ДНК-контаминации, однако публикаций о том, как с ней бороться, очень мало (рис. 1).
Главным образом, загрязнения попадают в воздух из пробирок, планшетов, с рук операторов, а затем переносятся по всей лаборатории и за ее пределы и оседают на одежде сотрудников, дверных ручках, холодильниках и других контактных предметах или остаются в воздухе в виде аэрозоля. Также контаминация может произойти при проведении некоторых лабораторных процедур, например при выделении ДНК из геля для клонирования или при автоклавировании. Среди основных типов контаминирущих ДНК и РНК можно выделить:
- Геномную ДНК;
- Ампликоны;
- Бактериальную/плазмидную ДНК;
- кДНК (редко);
- вирусную РНК.
Чтобы контаминация лаборатории не стала причиной ошибочных результатов ПЦР, ее нужно своевременно выявить и ликвидировать.
Как проверить лабораторию на наличие контаминации?
Самый важный момент, который позволит вовремя выявить контаминацию, – это постановка отрицательных контролей. Если они не проходят, то первым делом нужно поменять реагенты и пластик и использовать другой ламинарный бокс для повторной постановки реакции. Если после этого отрицательные контроли проходят, следует провести локальную деконтаминацию изначального ламинарного бокса и утилизировать контаминированные реагенты. Однако если после смены пластика, реагентов и ламинарного бокса отрицательные контроли не проходят, значит произошла более серьезная контаминация: поверхностная или воздушная. Определение типа контаминации позволяет оценить сам масштаб необходимых мер: при контаминации воздуха необходима самая сложная – объемная – деконтаминация всего помещения.
Для анализа контаминации поверхностей нужно сделать с них смывы: нанести ПЦР-буфер на проверяемую поверхность и несколько раз ресуспендировать, а затем использовать полученный раствор в качестве матрицы для ПЦР. Чтобы проанализировать чистоту воздуха, необходимо сделать посевы из воздуха: открыть пробирку с ПЦР-буфером и подержать ее на воздухе полчаса, закрыть пробирку и использовать этот буфер в качестве ПЦР-матрицы. Если нет возможности проверить наличие ДНК в воздухе и сделать смывы с поверхностей для оценки их чистоты (например, негде поставить заведомо “чистые” реакции), следует сразу начинать деконтаминацию.
Что делать, если вы обнаружили контаминацию?
Если на каком-либо этапе проверки лаборатории на наличие контаминации вы все-таки ее выявили, то нужно с этой проблемой бороться. Советы от эксперта в области деконтаминации позволят вам грамотно и своевременно устранить контаминацию и не допустить ее повторного появления.
- Проводите проверочные постановки реакций в другом помещении, если есть такая возможность;
- Смените реагенты и пластик, а также лабораторную одежду. Помните, что одежда является одним из источников контаминации и ее миграции;
- Деконтаминируйте дозаторы и ламинарный бокс. Несмотря на то что многие дозаторы автоклавируются, это, к сожалению, не поможет, потому что автоклавирование не разрушает ДНК, а в лучшем случае частично ее фрагментирует;
- Если есть какие-то признаки мигрирующей контаминации (переносимой по воздуху или операторами, на оборудовании или через дозаторы), то необходимо как можно более оперативно использовать профессиональные средства для деконтаминации;
- Используйте облучатели-рециркуляторы с фильтрами и с высокой производительностью независимо от того, подозреваете ли вы поверхностную контаминацию или контаминацию воздуха;
- Проводите обработку помещения бактерицидными лампами с циклическим таймером. Одной обработки в день недостаточно;
- Убедитесь в том, что вентиляция в здании работает нормально. В случае серьезных воздушных контаминаций, задача номер один – очистить воздух. Данная процедура занимает примерно сутки. Сначала необходимо очистить воздух рециркуляторами, а также обработать поверхности УФ-излучением;
- Если после первых этапов деконтаминации (рециркуляторами, УФ или профессиональными средствами, примененными локально на поверхности) остаются высокие концентрации контаминирующей ДНК, то необходимо переходить к объемной аэрозольной деконтаминации всего помещения. Она проводится ТОЛЬКО профессиональными средствам. Если не откладывать и делать всё в правильном порядке, даже от самой тяжелой контаминации с загрязненным воздухом можно избавиться всего за несколько дней. В случае наиболее частых локализованных и умеренных контаминаций при использовании профессиональных средств вся процедура, как правило, занимает несколько минут.
И помните, ни в коем случае нельзя пользоваться спиртом, он осаждает ДНК на поверхностях, но никогда ее не разрушает и осложняет ее смывку (как это характерно для любых осадков нуклеиновых кислот после спирта). При использовании 70% и 96%-этанола Cq сдвигается всего на 0.5-2 цикла – даже чистая вода обладает лучшими деконтаминационными свойствами. Также не надо надеяться на хлорку и перекись водорода. Эти средства не решат вашу проблему, и нужно пользоваться профессиональными средствами для ДНК-деконтаминации.
Компания «Биомедицинские инновации» разработала высокоэффективное средство DNArid для борьбы с этой проблемой. В таблице показано, насколько эффективен данный реагент по сравнению с аналогичными продуктами других производителей, а также насколько традиционные средства (хлорсодержащие дезинфицирующие средства и перекись водорода в различных концентрациях) уступают профессиональным.
| Квантификационный цикл | |||||
| Метод деконтаминации | Геномная ДНК | Аэрозольная контаминация | Разлитые ампликоны | ||
| Без обработки | 26.3 | 20.3 | 10.8 | ||
| Вода | 35.8 | 25.8 | 16.5 | ||
| 1х ДП-2Т (средство с хлором) | 34.0 | 33.7 | 14.5 | ||
| H₂O₂, 3% | N/D | 34.6 | 21.5 | ||
| H₂O₂, 6% | N/D | 32.8 | 22.0 | ||
| Sigma DNA decontamination reagent | N/D | 35.6 | 17.7 | ||
| AppliChem DNA-ExitusPlus | 36.1 | 34.2 | 28.2 | ||
| DNArid | N/D | N/D | 28.6 | ||
Средство DNArid применяется как при уже случившейся контаминации, так и для ее предотвращения при еженедельной или ежедневной обработке рабочих зон и оборудования. Реагент не токсичен, безопасен для окружающей среды, не коррозивен и может применяться на любых поверхностях. Благодаря своей безопасности DNArid полностью решает проблему лабораторий, в которых помещения для ПЦР и электрофореза находятся не в разных зданиях или хотя бы не на разных этажах. Плановая обработка дверных ручек и других предметов (в том числе лабораторной одежды и обуви), с которыми контактируют операторы, снижает до нуля риск внесения контаминации в чистую зону.
После того, как деконтаминация проведена, нужно поставить отрицательные контроли, провести смывы с поверхностей и оценить качество воздуха, чтобы подтвердить, что деконтаминация прошла успешно. Когда вы убедились, что контаминация элиминирована, нужно минимизировать риски новой контаминации.
Что делать, чтобы предотвратить контаминацию?
Для того чтобы предотвратить контаминацию, важно действовать комплексно. Деконтаминации традиционными средствами или облучения ультрафиолетом недостаточно. Несколько простых правил и советов помогут вам избежать проблему ДНК-контаминации:
- Проводите рутинную деконтаминацию – регулярная обработка профессиональными средствами, например DNArid, стоит недорого в пересчете на каждую защищенную реакцию ПЦР и обходится намного дешевле последствий контаминации и затрат на ее устранение;
- Используйте облучатели-рециркуляторы с высокой производительностью и фильтрами;
- Проводите облучение помещения ультрафиолетом по таймеру несколько раз в сутки;
- Убедитесь в функционировании системы вентиляции или используйте альтернативные решения – фильтровые блоки с HEPA-фильтром для подачи воздуха через окно;
- Проводите деконтаминацию дозаторов с их разборкой и полной обработкой;
- Вовремя обслуживайте и очищайте амплификаторы и центрифуги;
- Регулярно деконтаминируйте автоклавы – источник фрагментарной ДНК;
- Обеспечивайте регулярную смену HEPA-фильтров ламинарных боксов и обслуживание их подрешеточных зон;
- Проводите микробиологический контроль воздуха – это простой и недорогой способ определить, оптимально ли работают системы вентиляции, очистки воздуха, УФ-облучения и правильно ли проводится уборка. Для этого можно использовать уже готовые чашки Петри со средой, специально разработанной для этих целей компанией «Биомедицинские инновации»;
- Используйте только заведомо чистую воду для всех процедур – и для ПЦР, и для пост-обработки поверхностей после деконтаминации, например воду, обработанную ДЭПК, в спрей-флаконе;
- Обеспечьте качественную утилизацию отходов: после проведения амплификации нужно не допустить повреждения пробирок и планшетов, а стерилизация автоклавированием не должна сама становиться источником контаминации;
- В лаборатории должен быть запас неконтаминированных салфеток, дистиллированной воды, наборов реагентов и пластика, а также лабораторной одежды;
- Сотрудники лаборатории должны быть обучены всем правилам работы в ПЦР-лаборатории, в том числе в части вопросов контаминации и деконтаминации.
Подводя итог, можно отметить, что проблему контаминации возможно решить в достаточно короткие сроки, при этом важно действовать комплексно, применяя методы как химической, так и физической деконтаминации. Чтобы не допустить повторного появления контаминации, нужно руководствоваться несколькими простыми правилами работы в лаборатории, и тогда ложноположительные результаты не будут угрожать вашим экспериментам. Желаем вам новых открытий и продуктивной работы, в которой нет места контаминации!
Источник