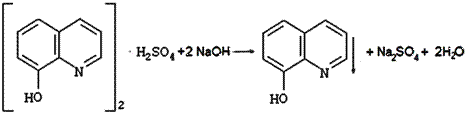
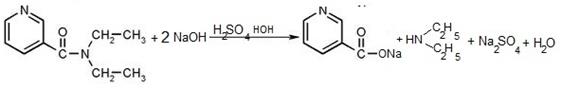
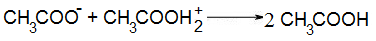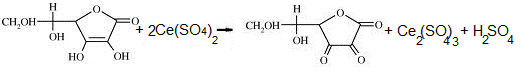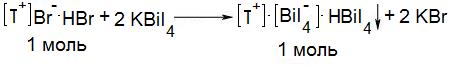Титрование по заместителю
Этот метод считается косвенным, его применяют тогда, когда по какой либо причине трудно определить точку эквивалентности, например, при работе с неустойчивыми веществами, либо определяемый ион не взаимодействует непосредственно с рабочим (титрантом) раствором, либо реагирует с ним в нестехиометрических соотношениях и т.п.
В этом методе используют исследуемое вещество, титрант и нестандартный раствор вспомогательного вещества.
К определяемому веществу добавляют вспомогательное вещество (в избытке), вступающего с ним в реакцию, один из выделившихся продуктов реакции (заместитель) в количестве, эквивалентном исследуемому, оттитровывают рабочим раствором
Например, при йодометрическом определении меди к анализируемому раствору добавляют заведомый избыток КI (вспомогательное вещество). Происходит реакция:
2Cu 2+ + 4I — = 2CuI + I2
Выделившийся иод (заместитель) оттитровывают тиосульфатом натрия.
Расчеты в заместительном титровании ведутся как при прямом титровании.
Обратное титрование (титрование по остатку)
Применяют в тех случаях, когда основная реакция протекает не очень быстро и процесс обратимый или нет подходящего индикатора. В этом случае используются два титранта:
основной и вспомогательный.
К исследуемому раствору добавляют заведомо в избытке определенный объем основного рабочего раствора, реагирующего с исследуемым веществом в эквивалентном количестве.
Остаток основного титранта, не всупивщего в реакцию с исследуемым веществом, оттитровывают вспомогательным титрантом.
Например, широко применяют обратное титрование хлорид ионов в кислых растворах при тиоцианатометрическом осадительном титровании.
К анализируемому раствору хлорида сначала добавляют заведомый избыток основного рабочего раствора нитрата серебра.
При этом происходит реакция образования малорастворимого хлорида серебра:
Не вступившее в реакцию избыточное (остаток) количество вещества AgNO3 оттитровывают раствором тиоцианата аммония или калия (вспомогательного рабочего раствора):
Содержание хлорида легко рассчитать, так как известно общее количество вещества серебра, введенное в раствор, и количество вещества AgNO3, не вступившее в реакцию с хлоридом
Для расчётов используют закон эквивалентов, исходя из которого:
С1(fэкв) V1 = С2(fэкв) V2 , где
С1(fэкв)-молярная концентрация эквивалента рабочего ра-ра;
V1-объём рабочего ра-ра;
С2(fэкв)- молярная концентрация эквивалента исследуемого ра-ра;
V2-объём исследуемого ра-ра
Применение титриметрических методов анализа в медико-биологических исследованиях:
· Данный метод может быть использован для:
· определения рН биологических жидкостей;
· определения концентрации катионов и анионов в биологических средах;
· количественного определения свободного хлора в воде;
· определения примесей органических веществ в воде и др.
36.
Нейтрализации метод — это объемный (титриметрический) метод определения концентрации кислот (ацидиметрия) и щелочей (алкалиметрия) в растворах.
При определении концентрации кислоты к точно отмеренному пипеткой объему исследуемого раствора постепенно приливают из бюретки рабочий раствор щелочи (обычно NaOH) известной концентрации, пока не изменится окраска индикатора, предварительно добавленного к титруемому раствору. Объем рабочего раствора, пошедший на взаимодействие с кислотой, отсчитывают по шкале бюретки. Определение концентрации щелочи производят аналогичным путем, только в качестве рабочего раствора в этом случае используют раствор кислоты (обычно HCl).
При титровании слабой кислоты сильной щелочью в качестве индикатора применяют обычно фенолфталеин, а при титровании слабой щелочи сильной кислотой — метиловый оранжевый. При титровании сильной кислоты сильной щелочью можно применять любой из названных индикаторов. При
выборе индикатора руководствуются правилом: значение рН в точке эквивалентности (рНэ) должно попадать в зону перехода цвета индикатора (т.е. рНэ ∋рТ±1)
37.
Индикаторы, применяемые в методах оксидиметрии, различны. Часто это органические вещества, которые сами являются окислителями или восстановителями. Иногда это специфические реактивы, например, крахмал в иодометрии. Перманганатометрические определения производят без индикатора.
Перманганатометрией называется такой вид оксидиметрии, в котором в качестве рабочего раствора применяют перманганат калия KMnO4. Он является сильным окислителем, особенно в кислой среде. В зависимости от кислотности среды при восстановлении KMnO4 получаются различные конечные продукты
38.
39.
Поддержанию на постоянном уровне концентрации ионов водорода способствуют буферные растворы – растворы, рН которых не меняется при добавлении к ним небольших количеств сильных кислот, щелочей, а также при разведении.
Простейший буферный раствор- это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион, либо смесь слабого основания и соли с общим катионом.
1 тип буферных растворов:
¢ Ацетатный — СН3СООН и СН3СООNa
¢ Белковый – РtCOOH и PtCOONa
¢ Гемоглобиновый – HHb и KHb
¢ Оксигемоглобиновый -HHbO2 и KHbO2.
2 тип буферных растворов:
По более современной классификации БР делят на следующие группы :
1. БР, состоящие из слабой кислоты и её аниона — НА/A — (CH3COOH / CH3COO — )
2. БР, состоящие из слабого основания и его катиона – В/BH + ( NH4OH / NH4 + )
3. БР, состоящие из аниона кислой и средней соли, или из анионов двух кислых солей, например, фосфатная буферная система – Н2РО4 — /HPO4 2-
4. БР, состоящие из ионов и молекул амфолитов. К ним относятся белковые БС, гемоглобиновая и оксигемоглобиновая БС.
Так как любой БР содержит слабый электролит, к процессу его диссоциации можно применить закон действующих масс, например, для ацетатного БР:
Так как концентрация ионов СН3СОО — велика из-за диссоциации соли, процесс диссоциации СН3СООН по принципу Ле -Шателье сдвинут влево, поэтому концентрация недиссоциированных молекул СН3СООН практически равна общей концентрации кислоты в БР, а концентрация ионов СН3СОО — равна концентрации соли в БР, поэтому:
40.
Если к буферному раствору добавить сильную кислоту, то ионы водорода будут соединяться с анионами с образованием слабого электролита и реакция среды при этом не меняется:
СН3СООNa + HCl = CH3COOH + NaCl
СН3СОО- + H+ = CH3COOH
Если к буферному раствору прибавить сильное основание, то ионы ОН- будут взаимодействовать с ионами Н+, которые содержатся в небольшом количестве, вследствие небольшой диссоциации кислоты. В результате образуется Н2О. Способность буферного раствора сохранять рН при добавлении сильных кислот или щелочей не беспредельна и ограничена величиной, называемой буферной ёмкостью.
В(к.) = ( рН0 –рН1) V(б.р.)
Буферная ёмкость зависит от:
· природы и общих концентраций компонентов буферного раствора, а также от соотношения их концентраций:
· чем больше концентрация компонентов и
· чем ближе отношение кислота/ соль к 1, тем больше буферная ёмкость.
Буферные системы в живых организмах поддерживают постоянство рН в крови и тканях. Исследования показали, что в процессе обмена веществ в организме образуется большое количество кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20-30 л I н. сильной кислоты. Сохранение постоянства рН среды в организме обеспечивается наличием в нем мощных буферных систем.
Большую роль при этом играют белковый, бикарбонатный и фосфатный буферы. Буферной системой крови являются бикарбонатный и фосфатный буферы: Н2С03 + NaHCO3; NaH2P04 + Na2НРО4 соответственно.
Однако наиболее мощной буферной системой крови является гемоглобиновый буфер (75% всей буферной ёмкости крови), который удаляет из организма большое количество углекислоты
41.
Водородкарбонатная(гидрокарбонатная): СО2 + Н2О = Н2СО3 Фосфатная буферная система: состоит из слабой кислоты Н2РО4- и сопряжённого основания НРО42-. В основе её действия лежит равновесие:
Н2РО4- = НРО42- + Н+
Белковые буферные системы— состоят из остатков аминокислот, которые содержат -NH2 группы, имеющие слабый основный характер, и –СООН группы, со слабыми кислотными свойствами.
Гемоглобиновая/оксигемоглобиновая БС, на долю которой приходится 75% буферной ёмкости крови.
Гемоглобиновый буфер является разновидностью белковой БС и состоит из 2х форм гемоглобина:
Нарушение в любой буферной системе сказывается на концентрациях составляющих гидрокарбонатной БС, поэтому изменение её параметров может достаточно точно характеризовать состояние дыхательных или метаболических нарушений, т.е. кислотно-основного состояния. Таким образом, благодаря буферному действию буферных систем происходит лишь небольшое снижение рН крови, т.е. сохраняется кислотно-основное состояние, несмотря на поступление в кровь значительных количеств кислот, т.к. в процессе усвоения пищи в организме генерируются значительное количество диоксида углерода (550- 775 г/cут), при взаимодействии которого с с влагой образуется угольная кислота в количестве, эквивалентном поступлению в кровь от 25 до 35 ммоль/ сут ионов Н+.
Кислотно- основное состояние организма – неотъемлемая часть гомеостаза внутренней среды организма
Смещение кислотно- основного равновесия крови в сторону повышения концентрации ионов Н+ (снижения рН) и уменьшения резервной щёлочности называется ацидозом, смещение его в сторону снижения концентрации ионов водорода ( повышение рН) и увеличение резервной щёлочности- алкалозом.
· -метаболический ацидоз и алкалоз.
Метаболический ацидоз характеризуется нарушением метаболизма и может наступить в результате следующих причин:
— избыточное введение или образование в организме стойких кислот (поступление кетокислот при голодании и диабете, повышенное образование молочной кислоты при шоке; поступление кислот с пищей, питьём, медикаментами, в результате вдыхания загрязнённого воздуха и т.д.);
— неполное удаление кислот( при почечной недостаточности);
— избыточные потери НСО3- иона ( в результате поноса, колита, язвы кишечника)
Метаболический алкалоз наступает вследствие:
потери ионов Н+ (рвоте, кишечной непроходимости и др.);
Увеличения концентрации НСО3- иона (при потере воды, введение солей органических кислот- молочной, уксусной ,лимонной, катаболизирующихся с поглощением ионов Н+ ).
Источник
Заместительное титрование



К аликвотной доле определяемого вещества Vп(X) добавляют заведомый избыток реагента А и выделяется заместитель В в количестве, эквивалентном определяемому веществу: X+A=B
Заместитель В титруется подходящим титрантом: B+T=C
Закон эквивалентов для заместительного титрования:
n(1/z X)=n(1/Z A) = n(1/Z T)
с использованием соотношения (4.8) можно записать в виде:
C(1/Z X)*Vп(1/z X)= C(1/Z T)*V(1/z T)
Отсюда получают формулу для расчета молярной концентрации эквивалента определяемого вещества в растворе по результатам заместительного титрования:
C(1/z X) 
которая имеет такой же вид, как и при прямом титровании (4.14). Именно поэтому все расчеты массы определяемого вещества в анализируемой задаче при заместительном титровании производят по формулам (2.15- 2.18) для прямого титрования.
Обратное титрование
К аликвотной доле определяемого вещества Vп(X) добавляют известный избыток первого титранта V(T1):
Затем избыток непрореагировавшего первого титранта оттитровывают вторым титрантом T2 при этом расходуется объем V(T2):
Закон эквивалентов в данном случае можно записать в виде:
Отсюда рассчитывают молярную концентрацию эквивалента вещества Х в растворе:
C(1/Z X) 
Подставляют полученное выражение в уравнение (4.2) и получают формулу для расчета массы определяемого вещества в анализируемом растворе, равном объему колбы, по результатам обратного титрования:
Часть II. ВАРИАНТЫ ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
1. АЦИДИМЕТРИЯ – кислотно-основное титрование.
Титранты: растворы хлороводородной и серной кислот.
Индикаторы: кислотно-основные – метиловый оранжевый, метиловый красный индивидуально или в смеси с метиленовым синим (2:1 или 1:1).
Варианты
1.1. Нейтрализация (прямое титрование) – основан на свойстве неорганических и органических оснований вступать во взаимодействие с кислотами с образованием солей.
По данному варианту определяют аммиак (ФС), метенамин (гексаметилентетрамин) (неофицинальный метод, см. сокращенно неоф. метод), кодеин (ФС), этилендиамин в аминофиллине (эуфиллине) (ФС).
1.1.2. Метенамин (гексаметилентетрамин) (неоф. метод):

1.1.3. Аминофиллин (эуфиллин) (определение по этилендиамину) (ФС):
1.2. Вытеснения (прямое титрование) – основан на вытеснении сильной кислотой (титрант) слабой кислоты из ее соли.
1.2.1. Натриевые соли неорганических кислот (натрия гидрокарбонат (ФС), натрия тетраборат (ФС)):


1.2.2. Соли органических кислот:
1.2.2.1. Соли производных барбитуровой кислоты (ФС) – барбитал-натрий, гексобарбитал-натрий (гексенал), этаминал-натрий.
1.2.2.2. Соли производных сульфаниламидов – сульфацетамид-натрий (сульфацил-натрий) (неоф. метод).
1.2.2.3. 
Определение проводят в присутствии органического растворителя, не смешивающегося с водой (эфир), который извлекает образующиеся кислоты и подавляет их диссоциацию.
Титрование натриевых солей барбитуровой кислоты и сульфаниламидов (соли более слабых кислот) проводят без добавления органических растворителей.
1.3. Гидролиза (обратное титрование). По этому варианту определяют метенамин (гексаметилентетрамин) (ФС). Метод основан на свойстве лекарственных веществ (ЛВ) гидролизоваться при нагревании с избытком титрованного раствора серной кислоты.


2. АЛКАЛИМЕТРИЯ – кислотно-основное титрование.
Титранты: растворы калия и натрия гидроксида.
Индикаторы: кислотно-основные – фенолфталеин, бромфеноловый синий, тимоловый синий, бромтимоловый синий, тимолфталеин, феноловый красный и другие.
Варианты
2.1. Нейтрализация (прямое титрование) – основан на свойстве неорганических и органических кислот взаимодействовать со щелочами с образованием солей.

2.1.1. Растворы кислоты хлористоводородной (ФС), кислота борная (ФС):

2.1.2. Бензойная, салициловая, ацетилсалициловая кислоты (ФС):
2.1.3. Аминокислоты: глутаминовая кислота по бромтимоловомусинему (ФС) и вариант по Серенсену (формольное титрование) (неоф. метод).
Аминокислоты являются амфотерными соединениями, в водных растворах образуют внутренние соли Н3N + – CН2 – СОО — , поэтому алкалиметрическое определение затруднено. Для связывания (блокирования) аминогруппы к аминокислоте добавляют формалин. Образующееся метиленовое производное титруют раствором натрия гидроксида.

2.1.4. Производные барбитуровой кислоты – барбитал, фенобарбитал (неоф. метод), бензолсульфониламиды – норсульфазол (неоф. метод), бутамид (ФС) –проявляют кислотные свойства за счет имидной и сульфамидной групп. Определение проводят в водно-спиртовом и водно-ацетоновом растворах (индикатор – тимолфталеин).


2.1.5. Аскорбиновая кислота (неоф. метод):
2.1.6. Фенилбутазон (бутадион) (ФС). Проявляет кислотные свойства за счет образования енольной формы. Растворитель – ацетон или спирт (индикатор фенолфталеин):
2.2. Щелочного гидролиза (обратное титрование) – основан на гидролитическом разложении вещества по сложно-эфирной или амидной группе в присутствии избытка титрованного раствора натрия гидроксида, остаток которого далее оттитровывается кислотой.
2.2.1. 

2.2.2. 

2.3. Косвенный (см. часть 1, «Вторичная аминогруппа», количественное определение, п. 2):

2.4. Вытеснения (прямое титрование). Основан на вытеснении слабого основания из его соли более сильным минеральным основанием. Титруют в присутствии органических растворителей.
Метод используется для количественного определения солей органических оснований – папаверина гидрохлорида, пилокарпина гидрохлорида, атропина сульфата, бендазола гидрохлорида (дибазола), хлорпромазина гидрохлорида (аминазина), прокаина гидрохлорида (новокаина) (для всех неоф. метод), хинозола (ФС) и т.д.
2.4.1. Прокаина гидрохлорид (новокаин) (неоф. метод) (см. часть 1, «Третичный и четвертичный атом азота», количественное определение, п. 3).
2.4.2. Кодеина фосфат (неоф. метод):
Если соль образована слабым или средней силы основанием, то титрование ведут в водной или водно-спиртовой среде (бендазола гидрохлорид (дибазол), пилокарпина гидрохлорид).
Если соль образована сильным основанием (хинозол, хлорпромазина гидрохлорид или аминазин), то титруют в присутствии органического растворителя (хлороформ, спирто-хлороформная смесь) для извлечения органического растворителя.
3. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ.
Метод кислотно-основного титрования в неводных растворителях применяется для количественного определения веществ, представляющих собой кислоты, основания или соли, титрование которых в воде затруднено или невозможно из-за слабых кислотно-основных свойств или малой растворимости. Слабыми считают электролиты (кислота или основание), его Кр -8 , т.е. рКа > 8.
Варианты
3.1. Ацидиметрия в среде протогенного растворителя.
Является официнальным методом практически для всех азотсодержащих органических соединений и их солей, обладающих основными свойстами.
Титрант: раствор хлорной кислоты (НСlО4).
Индикаторы: кристаллический фиолетовый, реже метиловый фиолетовый, малахитовый зеленый.
Метод основан на солеобразовании слабого органического основания титрантом в среде протогенного растворителя, усиливающего основные свойства анализируемого вещества.
3.1.1. Определение оснований – кофеин (ФС), нитроксолин в субстанции (ФС), диазепам (сибазон) (ФС), фтивазид (ФС), изониазид (ФС), метамизол-натрий (анальгин) (неоф. метод), глутаминовая кислота (неоф. метод), никотинамид (ФС).
3.1.1.1. Никотинамид (ФС). Реакция идет по третичному атому азота пиридинового цикла.
В основе лежат следующие стадии:
1) Протонированиеоснования (усиление основных свойств):
2) Отнятие протона от титранта:
3) Солеобразование (нейтрализация):
 |
4) Регенерация растворителя:

 |
3.1.1.2. Изониазид (субстанция и таблетки по ФС). Реакция идет по азоту пиридинового цикла. Определение ведут в среде ледяной уксусной кислоты уксусного ангидрида. Уксусный ангидрид добавляют для блокирования аминогруппы, т.к. она тоже обладает основными свойствами:
3.1.2. Определение солей – хлорпромазина гидрохлорид (аминазин), дифенилгидрамина гидрохлорид (димедрол), бендазола гидрохлорид (дибазол), тримеперидина гидрохлорид (промедол), апрофен, эфедрина гидрохлорид, папаверина гидрохлорид, кокаин, эпинефрин (адреналин), норэпинефрин (норадреналин), кодеина фосфат, тиамина хлорид и т. д. (для всех ФС).
3.1.2.1. 






3.1.2.2. Соли галогенпроизводных кислот азотсодержащих органических оснований (см. часть I, «Третичный и четвертичный атом азота», количественное определение, п. 1).
3.1.2.3. Атропина сульфат (ФС) в процессе титрования образует две соли перхлорат и гидросульфат:
3.2. Алкалиметрия в среде протогенного растворителя.
По этому методу определяют лекарственные соединения, обладающие слабыми кислотными свойствами.
Титранты: раствор метилата натрия или лития, растворы гидроксида натрия или калия в среде метилового спирта или бензола.
Индикаторы: тимоловый синий, реже бромтимоловый синий.
Растворители (протофильные): наиболее часто используемые – диметилформамид (ДМФА), пиридин, этилендиамин.
Метод основан на солеобразовании определяемых соединений, проявляющих слабые кислотные свойства с титрантом в среде протофильного растворителя, усиливающего кислотные свойства анализируемого вещества.
Является официнальным и применяется для лекарственных средств, содержащих имидную группу (барбитураты), сульфамидную (сульфаниламиды) – фталилсульфатиазол (фталазол), производных урацила (метилурацил, фторурацил), ксантина (теобромин, теофиллин), 5-нитрофурана (нитрофурантоин или фурадонин), аминокислот (метионин), фенолов (нитроксолин в таблетках), а также лекарственных средств, содержащих енольный гидроксил (этилбискумацетат или неодикумарин).
3.2.1. Барбитураты (барбитал, фенобарбитал) (ФС) (см. часть «Третичный и четвертичный атом азота», количественное определение, п. 1).
3.2.3. Этилбискумацетат (неодикумарин) (ФС), фталилсульфатиазол (фталазол) (ФС) титруются как двухосновные кислоты:
3.2.4. 
4. НИТРИТОМЕТРИЯ.
Титрант: раствор натрия нитрита.
Варианты
4.1. Диазотирования – основан на свойстве первичных ароматических аминов вступать в реакцию диазотирования с образованием солей диазония.
4.1.1. Производные пара-аминобензойной кислоты – прокаина гидрохлорид (новокаин), прокаинамида гидрохлорид (новокаинамид), бензокаин (анестезин) – ФС, сульфаниламиды – норсульфазол,сульфацетамид-натрий (сульфацил-натрий) и др. – ФС (см. часть 1, «Первичная ароматическая аминогруппа», количественное определение, п. 1).
4.1.2. ЛВ, содержащие замещенную первичную ароматическую аминогруппу (парацетамол – по ФС, оксазепам (нозепам) – неоф. метод) после кислотного гидролиза (см. часть 1, «Первичная ароматическая аминогруппа», количественное определение, п. 1).
4.1.3. Ароматические нитропроизводные: хлорамфеникол (левомицетин) (ФС), нитроксолин (неоф. метод), нитразепам (неоф. метод) после восстановления ароматической нитрогруппы до первичной ароматической аминогруппы.
4.2. 
4.3. Нитрозирования.
Тетракаина гидрохлорид (дикаин) (ФС), содержащий вторичную ароматическую аминогруппу:
5. ЙОДОМЕТРИЯ.
Титранты: растворы йода и натрия тиосульфата. Вспомогательный раствор – раствор калия йодида.
Индикаторы: раствор крахмала, хлороформ (для экстракции йода) и безиндикаторный способ.
Варианты
5.1. Окисления – основан на окислении ЛВ йодом.
5.1.1. Раствор формальдегида (ФС), глюкоза (неоф. метод), содержащие альдегидную группу. Вариант обратного титрования (см. часть «Карбонильная группа», количественное определение, п. 1).
5.1.2. 

5.1.3. 


5.1.4. Аскорбиновая кислота (неоф. метод):
5.1.5. 

5.1.6. Унифицированный йодометрический метод для йодсодержащих органических препаратов (лиотропин, тиреоидин) (см. часть 1, «Ковалентно связанный галоген», количественное определение, п. 2).
5.2. Восстановления – основан на восстановлении лекарственных веществ калия йодидом, выделившийся йод титруют раствором натрия тиосульфата (косвенное титрование).
5.2.1. 



5.2.2. 


5.2.3. Хлорамин Б, галазон (пантацид) (ФС):
Определение хлорамина проводят в среде хлороводородной кислоты, галазона (пантоцида) – в среде натрия гидроксида (т.к. пантоцид (галазон) мало растворим в воде). Вещества разлагаются с выделением активного 



Независимо от количества атомов хлора в молекуле fэкв = 1 (атомарного хлора). Рассчитывают содержание активного хлора: хлорамин Б должен содержать 25-29% хлора, галазон (пантоцид) – не менее 50%.
5.3. Замещения – основан на свойстве йода вступать в реакцию электрофильного замещения с лекарственными веществами (фенолопроизводными – резорцин (ФС), тимол (ФС), фенол (ФС), салициловая кислота (неоф. метод); аминопроизводными – сульфаниламиды (неоф. метод), прокаина гидрохлорид (новокаин) и др. производные пара-аминобензойной кислоты (неоф. метод), вариант обратного титрования):
5.3.1. Фенол (ФС) (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.2).
5.3.2. Антипирин (ФС), обратное титрование:


5.3.3. Фенилбутазон (бутадион) (неоф. метод), прямое титрование:
5.4. 


fэкв = ½, где n – количество молекул йода в составе полийодида.
5.4.1. Кофеин в кофеин-бензоате натрия (ФС). Обратное титрование (см. часть 1, «Третичный и четвертичный атом азота», количественное определение, п. 4).
6. ОПРЕДЕЛЕНИЕ АЗОТА В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ (МЕТОД КЬЕЛЬДАЛЯ).
Титрант: раствор хлороводородной кислоты.
Индикатор: метиловый красный в смеси с метиленовым синим.
Варианты
6.1. Классический метод Кьельдаля (см. часть 1, «Ковалентно связанный азот», количественное определение, п. 1).
Примеры лекарственных средств:
| Примидон (ФС) | Осалмид (ФС) | |
| Гексамидин (ФС) | Оксафенамид (ФС) | Дипрофиллин (ФС) |
 |  |  |
| fэкв = ½ | fэкв = 1 | fэкв = ¼ |
| ЛВ | ЛВ | ЛВ |
6.2. 
Фактор эквивалентности зависит от числа амидных групп.
6.2.1. 


6.2.2. Гидролитическое разложение амидов в присутствии серной кислоты с образованием соли амина, которую разлагают щелочью до летучего амина и далее определяют по методу Кьельдаля (никетамид или диэтиламид никотиновой кислоты – неоф. метод).
Видоизмененный метод Кьельдаля используется для определения салициламида (ФС), можно по этому методу определить никотинамид (неоф. метод).
7. КОМПЛЕКСОНОМЕТРИЯ – метод основан на свойстве катионов металлов количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных в воде бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминтетрауксусной кислоты (сокращенно Na2H2TrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом.
Действие металлоиндикаторов зависит от рН среды:
а) рН 9,5-10 создается аммиачным буфером.
Индикаторы: кислотный хром черный специальный (или эриохром черный Т), кислотный хромовый темно-синий (или хромовый темно-синий), переход окраски от красно-фиолетовой или вишнево-красной к синей или сине-фиолетовой.
Титруют: Zn 2+ ,Mg 2+ ,Ca 2+ .
б) рН 1-2 создается доьавлением разведенной азотной кислоты, рН 4-5-6 создается добавлением ацетатного раствора, рН 7,8-8,2 создается добавлением гексаметилентетрамина (метенамина).
Индикатор: ксиленовый оранжевый, переход окраски от красной к желтой.
Титруют: Bi 3+ (рН 1-2); Cu 2+ (рН 4-5-6); Zn 2+ , Pb 2+ , Al 3+ (рН 7,8-8,2).
в) рН 12-14 создается 30% раствором натрия гидроксида вблизи точки эквивалентности.
Индикатор: кальконкарбоновая кислота, переход окраски от красно-сиреневой к голубой.
Варианты
7.1. Прямого титрования.Определяют цинка сульфат, кальция хлорид, цинка оксид, магния оксид, кальция лактат, кальция глюконат, висмута нитрит основной (ФС). Реакция комплексообразования:
1) 
2)
3) В точке эквивалентности:

7.2. Обратного титрования. Используется, если:
1) Реакция комплексонообразования проходит медленно (Аl 3+ );
2) Нет подходящего индикатора (Pb 2+ );
3) Анализируемое вещество не растворяется в воде
1) 
2) 

Трилон Б образует с катионами металлов комплексонаты в стехиометрическом соотношении 1:1 независимо от заряда катиона, поэтому fэкв = 1. Исключение составляет препарат – висмута нитрат основной, т.к. это вещество непостоянного состава и расчет идет на Bi2O3, поэтому fэквBi2O3= ½.
7.3. Косвенного титрования. Основан на свойстве органических лекарственных веществ с третичной аминогруппой (папаверина гидрохлорид, морфина гидрохлорид, атропина сульфат, хлорпромазина гидрохлорид (аминазин), хинина гидрохлорид и др.) образовывать комплексные соли с общеалкалоидными реактивами, например, тетрароданоцинкатом аммония, калия тетрайодовисмутатом (III) (неоф. метод) (см. часть 1, «Третичный и четвертичный атом азота», количественное определение, п. 5).
Примеры лекарственных веществ:
 |  |
| хлорпромазина гидрохлорид (Аминазин) | атропина сульфат |
| fэкв = 2/n = 2/1 = 2 | fэкв = 2/n = 2/2 = 1 |
8. ЦЕРИМЕТРИЯ(окислительно-восстановительное титрование).
Титрант: раствор церия (IV)сульфата.
Индикация: 1) безиндикаторный; 2) дифениламин или ферроин – комплекс Fe(II) с о-фенантролином; 3) потенциометрический способ индикации.
Метод основан на свойстве препаратов окисляться солями церия (IV), которые в кислой среде восстанавливаются до церия (III).

Варианты
8.1. Прямого титрования.
8.1.1. Хлорпромазина гидрохлорид (Аминазин) (МФ III) (безиндикаторный метод) – окисление за счет серы до моносульфоксида.
Титруют до исчезновения образующегося в процессе титрования красного окрашивания.
8.1.2. Менадиона натрия бисульфит (викасол) (ФС) (в присутствии индикатора ферроина).
Метод основан на окислении восстановленной формы менадиона сульфатом церия (IV) до 2-метил-1,4-нафтохинона и восстановлении церия (IV) до церия (III).
Предварительно действием щелочи выделяют 2-метил-1,4-нафтохинон, извлякают хлороформом, хлороформ отгоняют, менадион восстанавливают цинковой пылью в кислой среде до 2-метил-1,4-дигидроксинафталина, который окисляют сульфатом церия (IV).
В точке эквивалентности избыточная капля титранта (Се(SO4)2)окисляет Fe 2+ в составе комплекса с о-фенантролином до Fe 3+ , который дает комплекс голубого цвета. Титруют до зеленого окрашивания (голубой цвет комплекса 
8.1.3. Аскорбиновая кислота (неоф. метод) (в присутствии индикатора – ферроина).
8.1.4. 
8.1.5. Токоферола ацетат в 50% масляном растворе (ФС) после кислотного гидролиза (индикатор — дифениламин):
В точке эквивалентности появляется сине-фиолетовое окрашивание.
8.2. Обратного титрования. Избыток церия (IV) сульфата (титрант) определяют йодометрически.
8.2.1. 


8.2.2. Кофеин (теобромин, теофиллин) (неоф. метод).
Избыток титрованного раствора церия (IV)сульфата при нагреве окисляет вещества в кислой среде до образования аллоксанов (диметилаллоксан – при окислении кофеина и теофиллина метилаллоксан – при окислении теобромина).

Избыток церия (IV) сульфата определяют йодометрически (см. п. 8.2.1.).
9. БРОМАТОМЕТРИЯ.
Титранты: растворы калия бромата и натрия тиосульфата.
Вспомогательные растворы: каоия бромида и калия йодида.
Индикация: 1) раствор крахмала, 2) метиловый оранжевый, 3) без индикатора, 4) хлороформ.
Варианты
9.1. Замещения – основан на свойстве лекарственных веществ – фенолов и ароматических вступать в реакцию электрофильного замещения атомов водорода ароматического кольца на атомы брома.
9.1.1. Прямого титрования:
Тимол (ФС), прокаина гидрохлорид (новокаин), бензокаин (анестезин), сульфаниламид (стрептоцид) и другие производные п-аминобензойной кислоты и сульфаниламидов (неоф. методы).
9.1.1.1. Тимол (ФС) (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.1.1.).
9.1.1.2. Сульфаниламид (Стрептоцид) (неоф. метод):


9.1.2. Обратного титрования. Избыток брома определяют йодометрическим методом.
Фенолопроизводные (фенол, резорцин (ФС)), салициловая кислота, натрия салицилат, фенилсалицилат (после гидролиза) (неоф. методы), раствор гексэстрола (синэстрола) в масле 2% для инъекций (ФС), производные урацила (неоф. методы).
9.1.2.1. Резорцин (ФС) (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.1.2.).
9.1.2.2. Тегафур (фторафур) (неоф. метод):




9.1.2.3. Хинозол (неоф. метод):
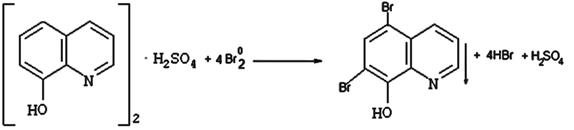

Вариант обратного титрования.
9.1.2.4. Салициловая кислота (неоф. метод) (с декарбоксилированием):
Можно определять сложные эфиры и амиды (фенилсалицилат, ацутилсалициловую кислоту, салициламид) после гидролиза (неоф. метод).

Вариант обратного титрования.
9.1.2.5. Гексэстрол (синэстрол) (масляный 2% р-р для инъекций – ФС):


Вариант обратного титрования.
9.2. Окислительного титрования.
9.2.1. Для экспресс-анализа йодсодержащих лекарственных веществ – основан на окислении йодид-иона (I — )до йодмонохлорида (ICl) броматом калия в сильно кислой среде НСl (1:1).
Титрант: раствор калия бромата.
Индикация: 1) метиловый оранжевый (переход окраски от красно-бурой до лимонно-желтой); 2) безиндикаторный способ (переход окраски от бурой в лимонно-желтую).
9.2.1.1. Прямого титрования. Калия йодид (неоф. метод):


 |


9.2.1.2. Косвенного титрования.
Тиамина бромид (неоф. метод) – при взаимодействии с реактивом Драгендорфа образуется соединение, после растворения осадка в растворе хлороводородной кислоты образующиеся йодид-ионы косвенно определяют броматометрическим методом окислительного титрования.
Метод разработан на кафедре фармхимии ПГФА доцентом Г.И. Савельевой. Предложен для анализа тиамина в многокомпонентых лекарственных препаратах, при малом содержании тиамина, когда другие титриметрические методы использовать невозможно.
Тиамин осаждают реактивом Драгендорфа:
Осадок отфильтровывают, промывают от избытка реактива, затем растворяют в растворе НСl:

3 

В ходе реакции образуется 8 I — ионов, следовательно, f экв = 1/16.
10. МЕРКУРИМЕТРИЯ – метод основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных)галогенидов ртути (II). Прямое титрование.
Титранты: легко ионизированные соли ртути (II)– ртути (II) перхлорат.
10.1. Определение галогенидов.

где Х – Cl — ,Br — ,I — .
Титрование в азотнокислой среде.
Индикация: дифенилкарбазон (до светло-сиреневого окрашивания)
10.1.1. Хлориды и бромиды калия и натрия, кальция хлорид (неоф. метод):


10.1.2. Йодиды натрия и калия (неоф. метод).
Варианты
10.1.2.1. Безосадочный в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%. Используется свойство ртути йодида растворяться в спирте с образованием бесцветных растворов.
Титрант: ртути (II)перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2]


10.1.2.2. Осадочного титрования с йодкрахмальным способом фиксации точки эквивалентности, индикация как в методе Кольтгофа.



В точке эквивалентности из раствора исчезают йодиды, что сопровождается исчезновением синего окрашивания:

10.2. Определение гидрохлоридов и гидробромидов органичнских оснований:
Тиамина хлорид или бромид, папаверина, этилморфина, эфедрина, пиридоксина, пилокарпина гидрохлориды, скополамина гидробромид и др. (неоф. методы).


где n – число молекул HBrили HCl в молекуле анализируемого препарата.
10.2.1. Скополамина гидробромид (неоф. метод):
10.2.2. Тиамина бромид или хлорид (неоф. метод):

10.3. Определение лекарственных веществ, содержащих ковалентно связаный хлор и бром – основано на предварительном разрушении органического вещества сожжением в колбе с кислородом, растворении продуктов сгорания в поглощающей жидкости (раствор пероксида водорода) и последующим определением элементов в ионном виде.
10.3.1. 

11. АРГЕНТОМЕТРИЯ – метод основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом в виде галогенидов серебра.
Варианты
11.1. Мора (прямое титрование) – используется для титрования хлоридов и бромидов.
Титрант:раствор серебра нитрата.
Индикатор: калия хромат.
Йодиды не определяют, т.к. (ПР AgI = 1,5·10 -16 ; ПР AgCl = 1,8·10 -14 ; ПР AgBr = 4,4·10 -13 ; ПР Ag2CrO4 = 2·10 -12 );
Кроме того осадки серебра йодида и серебра хромата близки по цвету, что затрудняет определение точки эквивалентности.
Реакция среды нейтральная или слабощелочная.
11.1.1. 



11.1.2. Гидрохлориды и гидробромиды органических оснований: папаверина гидрохлорид, прокаина гидрохлорид (новокаин) (неоф. метод).

11.2. Фаянса (прямое титрование).
Титрант: раствор серебра нитрата.
Индикаторы: адсорбционные – натрия эозинат (для йодидов), бромфеноловый синий, флуоресцин (для хлоридов и бромидов).
Среда – уксуснокислая (разб. CH3COOH). Натрия эозинат не используется для определения хлоридов, т.к. анион в самом начале титрования вытесняет хлориды из осадка и розовая окраска наступает от первой капли титрованного раствора.
11.2.1. Калия и натрия йодиды (ФС), каоия и натрия хлориды и бромиды (неоф. метод):






11.2.2. 
11.2.3. Лекарственные вещества, содержащие ковалентно-связанный галоген после переведения его в ионогенное состояние (гидролитическое разложение, восстановительная минерализация) (кислота йопаноевая (неоф. метод)).


fэкв = 1/n, где n – число атомов галогена в органическом соединении, для кислоты йопаноевой fэкв = 1/3.
11.3. Фольгарда (обратное титрование).
Титранты: растворы серебра нитрата и аммония тиоцианата (роданида).
Индикатор: железоаммонийные квасцы.
Среда – кислая (разб.НNO3) – для предотвращения гидролиза соли (индикатора). Можно определять все галогениды, но для хлоридов осадок серебра хлорида отделяют фильтровани ем или добавлением нитробензола, т.к. растворимость осадка серебра хлорида выше растворимости осадка серебра тиоцианата (ПР AgCNS = 1,07·10 -12 ; ПР AgCl = 1,8·10 -10 ).
11.3.1. Натрия бромид, натрия йодид (неоф. метод):





индикатор изб. капля желто-розовое окрашивание
11.3.2. Галогениды органических оснований (таблетки тропацина, гоматропина гидробромид, папаверина гидрохлорид (неоф. метод)):


индикатор изб. капля желто-розовое окрашивание
11.3.3. 




11.4. Фольгарда в модификации Кольтгофа (косвенный или видоизмененный вариант Фольгарда). Используется для бромкамфоры (ФС).
В отличие от классического метода Фольгарда в данном варианте индикатором служит железа тиоцианат (роданид) желто-розового цвета, который получают рибавлением к анализируемой смеси растворов железоаммонийных квасцов и аммония тиоцианата. При расчетах из объема серебра нитрата вычитают объем раствора аммония тиоцианата (обычно 0,1 мл 0,1 моль/л). Титрование ведут до исчезновения розовой окраски.
Источник