- 6.6. Способы выявления и окраски капсул микробов
- Способ выявления капсул у бактерий
- Способ выявления капсул у бактерий
- Поверхностные структуры бактерий
- Капсула бактерий
- Выявление капсул у бактерий методом бурри – гинса
- Выявление спор у бактерии методом ожешко
- Выявление жгутиков у культуры подвижных микроорганизмов методом серебрения по морозову:
- Методы выявления капсул, жгутиков, спор
- Изучение микробов в живом состоянии
6.6. Способы выявления и окраски капсул микробов
Некоторые виды бактерий продуцируют слизистое вещество, которое, концентрируясь вокруг тела микробной клетки, образует капсулу. При обычных методах окраски капсулы остаются бесцветными. Это позволяет применять простые методы окраски для выявления капсульных микроорганизмов в мазках из органов и тканевой жидкости.
При окраске метиленовым синим клетки тканей и тела бактерий окрашиваются в голубой цвет, вокруг бактерий сохраняется бесцветная зона – капсула, которая выявляется на темном фоне.
Для окрашивания вещества капсул применяют специальные способы окраски.
6.6.1. Выявление капсул по способу Бурри
На узкий конец предметного стекла наносят каплю туши (рецепт 27) в бактериологическую петлю исследуемого материала. Смесь перемешивают тщательно петлей, делают мазок, как мазок крови, высушивают на воздухе и, не фиксируя, микроскопируют с иммерсионной системой. Способом Бурри можно пользоваться не только для выявления капсул микробов, но и для обнаружения в исследуемом материале спирохет. Фон препарата окрашен в темно-дымчатый цвет, микробные тела и их капсулы не окрашиваются тушью и остаются бесцветными, вследствие чего этот способ получил название негативного.
6.6.2. Окраска капсул по способу Бурри–Гинса
- Приготавливают негативно окрашенный по способу Бурри препарат;
- фиксируют любым химическим способом: метиловым спиртом, смесью Никифорова или другими смесями;
- промывают водой;
- окрашивают карболовым фуксином Циля, разведенным 1:3, в течение 3–5 мин (рец. 17);
- препарат промывают водой, высушивают и микроскопируют с иммерсионной системой.
При микроскопии на темном фоне препарата контрастно выделяются неокрашенные капсулы, внутри которых находятся бактерии ярко-малинового цвета.
Источник
Способ выявления капсул у бактерий
Капсула – слизистая структура толщиной более 0,2 мкм, прочно связанная с клеточной стенкой бактерии и имеющая четко очерченные внешние границы. Капсулу патогенные бактерии (пневмококки, бациллы и др.) образуют, как правило, в организме животных или человека. Однако у некоторых видов (клебсиелла пневмонии) капсула обнаруживается постоянно.
Clostridium perfringens. Электронная микроскопия. Вокруг клетки видна массивная капсула (К), состоящая из глыбок электронноплотного материала. х100000.«Авакян А.А., Кац Л.Н., Павлова И.Б. Атлас анатомии бактерий, патогенных для человека и животных. М «Медицина».-1972.-183 с.»
Капсулы патогенных бактерий состоят, главным образом, из полисахаридов (пневмококки), но могут содержать полипептиды (сибиреязвенные бациллы).
Многие бактерии образуют микрокапсулу – слизистое образование толщиной менее 0,2 мкм, выявляемое лишь при электронной микроскопии в виде микрофибрилл из мукополисахаридов, которые тесно прилегают к клеточной стенке.
Капсула несет многообразные функции: защитную, предохраняя клетку от неблагоприятных условий среды обитания, и адгезивную, способствуя «прилипанию» к поверхности (рецепторам) клетки хозяина. Капсулы экранируют бактериальные структуры, активирующие систему комплемента, а также структуры, распознаваемые иммунокомпетентными клетками. Гидрофильность капсул затрудняет поглощение их фагоцитами, а само капсульное вещество защищает бактерию от действия лизосомальных ферментов и токсичных пероксидов фагоцитирующих клеток.
Капсулы имеют консистенцию геля и не задерживают анилиновые красители, поэтому не окрашиваются ими. Капсула различима в мазках-отпечатках из патологического материала. Она выявляется при специальном окрашивании по Бурри-Гинсу, создающем негативное контрастирование веществ капсулы.
Источник
Способ выявления капсул у бактерий
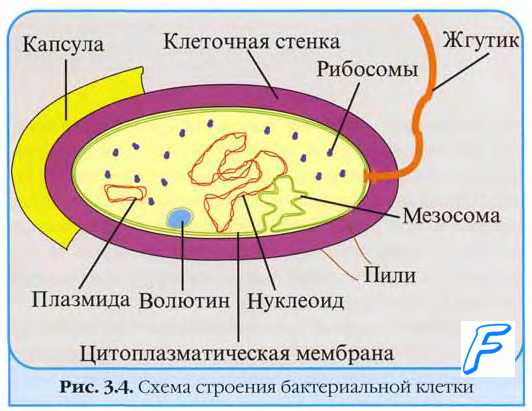
Один из основных признаков прокариотической клетки — отсутствие внутреннего разделения, обеспечиваемого элементарными мембранами. По сути, единственная мембранная система прокариотической клетки — ЦПМ, входящая в состав клеточной оболочки, часто сложно устроенная и проникающая поперечными складками глубоко в цитоплазму. В составе любой стабильной бактериальной клетки выделяют условные компартменты — поверхностные структуры, клеточную оболочку и цитоплазму.
Поверхностные структуры бактерий
Основные поверхностные структуры бактериальной клетки — капсула, жгутики и микроворсинки. Их наличие — относительно стабильный признак, используемый для идентификации бактерий.
Капсула бактерий
Клеточную оболочку многих бактерий окружает слой аморфного, сильно обводнённого вещества. Этот покров выполняет важные функции: делает оболочку клетки (состоящей из клеточной стенки и ЦПМ) более плотной и прочной, предохраняет бактерии от воздействия бактерицидных факторов, обеспечивает адгезию на различных субстратах, может содержать запасы питательных веществ.
Организация капсул бактерий. Основную роль в организации капсул бактерий играет ЦПМ. Выделяют микрокапсулы (выявляемые только при электронной микроскопии в виде слоя мукополисахаридных микрофибрилл) и макрокапсулы (обнаруживают при световой микроскопии). У некоторых бактерий полимеры клеточной оболочки, выделяемые наружу, свободно располагаются вокруг неё, образуя слизистый слой. Капсулированные бактерии могут превращаться в бескапсульные варианты и, поскольку первые образуют мукоидные или гладкие (S), а бескапсульные — шероховатые (R) колонии, это явление известно как S- и R-диссоциация. Капсула и слизистый слой не препятствуют поступлению и выходу различных веществ из бактериальной клетки, а также плохо удерживают красители.
Окраска капсул бактерий. Для облегчения микроскопирования капсулы можно сделать видимыми, проведя негативную окраску мазка по Бурри-Гинсу или Хиссу либо с помощью реакции набухания по Нойфельду (см. ниже).
Состав капсул бактерий. В состав большинства бактериальных капсул входят сложные полисахарид ды. Капсулы также могут содержать соединения азота (например, у пневмококков капсула состоит из полисахаридов, глюкозамина и глюкуроновой кислоты), но могут и не содержать азот (например, капсулы лейконостоков состоят из декстрана, левулана, фруктозана и других полимеризованных моносахаров). Капсулы некоторых болезнетворных бактерий (например, Bacillus anthracis) формируют полисахариды и полипептиды, образованные мономерами D-глутаминовой кислоты. Поскольку D-аминокислоты устойчивы к воздействию протеаз, такая капсула лучше защищает бактерию от ферментативных воздействий фагоцитов.
Антигенные свойства капсул бактерий. Капсульные Аг (К-Аг) многих патогенных бактерий проявляют выраженные иммуногенные свойства (например, вакцины против пневмококковых и менингококковых инфекций готовят из материала капсулы). Связывание AT с капсулой изменяет её светопреломляющие характеристики, вызывая кажущееся набухание капсулы, видимое при соответствующих условиях освещения под микроскопом и известное как реакция Нойфельда.
Источник
Выявление капсул у бактерий методом бурри – гинса
Черную тушь смешивают с культурой, делают мазок препарата, как мазок крови и высушивают препарат.
После этого проводят фиксацию препарата химическим способом: смесью Никифорова или другими смесями.
Окрашивают тела микробных клеток карболовым фуксином Циля, разведенным 1:3, в течение 3-5 минут.
Препарат промывают водой, высушивают и микроскопируют с иммерсионной системой.
Оценка результата.На темном фоне препарата хорошо видны бесцветные капсулы, внутри которых находятся тела бактерий красного/ярко-малинового цвета.
Выявление спор у бактерии методом ожешко
На высушенный нефиксированный препарат (мазок готовится толстым и на краю стекла) наливают несколько капель 0,5% раствора хлористоводородной кислоты (HCl) и подогревают 1 — 2 мин над пламенем горелки/спиртовки до закипания, после чего остатки кислоты сливают.
Препарат (остывший) промывают водой, подсушивают и фиксируют над пламенем горелки/спиртовки.
Мазок окрашивают карболовым фуксином Циля (основной краситель) при нагревании до появления паров.
Обесцвечивают 5% раствором серной кислоты (дифференцирующее вещество) в течение нескольких секунд.
Докрашивают 3 — 5 мин метиленовым синим Леффлера (дополнительный краситель), высушивают и микроскопируют с иммерсией.
Оценка результатов. Споры бактерий окрашиваются в красный цвет, цитоплазма приобретает синий цвет, вегетативные тела микробных клеток – голубого цвета.
Выявление жгутиков у культуры подвижных микроорганизмов методом серебрения по морозову:
Прокаленной и охлажденной петлей слегка прикасаются к поверхности колоний или газонного роста микробной культуры, чтобы не вызвать механического повреждения жгутиков.
Полученный материал переносят в преципитационную пробирку, на дно которой налито 0,1 — 0,2 мл 1% раствора формалина. Петлю оставляют в неподвижном состоянии на несколько минут. За это время часть микробов переходит с петли в раствор. Эту процедуру повторяют 2-3 раза, пока жидкость не станет слабо опалесцировать.
Приготовленную взвесь ставят на 1 — 2 ч в термостат при 37 0 С для равномерного распределения микроорганизмов в жидкой среде.
Затем в пробирку с 1,5 — 2 мл дистиллированной воды вносят 1-2 капли формалиновой бактериальной взвеси. Через 10-15 мин, после того как бактерии относительно равномерно распределятся по всему объему жидкости, наносят 5-6 капель полученной взвеси на предметное стекло, не касаясь его петлей.
Капли высушивают на воздухе, не размазывая.
Для лучшего протравливания обрабатывают их реактивом № 1 (Реактив № 1:1 мл ледяной уксусной кислоты. 2 мл формалина, 100 мл дистиллированной воды) в течение 1 мин.
Остатки протравы сливают, мазок промывают водой.
После подсыхания мазка на препарат наливают реактив № 2 (Реактив № 2: 5 г танина, 1 мл жидкой карболовой кислоты, 100 мл дистиллированной воды), подогревают на лёгком пламени до появления паров (1 мин).
Тщательно промывают водой (1-2 мин).
10) На подсушенный после промывания препарат наносят реактив № 3 (Реактив № 3: 5 г кристаллического нитрата серебра растворяют в 100 мл дистиллированной воды, отливают 20 мл в другой сосуд, к оставшимся 80 мл раствора серебра по каплям добавляют раствор аммиака, пока не растворится образующийся осадок и не останется лёгкая опалесценция. Если аммиака будет слишком много, то из отлитых в другой сосуд 20 мл раствора серебра надо по каплям добавлять до получения нужной слабой опалесценции) и выдерживают его до появления тёмно- коричневой окраски мазка.
11) Тщательно промывают водой.
12) Высушивают и микроскопируют с иммерсионной системой.
Оценка результатов. Тела микробных клеток окрашиваются в коричневато-чёрный (угольно-черный) цвет, жгутики приобретают различные оттенки коричневого цвета и отчетливо видны на окрашенном в слабо-желтый цвет фоне.
Источник
Методы выявления капсул, жгутиков, спор
Для выявления некоторых бактерий и отдельных структур клеток применяют специальные методы окраски.
Окраска кислотоустойчивых бактерий по методу Циля-Нильсена:
1. На фиксированный мазок наносят карболовый раствор фуксина через полоску фильтровальной бумаги и подогревают до появления паров в течение 3-5 минут.
2. Снимают бумагу, промывают мазок водой.
3. На мазок наносят 5% раствор серной кислоты или 3% раствор солянокислого спирта на 1-2 минуты для обесцвечивания.
4. Промывают водой.
5. Докрашивают мазок водным раствором метиленового синего в течение 3-5 минут.
6. Промывают водой, высушивают и микроскопируют.
Выявление капсулы по методу Гинса:
1. На предметное стекло наносят каплю туши, а рядом – каплю исследуемого материала. Обе капли тщательно перемешивают и с помощью шлифованного стекла готовят мазок.
2. Мазок высушивают на воздухе и фиксируют на пламени горелки.
3. Мазок окрашивают фуксином в разведении 1:3 или сафранином. При этом бактерии окрашиваются в красный цвет, капсулы остаются неокрашенными и выделяются на темном фоне препарата.
Окраска жгутиков по Леффлеру:
1. Взвесь бактерий переносят в каплю воды, не перемешивают и высушивают.
2. Обрабатывают препарат 15-20 минут протравой (1 мл насыщенного спиртового раствора фуксина + смесь из 10 мл 25% водного раствора танина с 5 мл насыщенного водного раствора сернокислого железа).
3. Тщательно промывают водой и высушивают на воздухе.
4. Докрашивают фуксином Циля в течение 3-4 минут при легком подогревании.
5. Промывают водой, высушивают, микроскопируют.
Окраска спор по методу Ожешки:
1. На нефиксированный мазок наносят 0,5% раствор хлористоводородной кислоты и подогревают на пламени горелки в течение 2-3 минут.
2. Кислоту сливают, препарат промывают водой, просушивают и фиксируют над пламенем горелки.
3. Окрашивают препарат по Цилю-Нильсену. Споры бактерий при этом приобретают красный цвет, а вегетативные формы – синий.
Изучение микробов в живом состоянии
Клетки микроорганизмов в живом состоянии изучают методом раздавленной капли и методом висячей капли.
Метод раздавленной капли. На поверхность обезжиренного предметного стекла наносят каплю исследуемого материала или суспензию бактерий и покрывают ее покровным стеклом. Капля должна быть небольшой, не выходящей за края покровного стекла. Микроскопируют препарат с объективом х40. Метод раздавленной капли удобен для исследования подвижности бактериальных клеток, а также для изучения крупных микроорганизмов — плесневых грибов, дрожжей.
Метод висячей капли. Препарат готовят на покровном стекле, в центр которого наносят каплю бактериальной суспензии. Затем предметное стекло с лункой, края которого предварительно смазывают вазелином, прижимают к покровному стеклу так, чтобы капля находилась в центре лунки. Препарат переворачивают покровным стеклом вверх. В правильно приготовленном препарате капля должна свободно висеть над лункой, не касаясь ее дна или края. Для микроскопии используют вначале малый сухой объектив х8, под увеличением которого находят края капли, а затем устанавливают объектив х40 и исследуют препарат.
Контрольные вопросы по теме занятия:
1. Простые методы окраски микробов.
2. Сложные методы окраски микробов.
3. Сущность окраски микробов по Граму.
4. Техника окраски микробов по Граму.
5. Структура бактериальной клетки.
6. Методы обнаружения капсул, жгутиков, спор.
7. Методы изучения микробов в живом состоянии.
Литература для подготовки к занятию:
1. Медицинская микробиология, вирусология и иммунология. Под ред. А.А. Воробьева. М., 2004.
1. Л.Б. Борисов. Медицинская микробиология, вирусология, иммунология. М., 2002.
2. О.К. Поздеев. Медицинская микробиология. М., ГЭОТАР-МЕДИА, 2005.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник