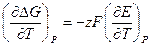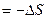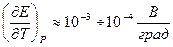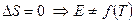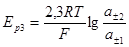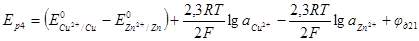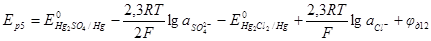6.10. Методы устранения диффузионного потенциала
Напряжение электрохимической системы с жидкостной границей между двумя электролитами определяется разностью электродных потенциалов с точностью до диффузионного потенциала.
Рис. 6.12. Устранение диффузионного потенциала с помощью электролитических мостиков
Вообще говоря, диффузионные потенциалы на границе двух электролитов могут быть довольно значительными и, во всяком случае, часто делают результаты измерений неопределенными. Ниже приведены значения диффузионных потенциалов для некоторых систем (в скобках указана концентрация электролита в кмоль/м 3 ):
Диффузионный потенциал, мВ
НС1(0,005) – НС1 (0,04)
КС1 (0,005) – КС1 (0,04)
NaCl (0,005) – NaCl (0,04)
LiCl (0,1) – LiCl (1,0) в диметилацетамиде
LiCl(0,l) – LiCl (1,0) в воде
В связи с этим диффузионный потенциал должен быть либо элиминирован, либо точно измерен. Элиминирование диффузионного потенциала достигается включением в электрохимическую систему дополнительного электролита с близкими значениями подвижностей катиона и аниона. При измерениях в водных растворах в качестве такого электролита применяют насыщенные растворы хлорида калия, нитрата калия или аммония.
Дополнительный электролит включают между основными электролитами с помощью электролитических мостиков (рис. 6.12), заполненных основными электролитами. Тогда диффузионный потенциал между основными электролитами, например в случае, изображенном на рис. 6.12, — между растворами серной кислоты и сульфата меди, заменяется диффузионными потенциалами на границах серная кислота — хлорид калия и хлорид калия — сульфат меди. При этом на границах с хлоридом калия электричество в основном переносится ионами К + и С1 – , которых много больше, чем ионов основного электролита. Поскольку подвижности ионов К + и С1 – в хлориде калия практически равны друг другу, то и диффузионный потенциал будет невелик. Если концентрации основных электролитов малы, то с помощью дополнительных электролитов диффузионный потенциал снижается обычно до значений, не превышающих 1 – 2 мВ. Так, в опытах Аббега и Кумминга установлено, что диффузионный потенциал на границе 1 кмоль/м 3 LiCl — 0,1 кмоль/м 3 LiCl равен 16,9 мВ. Если же между растворами хлорида лития включены дополнительные электролиты, то диффузионный потенциал снижается до следующих значений:
Дополнительный электролит Диффузионный потенциал системы, мВ
Элиминирование диффузионных потенциалов методом включения дополнительного электролита с равными числами переноса ионов дает хорошие результаты при измерениях диффузионных потенциалов в неконцентрированных растворах с мало отличающимися подвижностями аниона и катиона. При измерениях же напряжений систем, содержащих растворы кислот или щелочей
Таблица 6.3. Диффузионные потенциалы на границе КОН – КСl и NaOH – KCl (по данным В. Г. Локштанова)
Источник
Снижение диффузионного потенциала
¨ Наличие Δφд не позволяет проводить точные измерения э.д.с. электрохимических систем
¨ Для его уменьшения используют метод солевого моста
¨ Между двумя растворами помещают промежуточный концентрированный раствор электролита с близкими значениями подвижностей катионов и анионов. В этом случае одна граница между двумя растворами заменяется на две границы с меньшим потенциалом. Кроме того, потенциалы на этих границах будут меньшими по знаку.
¨ В качестве солевых мостов используют растворы KCl и NH4NO3.
5)Удельная, эквивалентная и молярная электропроводности электролитов. определение. Размерность. Закон Кольрауша. Практическое приложение з-на Кольрауша, определение Константы скорости эд.дис., ПР труднорастворимых солей, Кондуктометрическре титрование.
Удельная электропроводность – электропроводность раствора или расплава, заключенного между двумя электродами площадью по 1 м 2 , расстояние между которыми равно 1 м
R – электрическое сопротивление
G – электрическая проводимость (электропроводность)
G измеряется в Ом -1 или сименсах (См)
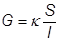
κ – удельная электропроводность (Ом -1 см -1 )
При увеличении концентрации сильного электролита удельная электропроводность увеличивается вследствие увеличения общего числа ионов в растворе. Дальнейший рост концентрации приводит к уменьшению подвижности ионов вследствие их взаимодействия друг с другом
Удельная электропроводность растворов слабых электролитов значительно ниже удельной электропроводности растворов сильных электролитов вследствие их малой степени диссоциации
Эквивалентная электропроводность L [в м 2 /(г-экв×Ом)] — это электропроводность объема раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 м друг от друга.
Зависимость l — 

l = l¥ — А
l¥ — предельная эквивалентная электропроводность при бесконечном разведении : с ® 0 , j ® ¥ .
l Или закон кубического корня при более высоких концентрациях
l = l¥ — B
Зависимость от т l(T)= l(T=0)*(1+αt+βt 2 )
Молярная
Λm — молярная электропроводность
Единицы измерения См∙м2∙моль-1
Молярная электропроводность – электропроводность раствора, содержащего 1 моль соответствующих ионов
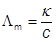

Закон Кольрауша
В бесконечно разбавленном растворе электролита перенос электричества осуществляется всеми ионами независимо друг от друга:
где λ+, λ– — подвижности ионов электролита Mv+Av–.
Из подвижностей ионов можно рассчитать молярную электропроводность электролита.
Часто в справочниках молярную электропроводность приводят не на 1 моль ионов, а на 1/z+или 1/z–ионов, например ½Ca 2+ .
Зависимость молярной электропроводности для слабых электролитов выражена более сильно, чем для сильных из-за уменьшения их степени диссоциации с ростом концентрации.
где α – степень диссоциации
3.6)Числа переноса и их экспериментальное определение методами движущейся границы и Гитторфа. Определение чисел переноса путём измерения диффузионного потенциала.
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов :
t+ = 
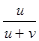



Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона.
Определение чисел переноса
Числа переноса зависят от природы электролита, его концентрации, температуры и т.д.
Для определения чисел переноса используют различные методы:
метод движущейся границы
Метод движущейся границы
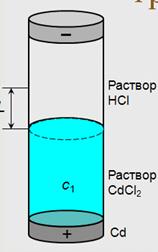
Если граница перемещается на расстояние L, то ионами Cd 2+ переносится с1LSz+FКл электричества.
Тогда
У электролитов должен быть один общий ион (Cl – )
Плотность нижнего раствора больше, чем плотность верхнего
Для сохранения границы между растворами подвижность иона в верхнем растворе должна превышать подвижность иона в нижнем (H + и Cd 2+ )
В методе используется различие в показателях преломления исследуемого и индикаторного растворов, и положение границы регистрируется специальной оптической системой.

Рассмотрим схему движения ионов (переноса электричества) в растворе HCl при электролизе. Разделим мысленно ванну с электролитом на три отделения : I — анодная часть (анолит), II — центральная часть, III — катодная часть (католит). В процессе электролиза в отделении II концентрация электролита не изменяется, в отделениях I и III — изменяется. Отношение убыли электролита у анода Dса и убыли электролита у катода Dск, Dса/Dск равно отношению абсолютных скоростей катиона и аниона и равно отношению их подвижностей.
t+ = 
Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса ; они не являются истинными, т.к. этот метод не учитывает сольватации ионов.
Источник
Методы устранения диффузионного скачка потенциала
а) солевой мостик, принцип действия – 2 противоположно направленных скачка потенциала, компенсирующих друг друга
б) введение в контактирующие р-ры индифферентного эл-та
в) элементы с одним эл-том
Зависимость ЭДС гальванического эл-та от температуры
1. Уравнение, определяющее зависимость
а) 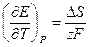
б) анализ: 
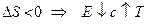
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
МЕТОДЫ УСТРАНЕНИЯ ДИФФУЗИОННОГО ПОТЕНЦИАЛА
Напряжение электрохимической системы с жидкостной границей между двумя электролитами определяется разностью электродных потенциалов с точностью до диффузионного потенциала.
Рис. 6.12. Устранение диффузионного потенциала с помощью электролитических мостиков
Вообще говоря, диффузионные потенциалы на границе двух электролитов могут быть довольно значительными и, во всяком случае, часто делают результаты измерений неопределенными. Ниже приведены значения диффузионных потенциалов для некоторых систем (в скобках указана концентрация электролита в кмоль/м 3 ):
| Диффузионный потенциал, мВ | |
| НС1(0,005) – НС1 (0,04) | 33.3 |
| КС1 (0,005) – КС1 (0,04) | -1.0 |
| NaCl (0,005) – NaCl (0,04) | -11.1 |
| LiCl (0,1) – LiCl (1,0) в диметилацетамиде | 38.0 |
| LiCl(0,l) – LiCl (1,0) в воде | 16.9 |
В связи с этим диффузионный потенциал должен быть либо элиминирован, либо точно измерен. Элиминирование диффузионного потенциала достигается включением в электрохимическую систему дополнительного электролита с близкими значениями подвижностей катиона и аниона. При измерениях в водных растворах в качестве такого электролита применяют насыщенные растворы хлорида калия, нитрата калия или аммония.
Дополнительный электролит включают между основными электролитами с помощью электролитических мостиков (рис. 6.12), заполненных основными электролитами. Тогда диффузионный потенциал между основными электролитами, например в случае, изображенном на рис. 6.12, — между растворами серной кислоты и сульфата меди, заменяется диффузионными потенциалами на границах серная кислота — хлорид калия и хлорид калия — сульфат меди. При этом на границах с хлоридом калия электричество в основном переносится ионами К + и С1 – , которых много больше, чем ионов основного электролита. Поскольку подвижности ионов К + и С1 – в хлориде калия практически равны друг другу, то и диффузионный потенциал будет невелик. Если концентрации основных электролитов малы, то с помощью дополнительных электролитов диффузионный потенциал снижается обычно до значений, не превышающих 1 – 2 мВ. Так, в опытах Аббега и Кумминга установлено, что диффузионный потенциал на границе 1 кмоль/м 3 LiCl — 0,1 кмоль/м 3 LiCl равен 16,9 мВ. Если же между растворами хлорида лития включены дополнительные электролиты, то диффузионный потенциал снижается до следующих значений:
Дополнительный электролит Диффузионный потенциал системы, мВ
Элиминирование диффузионных потенциалов методом включения дополнительного электролита с равными числами переноса ионов дает хорошие результаты при измерениях диффузионных потенциалов в неконцентрированных растворах с мало отличающимися подвижностями аниона и катиона. При измерениях же напряжений систем, содержащих растворы кислот или щелочей
Таблица 6.3. Диффузионные потенциалы на границе КОН – КСl и NaOH – KCl (по данным В. Г. Локштанова)
| KOH – KCl (насыщ.) | NaOH – KCl (насыщ.) | KOH – KCl (насыщ.) | NaOH – KCl (насыщ.) | ||||
| KOH кмоль/м 3 | φд, мВ | NaOH кмоль/м 3 | φд, мВ | KOH кмоль/м 3 | φд, мВ | NaOH кмоль/м 3 | φд, мВ |
| 1,0 4,2 9,1 | 1,0 4,0 8,5 | 15,2 20,4 | 13,3 19,4 |
с очень различными скоростями движения катиона и аниона, следует быть особенно осторожными. Например, на границе НС1 — КС1 (насыщ.) диффузионный потенциал не превышает 1 мВ, только если концентрация раствора НС1 ниже 0,1 кмоль/м 3 . В противном случае диффузионный потенциал быстро увеличивается. Аналогичное явление наблюдается и для щелочей (табл. 6.3). Так, диффузионный потенциал, например в системе
4,2 кмоль/м 3 20,4 кмоль/м 3
составляет 99 мВ, и в данном случае с помощью солевого мостика нельзя добиться значительного его снижения.
Для снижения диффузионных потенциалов до пренебрежимо малых значений Нернст предложил добавлять в контактирующие растворы большой избыток какого-нибудь индифферентного для данной системы электролита. Тогда диффузия основных электролитов уже не будет приводить к возникновению существенного градиента активности на границе раздела, а следовательно, и диффузионного потенциала. К сожалению, добавка индифферентного электролита изменяет активность ионов, участвующих в по-тенциалопределяющей реакции, и приводит к искажению результатов. Поэтому этим методом можно пользоваться только в тех
случаях, когда добавка индифферентного электролита не может повлиять на изменение активности или это изменение может быть учтено. Например, при измерении напряжения системы Zn | ZnSO4 | CuSO4 | Cu, в которой концентрации сульфатов не ниже 1,0 кмоль/м 3 , добавка сульфата магния для снижения диффузионного потенциала вполне допустима, ибо при этом средние ионные коэффициенты активности сульфатов цинка и меди практически не изменятся.
Если при измерении напряжения электрохимической системы диффузионные потенциалы не элиминируются или должны быть измерены, то прежде всего следует позаботиться о создании устойчивой границы соприкосновения двух растворов. Непрерывно обновляющуюся границу создают путем медленного направленного движения растворов параллельно друг другу. Таким образом можно добиться стабильности диффузионного потенциала и его воспроизводимости с точностью до 0,1 мВ.
Диффузионный потенциал определяют по методу Коэна и Том-брока из измерений напряжений двух электрохимических систем, причем электроды одной из них обратимы к катиону соли, а другой — к аниону. Допустим, нужно определить диффузионный потенциал на границе ZnSO4(a1)/ZnSO4(a2). Для этого измеряем напряжения следующих электрохимических систем (примем, что а1
Напряжение системы З
Следовательно, разность напряжений систем 1 и 3 выразится уравнением:
Если, как и раньше, отношение активностей ионов цинка заменить отношением средних ионных активностей соли цинка, по- лучим:
Поскольку последний член этого уравнения обычно поддается точному расчету, из измерений Ер1 и Ep3 можно определить значение диффузионного потенциала.
Аналогичным образом определяют диффузионный потенциал на границе двух разных растворов. Например, если хотят определить диффузионный потенциал на границе растворов сульфата цинка и хлорида меди, составляют две электрохимические си-стемы:
Напряжение системы 4
Естественно, что чем большее число членов входит в уравнение для диффузионного потенциала, тем меньше вероятность большой точности определения.
Источник