Способ стерилизации питательных сред содержащих углеводы
Известно много способов стерилизации, которые разделяют на две основные группы: термическую и холодную стерилизацию.
а) Термическая стерилизация. Наиболее широко используются:
— стерилизация насыщенным паром под давлением (автоклавирование);
— стерилизация текучим паром;
— тиндализация.
Стерилизация насыщенным паром под давлением (автоклавирование) и ее контроль. Большинство сред стерилизуют автоклавированием, но при различных режимах в зависимости от их состава. Это один из наиболее эффективных методов, основанных на прогревании субстрата насыщенным паром в автоклавах — аппаратах, работающих под давлением выше атмосферного, так как с повышением давления пара повышается и его температура.
Совместное действие высокой температуры и пара обеспечивает надежность стерилизации. Среды, предназначенные для стерилизации в автоклаве, разливают в посуду не более чем на 1/2 емкости и закрывают ватно-марлевыми и резиновыми пробками, которые завальцовывают.
Наиболее часто используемый режим стерилизации +121 °С в течение 15 мин (тиогликолевая среда, МПА, МПБ, бульон Хоттингера, агар Хоттингера и др.). Питательные среды, в составе которых имеются термолабильные вещества, стерилизуют при более низких температурах и давлении. Так, например, режим 112°С в течение 20 мин используется для сред, содержащих углеводы (среды Гисса), витамины, молоко, желатин, режим 110°С в течение 30 мин — для среды Тароцци (содержит углеводы и мясной фарш), режим 100 °С в течение 15 мин — для среды с мочевиной.
При выборе режима стерилизации необходимо учитывать не только состав среды, но и ее pH. При значительных отклонениях pH от нейтрального уровня полимерные компоненты среды могут подвергаться гидролизу. Так, например, в среде с pH ниже 6,0, содержащей желатин, происходит нентонизация последнего, и среда не затвердевает даже при охлаждении, а при pH ниже 5,0 гидролизуется агар, утрачивая свойство образовывать плотный гель.
При стерилизации среды, имеющей щелочную реакцию, карамелизуются углеводы, выпадают в осадок соли некоторых металлов.
Чтобы избежать подобных явлений, желательно стерилизовать среды при нейтральном значении pH, а после автоклавирования подкислить или подщелочить их стерильными растворами кислот или щелочей соответственно.
Для коммерческих питательных сред режим стерилизации указывается в инструкциях по их применению.
Стерилизация текучим паром применяется для сред, содержащих вещества, разлагающиеся при температуре выше 100 °С (аммиачные соли, молоко, желатин, картофель, некоторые углеводы). Стерилизацию проводят в автоклаве при открытом спускном кране и незавинченной крышке или в аппарате Коха по 15-30 мин в течение 3 дней подряд. При первом сеансе погибают вегетативные формы микроорганизмов, но споры сохраняются и прорастают в вегетативные особи в процессе хранения среды при комнатной температуре в промежутках между сеансами. Последующие сеансы достаточно надежно обеспечивают стерильность среды.
Тиндализация применяется для стерилизации питательных сред, имеющих в своем составе легко разрушающиеся при высокой температуре компоненты (сыворотки, витамины).
Прогревание стерилизуемой среды производят на водяной бане, снабженной терморегулятором, по 1 ч при температуре 60-65 °С в течение 5 дней или при 70-80 °С в течение 3 дней. В промежутках между прогреваниями среды выдерживают при температуре 25-27 °С для прорастания спор в вегетативные формы, которые погибают при последующих прогреваниях.
Эффективность тиндализации, как и стерилизации текучим паром, зависит от того, прорастут ли споры. Поэтому она не достигает цели, если споры находятся в среде, непригодной для роста или содержащей ингибиторы роста, либо среда в промежутках между нагревами инкубируется при температуре, неблагоприятной для прорастания спор.
После стерилизации среды охлаждают до 45-50 °С и разливают, соблюдая правила асептики, в стерильные чашки, обычно по 15-20 мл, что соответствует высоте слоя 0,25-0,30 см. Чем толще слой, тем менее контрастно выглядят колонии. При тонком же слое ухудшается рост микроорганизмов в связи с поступлением меньшего количества питательных веществ. Среда должна быть равномерно распределена по дну чашки, не содержать пузырьков воздуха. Необходимым условием получения изолированных колоний является отсутствие конденсата на поверхности питательной среды.
Для этого перед посевом среду необходимо подсушить, поместив открытые чашки со средой в термостат и выдержав при температуре 37 °С в течение 40-60 мин.
б) Холодная стерилизация. Основными способами холодной стерилизации являются различные типы фильтрования и облучения. Такой стерилизации подвергаются растворы веществ, которые при нагревании разрушаются или существенно изменяют свои свойства, например, многие витамины, антибиотики, ферменты,, сыворотки и др.
в) Стерилизация фильтрованием. Для стерилизации фильтрованием используют фильтры, изготовляемые из материалов с различными физико-химическими свойствами, разной пропускной и адсорбционной способностью (мембранные, асбестовые, стеклянные, фарфоровые). Этот способ применяют для аминокислот, в частности триптофана, глутамина и аспарагина, которые являются высоко лабильными, и но этой причине их нельзя нагревать, в связи с чем стерилизацию проводят путем ультрафильтрования.
г) Стерилизация облучением. В целях стерилизации используют УФ-облучение с длиной волны 254 нм, однако его применение ограничено из-за малой проникающей способности. От УФ-лучей микроорганизмы могут быть защищены органическими веществами, пылью, стеклом или другим покрытием, а гибель микробных клеток вызывает только непосредственное и продолжительное воздействие. В силу этого УФ-облучению с целью стерилизации подвергают биологические жидкости, разлитые тонким слоем, например кровь, плазму, вакцины.
Гамма-лучи, обладающие высокой проникающей способностью, могут быть использованы для стерилизации жидких и плотных питательных сред, различных биологических жидкостей и растворов. Однако в связи со специфическими требованиями по технике безопасности при работе с источниками этих излучений, а также с высокой стоимостью они используются в практике работы только крупных предприятий.
Редактор: Искандер Милевски. Дата публикации: 20.05.2019
Источник
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
- Вы здесь:
- Библиотека технолога
- Пиво и напитки
- Г.С. Качмазов — Дрожжи бродильных производств
5. МЕТОДЫ СТЕРИЛИЗАЦИИ ПОСУДЫ И ПИТАТЕЛЬНЫХ СРЕД
Основываясь на влиянии внешних условий на микроорганизмы, в микробиологической практике разработан ряд приемов, приводящих микроорганизмы к гибели. Одним из таких приемов является стерилизация.
Под стерилизацией (обеспложиванием) понимают полное уничтожение микроорганизмов и их спор в питательных средах, посуде, на инструментах и других предметах лабораторного оборудования. Для их стерильности наиболее часто пользуются воздействием высокой температуры.
5.1. СТЕРИЛИЗАЦИЯ ОБЖИГАНИЕМ НА ПЛАМЕНИ ГОРЕЛКИ
Небольшие стеклянные (палочка, шпатель) и металлические (игла, петля, пинцет, скальпель) предметы проводят несколько раз через пламя горелки. Стерилизация достигается обугливанием находящихся на их поверхности микроорганизмов. Обжиганием на пламени пользуются и для стерилизации поверхности ватных пробок.
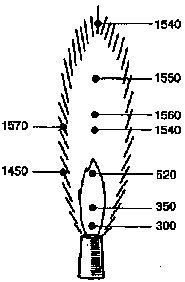
Рис. 14
Значение температуры в разных
участках пламени газовой горелки
5.2. СТЕРИЛИЗАЦИЯ КИПЯЧЕНИЕМ
Стерилизацию металлических инструментов и резиновых трубок проводят кипячением. Так как споры некоторых бактерий сохраняют жизнеспособность при кипячении в воде в течение нескольких часов, то рекомендуется стерилизацию кипячением проводить в 2%-ном растворе карбоната натрия в течение 10 мин. В этих условиях споры погибают.
5.3. СТЕРИЛИЗАЦИЯ СУХИМ ЖАРОМ
Сухим жаром стерилизуют стеклянную посуду. При этом пробирки, колбы предварительно закрывают ватными пробками. Чтобы избежать заражения простерилизованных предметов из воздуха, их перед стерилизацией заворачивают в оберточную бумагу и вынимают только перед работой.
Пипетки перед стерилизацией с концов закрывают ватой. Затем их обертывают длинными полосками бумаги шириной 3,5–4 см. Бумагу наматывают по спирали, начинная с конца пипетки, который будет погружен в среду. Концы обертки закрепляют ниткой. Тонкие пипетки обертывают бумагой вместе по несколько штук.
Чашки Петри заворачивают в бумагу в форме квадрата, сторона которого приблизительно равна трем диаметрам чашки. Чашку Петри помещают на середину листа, загибают его с двух противоположных сторон кверху так, чтобы края налегали друг на друга. Два свободных конца загибают вниз. При таком обертывании у чашек легко различать верх и низ.
Подготовленную таким образом посуду помещают в сушильный шкаф, в котором нагревают ее при температуре 160–170°С в течение 2 ч (с момента установления нужной температуры). При таком нагревании погибают не только бактерии, но и их споры.
Температуру в сушильном шкафу выше 175°С допускать не следует, так как при этом ватные пробки буреют, а бумажная обертка становится ломкой.
5.4. СТЕРИЛИЗАЦИЯ ТЕКУЧИМ ПАРОМ (ДРОБНАЯ СТЕРИЛИЗАЦИЯ), ИЛИ ТИНДАЛИЗАЦИЯ
Питательные среды, воду, резиновые трубки и другие предметы, портящиеся от действия сухого жара, и питательные среды, портящиеся под действием высокой температуры (среды, содержащие молоко, солод, желатину), обеспложивают действием текучего пара.
Стерилизацию текучим паром производят в кипятильнике Коха или в автоклаве с открытым вентилем. Воду в них доводят до кипения, и образующийся пар обтекает стерилизуемые объекты. Температура стерилизуемых питательных сред достигает 100°С. Нагревание в течение 30–45 мин приводит к гибели вегетативных клеток бактерий, но споры их не погибают. Затем жидкость охлаждают до температуры, благоприятной для прорастания спор (до 30°С). Нагревание приводит к активации спор и более быстрому их прорастанию. На следующий день нагревание повторяют. При этом погибают вегетативные клетки, развившиеся из спор. Для обеспечения полной стерильности жидкость оставляют еще на сутки и снова повторяют нагревание. Такую стерилизацию называют дробной или тиндализацией.
5.5. ПАСТЕРИЗАЦИЯ
В основе пастеризации лежит нагревание жидкостей до температуры меньше 100°С. Целью ее является уничтожение неспороносных бактерий в жидкостях, теряющих питательные свойства при кипячении (молоко, пиво, вино и др.). Осуществляется пастеризация путем нагревания жидкостей при 60°С в течение 30 мин, или при 75°С в течение 15 мин, или при 80°С в течение 10 мин.
5.6. ХОЛОДНАЯ СТЕРИЛИЗАЦИЯ
Органические жидкости, не выносящие нагревания, освобождают от бактерий, пропуская через стерильные мелкопористые фильтры. Эти фильтры задерживают микроорганизмы, их называют бактериальными фильтрами.
Бактериальные фильтры имеют разные номера. Фильтры № 1 имеют средний диаметр пор 0,3 мкм и являются наиболее надежными. Фильтры № 5 имеют самые большие отверстия пор, диаметром 1,2 мкм.
Перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в теплую дистиллированную воду и кипятят 30 мин, меняя 2– 3 раза воду.
5.7. СТЕРИЛИЗАЦИЯ ПАРОМ ПОД ДАВЛЕНИЕМ (АВТОКЛАВИРОВАНИЕ)
Наиболее надежным и универсальным методом стерилизации питательных сред и материалов является стерилизация их насыщенным паром под давлением. Производят ее в автоклаве, в котором стерилизуемые объекты нагревают чистым насыщенным паром при давлении выше атмосферного. Когда насыщенный пар встречается с более холодным объектом, он конденсируется, превращаясь в воду. При конденсации выделяется большое количество теплоты, и температура стерилизуемого объекта быстро повышается.
Полная стерилизация питательных сред при 120°С и давлении 0,1 МПа обеспечивается нагреванием в течение 20 мин.
5.7.1. ПРАВИЛА РАБОТЫ С АВТОКЛАВОМ
Стерилизация в автоклаве производится при повышенном давлении, поэтому работа с ним требует определенной осторожности. Исправность автоклава в определенные сроки проверяют специалисты, которые устанавливают следующий срок проверки.
Системы автоклавов различаются, но все они имеют общие принципы устройства (рис. 15), и правила работы с ними однотипны.
Во внутренний котел автоклава (стерилизационную камеру) помещают материал, подлежащий стерилизации.
В водопаровую камеру наливают воду с таким расчетом, чтобы уровень ее в водомерной трубке был между верхней (максимальной) и нижней (минимальной) чертой.
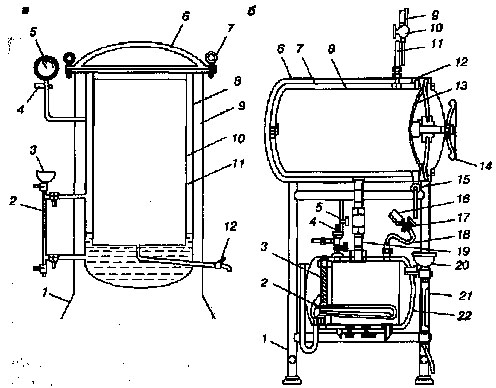
Рис. 15
Устройство автоклавов:
а – вертикальный автоклав: 1 – подставка, 2 – водомерная трубка, 3 – воронка, 4 – предохранительный клапан, 5 – манометр, 6 – крышка, 7 – винтовые зажимы, 8 – котел, 9 – кожух, 10 – камера стерилизации, 11 – водопаровая камера, 12 – паровыпускной клапан;
б – горизонтальный автоклав: 1 – постамент, 2 – нагревательный элемент. 3 – крышка котла, 4 – предохранительный клапан, 5 – вентиль, 6 – кожух, 7 – паровая камера, 8 – стерилизационная камера, 9 – манометр паровой камеры, 10 – трехходовой кран, 11 – сифонная трубка паровой камеры, 12 – опорное кольцо, 13 – крышка паровой камеры, 14 – штурвал, 15 – впускной кран,
16 – манометр котелка, 17 – трехходовой кран котелка, 18 – сифонная трубка котелка, 19 – патрубок, 20 – воронка, 21 – водоуказательная колонка, 22 – котелок.
Крышку автоклава привинчивают болтами к корпусу. Завинчивают болты попарно, крест-накрест, чтобы избежать перекоса крышки, который может возникнуть при завинчивании болтов по кругу.
Открывают краны и включают источник обогрева. Когда пар из выпускного крана начинает выходить непрерывной струей, его закрывают и наблюдают за постепенным повышением давления в рабочей камере по манометру.
Отсчет времени стерилизации начинают с того момента, когда в автоклаве установится заданное давление.
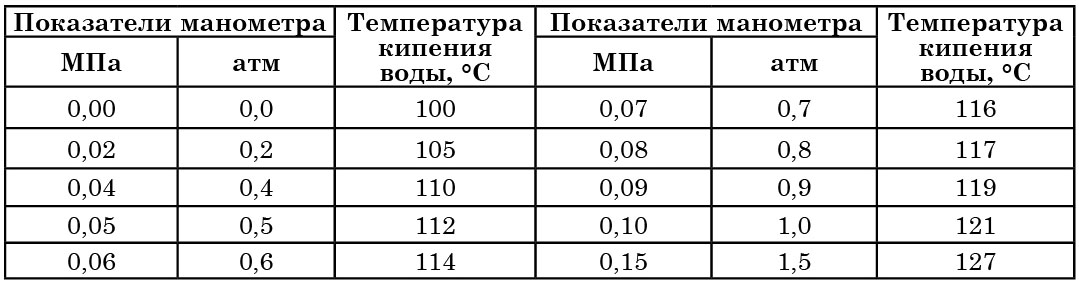
Зависимость давления и температуры в камере автоклава
Между показаниями манометра и температурой кипения воды имеется определенная зависимость (табл. 5). Время от времени эти соотношения следует проверять. Нарушение их указывает на неисправность автоклава и на необходимость его ремонта.
Проверку осуществляют следующим образом: в стерилизационную камеру автоклава помещают 100 г бензойной кислоты с добавлением небольшого количества фуксина или метиленового синего. Если при показании манометра в 0,1 МПа бензойная кислота расплавится, образуя с красителем сплав, то, значит, автоклав дает нужную температуру (120°С).
После окончания заданного срока стерилизации источник нагрева выключают, перекрывают вентиль водопаровой камеры и только после этого постепенно открывают выпускной клапан. При быстром выпускании пара могут быть вырваны ватные пробки из стерилизуемой посуды.
После полного выхода пара отвинчивают болты крышки (снова крест-накрест) и открывают ее, ориентируя крышку на себя для защиты от выходящего пара.
Если во время стерилизации давление начинает подниматься выше заданного уровня, его регулируют, уменьшая нагрев или выпуская часть пара через предохранительный клапан. Последний должен быть отрегулирован так, чтобы при повышении давления излишек пара выходил автоматически.
Источник