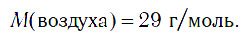Химический практикум для учащихся медико-биологических классов краснодар
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Если для опыта необходима сухая газоотводная трубка, то поступают следующим образом. На свободный конец газоотводной трубки надевают резиновую трубку со стеклянным наконечником. При испытании герметичности прибора намокнет съемный наконечник, а газоотводная трубка останется сухой.
Собрать газ в сосуд можно разными методами. Наиболее распространенны два – метод вытеснения воздуха и метод вытеснения воды. Каждый из них имеет свой достоинства и недостатки, и выбор метода во многом обусловлен свойствами того газа, который нужно собрать.
Метод вытеснения воздуха
Этим методом можно собрать любой газ, но здесь возникает проблема точного определения того момента, когда весь воздух из сосуда-приемника будет вытеснен собираемым газом.
Прежде чем собирать газ вытеснением воздуха, необходимо выяснить, тяжелее он или легче воздуха. От этого будет зависеть положение сосуда-приемника (рис.). Для этого рассчитывают относительную плотность газа по воздуху по формуле: D возд. (X) = Mr(X)/29, где Mr – относительная молекулярная масса собираемого газа, 29 – относительная молекулярная масса воздуха. Если рассчитанная величина окажется меньше единицы, то газ легче воздуха, и сосуд-приемник нужно располагать отверстием вниз (рис. 57, а). Если же относительная плотность газа по воздуху больше единицы, то газ тяжелее воздуха, и сосуд-приемник следует располагать отверстием вверх (рис. 57,б).
Рис. 57. Положение сосуда-приемника (1): а – для газа, который легче воздуха; б – для газа, который тяжелее воздуха.
Контролировать наполнение сосуда можно по-разному в зависимости от того, какой газ собирают. Например, окрашенный оксид азота(IV) легко обнаружить по красно-бурому цвету. Для обнаружения кислорода используют тлеющую лучинку, которую подносят к краю сосуда, но не вносят внутрь.
Метод вытеснения воды.
При использовании этого метода значительно легче контролировать наполнение сосуда-приемника газом. Однако этот метод имеет серьезное ограничение – его нельзя использовать, если газ растворяется в воде или вступает с ней в реакцию .
Для собирания газа вытеснением воды необходимо иметь широкий сосуд, например кристаллизатор, наполненный на 2/3 водой. Сосуд-приемник, например пробирку, наполняют доверху водой, закрывают пальцем, быстро переворачивают вверх дном и опускают в кристаллизатор. Когда отверстие пробирки окажется под водой, отверстие пробирки открывают и вводят в пробирку газоотводную трубку (рис. 58).
Рис. 58. Прибор для собирания газа методом вытеснения воды: 1 – пробирка-приемник, наполненная водой; 2 – кристаллизатор.
После того, как вся вода будет вытеснена из пробирки газом, отверстие пробирки закрывают под водой пробкой и извлекают из кристаллизатора.
Если газ, который собирают методом вытеснения воды, получают при нагревании, нужно неукоснительно соблюдать следующее правило:
Нельзя прекращать нагревание пробирки с исходными веществами, если газоотводная трубка находится под водой!
Оформление результатов эксперимента
Форма записи результатов, полученных при выполнении химического эксперимента, никем не регламентирована. Но протокол эксперимента обязательно должен включать следующие пункты: название эксперимента и дату его проведения, цель эксперимента, перечень оборудования и реактивов, которые были использованы, рисунок или схему прибора, описание действий, которые были выполнены в ходе работы, наблюдения, уравнения протекающих реакций, расчеты, если они производились при выполнении работы, выводы.
Форма отчета о проведенной практической работе.
Запишите дату проведения эксперимента и название опыта.
Сформулируйте самостоятельно цель эксперимента.
Кратко запишите все, что вы делали.
Выполните рисунок опыта или нарисуйте прибор, которым вы пользовались. Старайтесь, чтобы рисунок получился четким. Обязательно сделайте к рисунку пояснительные надписи. Для изображения окрашенных веществ используйте цветные карандаши или фломастеры.
Запишите свои наблюдения, т.е. опишите условия протекания и признаки химических реакций.
Составьте уравнения всех химических реакций, которые произошли в ходе эксперимента. Не забудьте расставить коэффициенты.
Сделайте вывод из опыта (или работы).
Оформить отчет о работе можно как последовательное описание действий и наблюдений, или в виде таблицы:
При решении экспериментальных задач, связанных с распознаванием и идентификацией веществ, отчет удобно оформлять в виде другой таблицы:
Тема 1. Основные понятия и законы химии.
Примеры физических явлений .
Опыт № 1. Нагревание стекла (стеклянной трубки)
в пламени спиртовки.
Оборудование и реактивы: стеклянная трубка, спиртовка, спички, асбестовая сетка.
Инструкция к выполнению опыта.
1. Возьмите стеклянную трубку за ее концы двумя руками.
2. Внесите среднюю часть трубки в пламя спиртовки. Помните, что верхняя часть пламени самая горячая.
3. Вращайте трубку, не вынося из пламени спиртовки (рис. 59).
4. Когда стекло сильно накалится (через 3–4 минуты), попытайтесь трубку согнуть, не прилагая чрезмерных усилий.
Рис. 59. Сгибание стеклянной трубки.
Положите стеклянную трубку на асбестовую сетку. Будьте осторожны: горячее стекло по внешнему виду не отличается от холодного!
6. Запишите свои наблюдения и сделайте вывод, ответив на вопросы:
1) Изменилось ли стекло?
2) Получилось ли новое вещество при нагревании стеклянной трубки?
3) Какое это явление: физическое или химическое?
Опыт № 2. Плавление парафина.
Оборудование и реактивы: тигель или стеклянная пластина, спиртовка, спички, тигельные щипцы или пробиркодержатель, асбестовая сетка, парафин.
Инструкция к выполнению опыта.
1. Положите небольшой кусочек парафина в тигель (или на стеклянную пластину).
2. Возьмите тигель (или стеклянную пластину) тигельными щипцами (или укрепите его в держателе для пробирок).
3. Внесите тигель с парафином (или стеклянную пластину) в верхнюю часть пламени спиртовки. Внимательно наблюдайте за происходящими изменениями.
4. После расплавления парафина поставьте тигель (или стеклянную пластину) на асбестовую сетку и погасите спиртовку.
5. Когда тигель (или стеклянная пластина) охладится, рассмотрите вещество, которое находится в тигле (или на стеклянной пластине).
6. Запишите свои наблюдения и сделайте вывод, ответив на вопросы:
1) Изменился ли парафин?
2) Получилось ли новое вещество при нагревании парафина?
3) Какое это явление: физическое или химическое?
Примеры химических явлений.
Опыт № 3. Прокаливание медной пластинки или проволоки
в пламени спиртовки.
Оборудование и реактивы: спиртовка, спички, тигельные щипцы или пробиркодержатель, асбестовая сетка, медная проволока или пластина.
Инструкция к выполнению опыта.
1. Возьмите медную пластину (или медную проволоку) тигельными щипцами.
2. Внесите медную пластину в верхнюю часть пламени спиртовки и накалите ее.
3. Через 1-2 минуты выньте пластину из пламени и счистите с нее ножом или лучинкой образовавшийся черный налет на чистый лист бумаги.
4. Повторите нагревание и снова счистите получившийся налет.
5. Сравните образовавшейся черный налет с медной пластинкой.
6. Запишите свои наблюдения и сделайте вывод, ответив на вопросы:
1) Изменилась ли медная пластинка при накаливании?
2) Образовалось ли новое вещество при накаливании медной пластинки?
3) Какое это явление: физическое или химическое?
Опыт № 4. Действие соляной кислоты на мел или мрамор.
Оборудование и реактивы: химический стакан объемом 50 мл, мрамор (мелкие кусочки или крошка), раствор соляной кислоты (1: 3), спички.
Инструкция к выполнению опыта.
1. В химический стакан поместите 2-3 небольших кусочка мрамора величиной с горошину. Будьте осторожны: не разбейте дно стакана.
2. Налейте в стакан столько соляной кислоты, чтобы кусочки мрамора были полностью покрыты ею. Что наблюдаете?
3. Зажгите спичку и внесите ее в стаканчик. Что наблюдаете?
4. Выполните рисунок опыта, запишите свои наблюдения.
6. Сделайте вывод, ответив на вопросы:
1) Образовалось ли новое вещество при приливании соляной кислоты к мрамору? Какое это вещество?
2) Почему потухла спичка?
3) Какое это явление: физическое или химическое?
Источник
Урок №24. Практическая работа №3. Получение и свойства кислорода
Цель работы : Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Необходимое оборудование и реактивы
штатив лабораторный с лапкой или пробиркодержатель;
два химических стакана;
пробка с газоотводной трубкой;
ложка для сжигания веществ;
перманганат калия (твердый) KMnO 4 ;
известковая вода — Са(ОН) 2.
Меры предосторожности
Работа со спиртовкой:
Не переносите горящую спиртовку с места на место.
Гасите спиртовку только с помощью колпачка.
При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
Дно пробирки должно находиться в верхней части пламени.
Дно пробирки не должно касаться фитиля.
Работа со стеклом:
Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке. Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть
Проверка прибора на герметичность:
Закройте пробирку пробкой с газоотводной трубкой, опустите конец трубки в стакан с водой. Плотно обхватите ладонью пробирку и внимательно следите за появлением пузырьков воздуха.
Загрузите по очереди два следующих видео — опыта и внимательно наблюдайте за экспериментом:
1. Получение кислорода (нажмите «Посмотреть опыт»)
Кислород( O 2 ) в лаборатории получают разложением перманганата калия KMnO 4 (марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑
Чистый кислород впервые получили независимо друг от друга шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли (при разложении оксидов ртути и свинца). До их открытия ученые считали, что воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород. Кислород — необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
2. Обнаружение кислорода
Кислород поддерживает горение — это свойство кислорода используется для его обнаружения
Кислород активно взаимодействует со многими веществами. Посмотрим, как реагирует кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати процентов по объему. В колбе с кислородом уголь раскаляется. Горение углерода становится интенсивным. При сгорании углерода образуется углекислый газ:
С+О 2 = СО 2
Добавим в колбу с газом известковую воду – она мутнеет. Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить подачу кислорода в зону горения.
Источник
Урок 15. Воздух как смесь газов
В уроке 15 «Воздух как смесь газов» из курса «Химия для чайников» мы выясним из чего состоит воздух; узнаем о получении, собирании и хранении газов, а также об их герметичности.
Вы уже знаете, что вещества могут находиться в различных агрегатных состояниях: газообразном, жидком и твердом.
В окружающей нас природе многие вещества при обычных условиях находятся в газообразном состоянии. Прежде всего, это компоненты воздушной оболочки Земли — атмосферы. Очень много газов растворено в водах Мирового океана. Во время извержения вулканов в атмосферу также выбрасывается большое количество вулканических газов. В недрах нашей планеты хранятся огромные запасы природного газа.
Атмосфере принадлежит важнейшая роль в жизни человека, животных и растений. Ее исследованиям были посвящены труды многих ученых прошлого. С давних времен был известен лишь один вид газа — воздух. При этом он изучался в основном физиками и интереса у химиков не вызывал. Лишь во второй половине XVIII в. было установлено, что воздух представляет собой смесь газов.
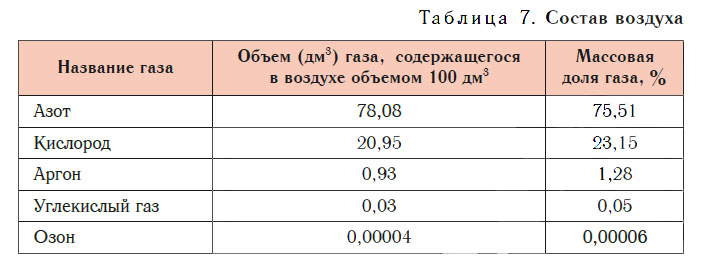
Состав воздуха
Основные компоненты воздуха — азот и кислород. При нормальных условиях в воздухе объемом 100 дм 3 содержится азот объемом около 78 дм 3 и кислород объемом около 21 дм 3 , а на долю всех остальных газов приходится около 1 дм 3 . В заметных количествах в воздухе присутствуют аргон, углекислый газ, озон и другие газы (табл. 7).
Для решения некоторых задач и проведения расчетов в физике, химии, технике очень удобно рассматривать воздух не как смесь газов, а как одно газообразное вещество. Экспериментальным путем можно установить, что при нормальных условиях масса воздуха объемом 22,4 дм 3 равна 29 г. Поскольку такой объем при н. у. занимает любой газ химическим количеством 1 моль, то молярную массу воздуха можно условно считать равной 29 г/моль:
Все газы, молярная масса которых меньше 29 г/моль, принято называть газами легче воздуха (например, водород H2, аммиак NH3, угарный газ CO, метан CH4), а газы, у которых она больше 29 г/моль — газами тяжелее воздуха (например, кислород O2, озон O3, углекислый газ CO2).
Получение, собирание и хранение газов
Газы имеют важное значение в жизни и деятельности человека. Поэтому необходимо уметь их получать, собирать и хранить.
В химической лаборатории небольшие объемы газов можно получать различными способами. Например, газы выделяются при нагревании некоторых твердых веществ (рис. 66).
Газообразные вещества могут образовываться при действии некоторых жидких веществ на твердые. Так, при действии уксуса на мрамор или мел выделяется углекислый газ (рис. 67).
В промышленности используют значительно большие, чем в химических лабораториях, количества различных газов. Большие объемы кислорода и азота получают из воздуха. Позднее вы узнаете, как это делается.
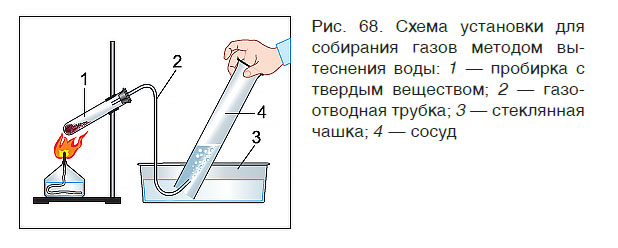
В лабораторных условиях собрать газ в сосуд можно двумя способами: вытеснением воды (рис. 68) и вытеснением воздуха. Первый способ применяют для собирания только нерастворимых в воде газов (кислород, азот, водород). Вто-
рой — для собирания как растворимых (аммиак, углекислый газ), так и нерастворимых в воде газов.
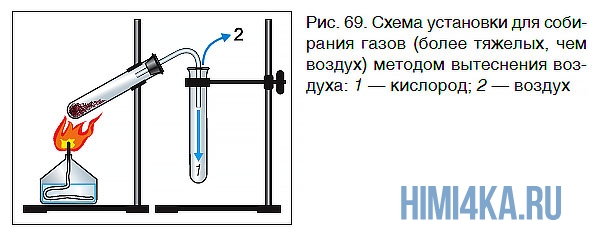
Для собирания газов, которые легче воздуха, сосуд для сбора газа следует закрепить дном вверх, а для газов, которые тяжелее воздуха, — дном вниз (рис. 69)
Для хранения газов следует использовать сосуды, не сообщающиеся с окружающей средой. Такие сосуды называют герметичными (т. е. не имеющими отверстий для выхода газа из сосуда наружу). В быту примером герметичного сосуда является бутылка с плотной пробкой, завязанный воздушный шарик или накачанная камера от велосипедного колеса, в химической лаборатории — пробирка, плотно закрытая пробкой, газометр.
Из курса физики вы знаете, что при нагревании газы расширяются. Это свойство можно использовать для проверки прибора для получения газов на герметичность (рис. 70). Для этого после сборки прибора следует погрузить конец газоотводной трубки в воду, а пробирку на несколько секунд зажать в ладони. Нагреваясь от тепла руки, воздух в пробирке расширяется и выходит из газоотводной трубки в виде пузырьков. Если пузырьки не наблюдаются, то это свидетельствует о том, что прибор собран негерметично и для газа имеется другой выход, кроме газоотводной трубки.
В промышленности для хранения газов чаще всего используют более прочные сосуды — баллоны (рис. 71), в которых сжатые газы находятся под большим давлением; для предупреждения разрушения баллона сжатым газом его стенки делают из толстой стали. Узнать, какой газ содержится в баллоне, можно по окраске баллона, цвету надписи на нем и цвету полосы. Например, баллон с кислородом должен быть окрашен в голубой цвет и иметь черную надпись «Кислород», баллон с азотом должен быть окрашен в черный цвет, иметь желтую надпись «Азот» и коричневую полосу, баллон с очень чистым аргоном должен быть окрашен в серый цвет, иметь зеленую надпись «Аргон» и зеленую полосу.
Краткие выводы урока:
- Вещества могут находиться в газообразном, жидком или твердом агрегатном состоянии.
- Воздух представляет собой смесь газов. Основными компонентами воздуха являются азот и кислород.
- При нормальных условиях в воздухе объемом 100 дм 3 содержится азот объемом около 78 дм 3 и кислород объемом около 21 дм 3 .
- Воздух можно условно рассматривать как газ, молярная масса которого равна 29 г/моль.
Надеюсь урок 15 «Воздух как смесь газов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник