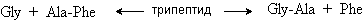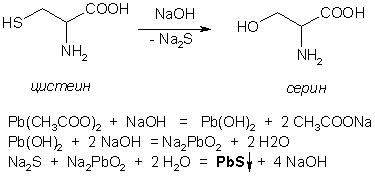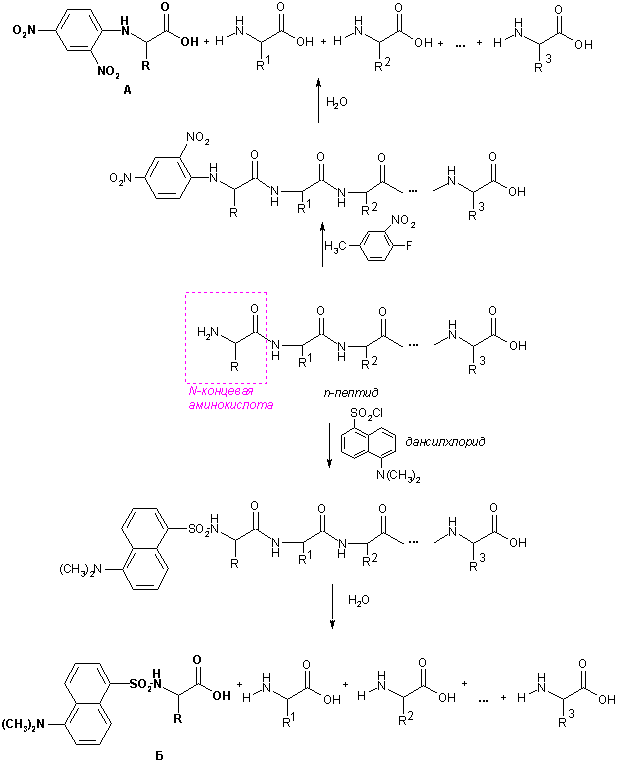Определение аминокислотной последовательности



Для определения аминокислотной последовательности используют комбинацию двух методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
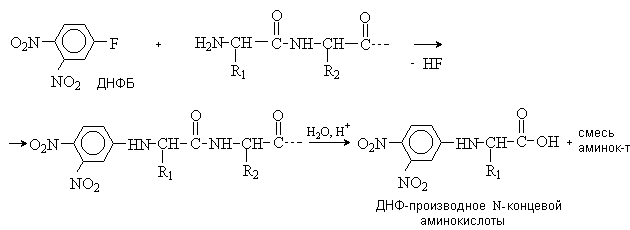
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют ДНФ-производное N-концевой аминокислоты.
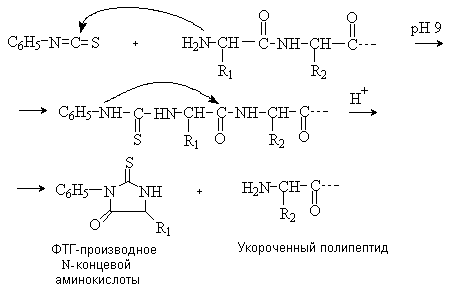
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой аминокислоты пептид не разрушается и операцию по отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с образованием более коротких цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют пептидные связи избирательно, например, только с N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы). Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
Источник
Последовательность аминокислот в белке
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Многообразие форм жизни объясняется разнообразием белковых молекул, которые наделены особыми биологическими функциями. Структуру белка определяет состав аминокислот и последовательность их расположения в пептидных цепях. Состав и последовательность аминокислот в цепи пептида закодированы в ДНК посредством генетического кода.
Внимание! Генетический код – это всеобщая система записи наследственной информации в виде последовательности нуклеотидов в молекулах ДНК либо мРНК, которая определяет порядок расположения аминокислот в структуре белка.
Связь между ДНК, РНК и белком
Белок, ДНК и РНК – это единая система, которая определяет специфичность организма и передает наследственные признаки. Каждый белок имеет строго определенную последовательность аминокислот в пептидной цепи и конкретную пространственную структуру. Последовательность аминокислот в белковой цепи соответствует первичной структуре. Всего их 4 – первичная, вторичная, третичная и четвертичная.
В организме свободную аминокислоту активирует фермент. тРНК (транспортная) переносит ее от фермента к иРНК (информационная). иРНК и рРНК (рибосомальная) отвечают за синтез из аминокислот белка со строго заданной ДНК последовательностью. Для каждой аминокислоты в клетке предусмотрены собственные ферменты и тРНК.
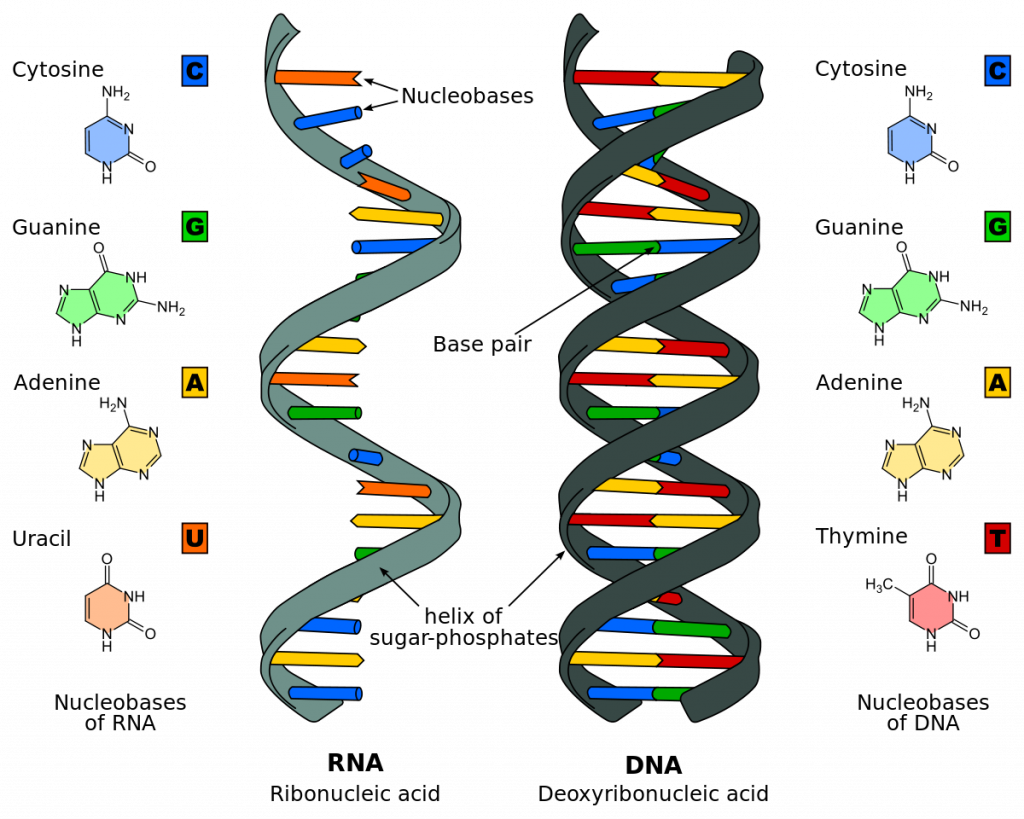
ДНК выполняет функцию матрицы, на которой производятся цепи РНК. РНК выступает в качестве матрицы для синтеза белка. ДНК -> РНК -> белок – именно таким образом переносится генетическая информация от последовательности нуклеотидов в ДНК к последовательности аминокислот в белках.
Как пишется и определяется аминокислотная последовательность
Аминокислотная последовательность – это цепочка аминокислот в молекуле пептида либо белка. Она записывается с N-конца со свободной аминогруппой к C-концу со свободной карбоксильной группой.
Пептидная последовательность иногда называют белковой. Это первичная структура всех белков в момент синтеза. Посредством посттрансляционных модификаций первичная структура видоизменяется, образуя зрелый белок.
Аминокислотная последовательность проистекает из последовательности мРНК. А она определяется в результате транскрипции гена, в котором нуклеотидный порядок в кодирующей последовательности определяет итоговый белок.
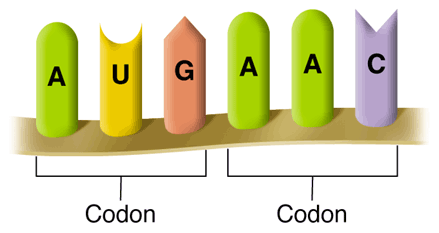
Три нуклеотида образуют кодон, определяющий аминокислоту. Каждая группа из трех нуклеотидных оснований ДНК является кодом для аминокислоты. Так, нуклеотидная последовательность ДНК CTG кодирует лейцин.
Всего существует 64 вероятных кодона для определения 20 аминокислот. В результате уникальная последовательность аминокислот образует уникальный белок.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Источник
Способ шифрования аминокислотной последовательности называется
Анализ белковых молекул
Для определения аминокислот, входящих в состав белка используют методы, основанные, как правило, на частичном или полном гидролизе полипептидной цепи. Обычно проводят кислотный или ферментативный гидролиз белка и аминокислоты анализируют различными хроматографическими методами. Таким способом можно установить количественный и качественный состав аминокислот, входящих в состав белка, но не их последовательность. Остановимся на некоторых химических способах анализа белковых молекул.
Свободные аминокислоты обнаруживают нингидринной реакцией (см. Нингидринная реакция). Эту же реакцию дают и белки, но в более жестких условиях – при кипячении с водным раствором нингидрина.
Для обнаружения пептидных связей в белках служит биуретовая реакция (реакция Пиотровского) – образование ярко-окрашенных комплексов при взаимодействии белков с гидроксидом меди (II) в присутствии щелочи. В эту реакцию вступают все пептиды, имеющие минимум две пептидные связи. Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий. Реакцию используют не только для качественного, но и для количественного определения белков.
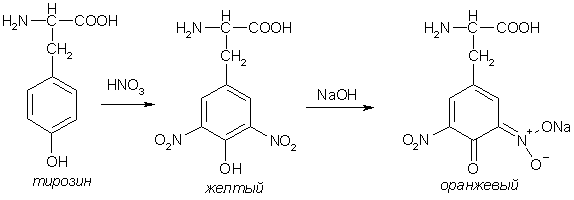
Пептиды, содержащие ароматические и гетероароматические аминокислоты дают положительную ксантопротеиновую реакцию (реакция Мульдера) – появление желтого окрашивания при действии конц. азотной кислоты. При добавлении щелочи цвет смеси меняется на оранжевый.
Серосодержащие аминокислоты в составе белка определяют по образованию черного осадка сульфида свинца при нагревании с ацетатом свинца – сульфгидрильная реакция (реакция Фоля).
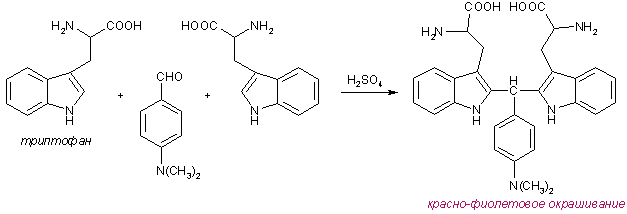
Триптофан обнаруживают при помощи реакции с п-диметиламинобензальдегидом в среде серной кислоты – реакция Эрлиха . Образующийся продукт конденсации имеет красно-фиолетовое окрашивание.
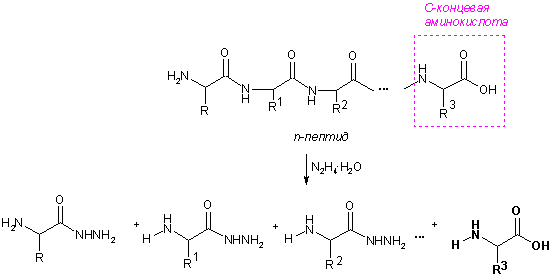
Определение С- и N-концевых аминокислот
N-Концевые аминокислоты определяют по реакции с 2,4-динитрофторбензолом или дансилхлоридом. Свободная аминогруппа N-концевой аминокислоты арилируется или ацилируется, белок гидролизуют, образовавшиеся N-(2,4-динитрофенил)- (А) или N-(5-диметиламинонафтил-1-сульфо)производные (Б) существенно отличаются по физико-химическим свойствам от остальных аминокислот, поэтому их легко отделяют и идентифицируют.
С-Концевые аминокислоты определяют методом Акароби – при нагревании пептида с гидразингидратом пептидные связи гидролизуются и образуется смесь гидразидов аминокислот. С-Концевая аминокислота не реагирует с гидразином, остается в свободном виде, ее выделяют и идентифицируют.
Удобным методом определения последовательности аминокислот (первичной структуры белка) является способ деградации полипептидной цепи с помощью фенилизотиоцианата (метод Эдмана). N-Концевые аминокислоты последовательно отщепляются от цепи в виде фенилтиогидантоинов и идентифицируются.
Источник
Линейность записи информации
БИОСИНТЕЗ БЕЛКОВ (ТРАНСЛЯЦИЯ)
Перевод информации, заключённой в полинуклеотидной последовательности мРНК, в аминокислотную последовательность белка требует определённого способа кодирования или шифрования, т.е. существования определённого закона, по которому чередование четырёх нуклеотидов в мРНК задаёт специфическую последовательность аминокислот в белке.
А. — Генетический код и его свойства
Необходимость кодирования структуры белков в линейной последовательности нуклеотидов мРНК и ДНК продиктована тем, что в ходе трансляции:
- нет соответствия между числом мономеров в матрице мРНК и продукте — синтезируемом белке;
- отсутствует структурное сходство между мономерами РНК и белка.
Это исключает комплементарное взаимодействие между матрицей и продуктом — принцип, по которому осуществляется построение новых молекул ДНК и РНК в ходе репликации и транскрипции.
Отсюда становится ясным, что должен существовать «словарь», позволяющий выяснить, какая последовательность нуклеотидов мРНК обеспечивает включение в белок аминокислот в заданной последовательности. Этот «словарь» получил название генетического, биологического, нуклеотидного, или аминокислотного кода. Он позволяет шифровать аминокислоты, входящие в состав белков, с помощью определённой последовательности нуклеотидов в ДНК и мРНК. Для него характерны определённые свойства.
Триплетность.Одним из основных вопросов при выяснении свойств кода был вопрос о числе нуклеотидов, которое должно определять включение в белок одной аминокислоты. Сразу было понятно, что это число не может быть равным 1 или 2, так как в этом случае количество кодирующих элементов будет недостаточным для шифрования 20 аминокислот в белках. Число кодирующих последовательностей из четырёх нуклеотидов по три равно 4 3 = 64, что более чем в 3 раза превышает минимальное количество, которое необходимо для кодирования 20 аминокислот. В дальнейшем было установлено, что кодирующими элементами в шифровании аминокислотной последовательности действительно являются тройки нуклеотидов, или триплеты,которые получили название«кодоны».
Смысл кодонов
Смысл кодонов стал понятен в 60-х г. XX столетия, когда, используя бесклеточную систему синтеза белков (табл. 4-3) и синтетические полирибонуклеотиды с заданной последовательностью нуклеотидов в качестве матрицы, М. Ниренберг и Г. Маттеи синтезировали полипептиды определённого строения. Так, на матрице поли-У, состоящей только из остатков УМФ, был получен полифенилаланин, а на матрице поли-Ц — полипролин. Из этого следовало, что триплет -UUU кодирует Фен, а триплет -ССС — Про.
В последующих экспериментах использовали смешанные синтетические полирибонуклеотиды с известным составом. В результате этой работы удалось установить, что из 64 кодонов включение аминокислот в синтезирующуюся полипептидную цепь шифрует 61 триплет, а 3 остальных — UAA, UAG, UGA не кодируют включение в белок аминокислот и первоначально были названы бессмысленными, или нон-сенс-кодонами. Однако в дальнейшем было показано, что эти триплеты сигнализируют о завершении трансляции, и поэтому их стали называть терминирующими, или стоп-кодонами.
Кодоны мРНК и триплеты нуклеотидов в кодирующей нити ДНК с направлением от 5′ к 3′-концу имеют одинаковую последовательность азотистых оснований, за исключением того, что в ДНК вместо урацила (U), характерного для мРНК, стоит тимин (Т).
Специфичность
Каждому кодону соответствует только одна определённая аминокислота. В этом смысле генетический код строго однозначен.
Таблица 4-3. Основные компоненты белоксинтезирующей системы
| Необходимые компоненты | Функции |
| 1 . Аминокислоты | Субстраты для синтеза белков |
| 2. тРНК | тРНК выполняют функцию адаптеров. Они акцепторным концом взаимодействуют с аминокислотами, а антикодоном — с кодоном мРНК. |
| 3. Аминоацил-тРНК синтетазы | Каждая аа-тРНК-синтетаза катализирует реакцию специфического связывания одной из 20 аминокислот с соответствующей тРНК |
| 4.мРНК | Матрица содержит линейную последовательность кодонов, определяющих первичную структуру белков |
| 5. Рибосомы | Рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков |
| 6. АТФ, ГТФ | Источники энергии |
| 7. Белковые факторы инициации, элонгации, терминации | Специфические внерибосомные белки, необходимые для процесса трансляции (12 факторов инициации: elF; 2 фактора элонгации: eEFl, eEF2, и факторы терминации: eRF) |
| 8. Ионы магния | Кофактор, стабилизирующий структуру рибосом |
Примечания:elF (eukaryotic initiation factors) — факторы инициации; eEF (eukaryotic elongation factors) — факторы элонгации; eRF (eukaryotic releasing factors) — факторы терминации.
Вырожденность
В мРНК и ДНК имеет смысл 61 триплет, каждый из которых кодирует включение в белок одной из 20 аминокислот. Из этого следует, что в информационных молекулах включение в белок одной и той же аминокислоты определяют несколько кодонов. Это свойство биологического кода получило название вырожденности.
У человека одним кодоном зашифрованы только 2 аминокислоты — Мет и Три, тогда как Лей, Сер и Apr — шестью кодонами, а Ала, Вал, Гли, Про, Тре — четырьмя кодонами (табл. 4-4).
Избыточность кодирующих последовательностей — ценнейшее свойство кода, так как она повышает устойчивость информационного потока к неблагоприятным воздействиям внешней и внутренней среды. При определении природы аминокислоты, которая должна быть включена в белок, третий нуклеотид в кодоне не имеет столь важного значения, как первые два. Как видно из табл. 4-4, для многих аминокислот замена нуклеотида в третьей позиции кодона не сказывается на его смысле.
Линейность записи информации
В ходе трансляции кодоны мРНК «читаются» с фиксированной стартовой точки последовательно и не перекрываются. В записи информации отсутствуют сигналы, указывающие на конец одного кодона и начало следующего.
Кодон AUG является инициирующим и прочитывается как в начале, так и в других участках мРНК как Мет. Следующие за ним триплеты читаются последовательно без каких-либо пропусков вплоть до стоп-кодона, на котором синтез полипептидной цепи завершается.
Универсальность
До недавнего времени считалось, что код абсолютно универсален, т.е. смысл кодовых слов одинаков для всех изученных организмов: вирусов, бактерий, растений, земноводных, млекопитающих, включая человека. Однако позднее стало известно одно исключение, оказалось, что митохондриальная мРНК содержит 4 триплета, имеющих другое значение, чем в мРНК ядерного происхождения. Так, в мРНК митохондрий триплет UGA кодирует Три, AUA — Мет, а АСА и AGG прочитываются как дополнительные стоп-кодоны.
Источник