- Распад гликогена (гликогенолиз)
- Синтез и распад гликогена реципрокны
- Способы активации синтазы гликогена
- Способы активации фосфорилазы гликогена
- Ковалентная модификация фосфорилазы
- Кальций-зависимая активация
- Аллостерическая (метаболическая) активация
- 6.4.2. Распад гликогена
- 6.5. Обмен глюкозы в тканях
- 6.5.1. Окисление глюкозы в тканях
- 6.5.1.1. Анаэробное окисление глюкозы
Распад гликогена (гликогенолиз)
Известно, что фосфоролитический распад играет ключевую роль в мобилизации полисахаридов.
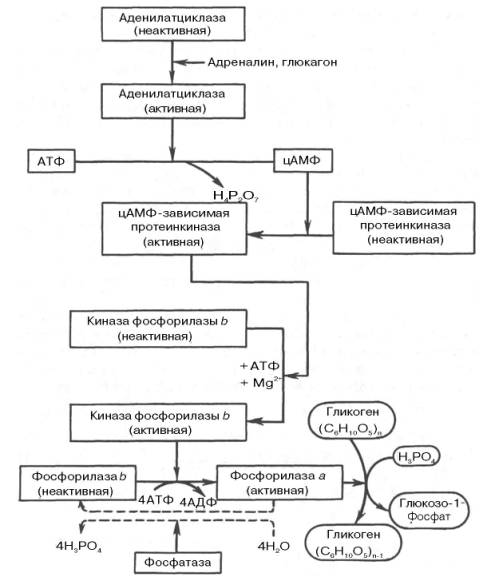
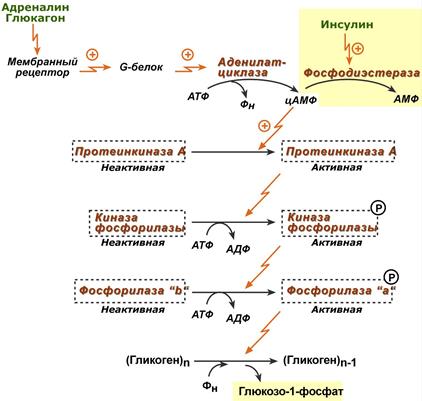
Рис. 10.1. Гормональная регуляция фосфоролитического отщепления остатка глюкозы от гликогена.
Фосфорилазы переводят полисахариды (в частности, гликоген) из запасной формы в метаболически активную форму; в присутствии фосфо-рилазы гликоген распадается с образованием фосфорного эфира глюкозы (глюкозо-1-фосфата) без предварительного расщепления на более крупные обломки молекулы полисахарида. В общей форме эту реакцию можно представить в следующем виде:
где (С6Н10О5)n означает полисахаридную цепь гликогена, а (С6Н10О5)n-1,– ту же цепь, но укороченную на один глюкозный остаток.
На рис. 10.1 изображены процесс распада гликогена до глюкозо-1-фосфата и участие в этом процессе цАМФ. Фермент фосфорилаза существует в двух формах, одна из которых (фосфорилаза а) активна, в то время как другая (фосфорилаза b) обычно неактивна. Обе формы могут диссоциировать на субъединицы. Фосфорилаза b состоит из двух субъединиц, а фосфорилаза а – из четырех. Превращение фосфо-рилазы b в фосфорилазу а осуществляется фосфорилированием белка:
2 Фосфорилаза b + 4 АТФ –> Фосфорилаза а + 4 АДФ.
Катализируется эта реакция ферментом, который называется киназой фосфорилазы b. Установлено, что эта киназа может существовать как в активной, так и в неактивной форме. Неактивная киназа фосфорилазы превращается в активную под влиянием фермента протеинкиназы (киназа киназы фосфорилазы), и не просто протеинкиназы, а цАМФ-зависимой протеинкиназы.
Активная форма последней образуется при участии цАМФ, которая в свою очередь образуется из АТФ под действием фермента аденилатцик-лазы, стимулируемой, в частности, адреналином и глюкагоном. Увеличение содержания адреналина в крови приводит в этой сложной цепи реакций к превращению фосфорилазы b в фосфорилазу а и, следовательно, к освобождению глюкозы в виде глюкозо-1-фосфата из запасного полисахарида гликогена. Обратное превращение фосфорилазы а в фосфорилазу b катализируется ферментом фосфатазой (эта реакция практически необратима).
Образовавшийся в результате фосфоролитического распада гликогена глюкозо-1-фосфат превращается под действием фосфоглюкомутазы в глюкозо-6-фосфат. Для осуществления данной реакции необходима фосфо-рилированная форма фосфоглюкомутазы, т.е. ее активная форма, которая образуется, как отмечалось, в присутствии глюкозо-1,6-бисфосфата .
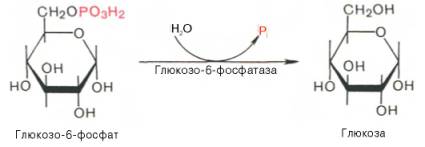
Образование свободной глюкозы из глюкозо-6-фосфата в печени происходит под влиянием глюкозо-6-фосфатазы. Данный фермент катализирует гидролитическое отщепление фосфата:
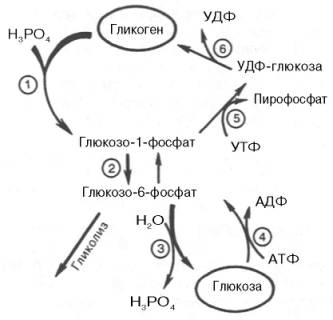
Жирными стрелками указан путь распада, тонкими — путь синтеза. Цифрами обозначены ферменты: 1 — фосфорилаза; 2 — фос-фоглюкомутаза; 3 — глюкозо-6-фосфатаза; 4 — гексокиназа (глюкокиназа); 5 — глюко-зо-1-фосфат-уридилтрансфераза; 6 — глико-генсинтаза.
Заметим, что фосфорилированная глюкоза в противоположность неэте-рифицированной глюкозе не может легко диффундировать из клеток. Печень содержит гидролитический фермент глюкозо-6-фосфатазу, который и обеспечивает возможность быстрого выхода глюкозы из этого органа. В мышечной ткани глюкозо-6-фосфатаза практически отсутствует.
На рис. 10.2 отражены представления о путях распада и синтеза гликогена в печени.
Можно считать, что сохранение постоянства концентрации глюкозы в крови является результатом одновременного протекания двух процессов: поступления глюкозы в кровь из печени и потребления ее из крови тканями, где она используется в первую очередь как энергетический материал.
В тканях (в том числе в печени) распад глюкозы происходит двумя основными путями: анаэробным (при отсутствии кислорода) и аэробным, для осуществления которого необходим кислород.
Источник
Синтез и распад гликогена реципрокны
Метаболизм гликогена в печени, мышцах и других клетках регулируется несколькими гормонами, одни из которых активируют синтез гликогена, а другие – распад гликогена. При этом в одной клетке не могут идти одновременно синтез и распад гликогена – это противоположные процессы с совершенно с разными задачами. Синтез и распад исключают друг друга или, по-другому, они реципрокны .
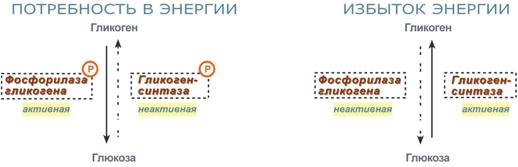
Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме.
Присоединение фосфатов к ферменту производят протеинкиназы , источником фосфата является АТФ:
- фосфорилаза гликогена активируется после присоединения фосфатной группы,
- синтаза гликогена после присоединения фосфата инактивируется.
Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз , активируя фосфорилазу гликогена.
- во время мышечной работы адреналин вызывает фосфорилирование ферментов обмена гликогена в мышцах и в печени. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце и печени происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения.
- при голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови.
Изменение активности ферментов обмена гликогена в зависимости от условий
Способы активации синтазы гликогена
Аллостерическая активация гликогенсинтазы осуществляется глюкозо-6-фосфатом.
Еще одним способом изменения ее активности является химическая (ковалентная) модификация. При присоединении фосфата гликогенсинтаза прекращает работу, т.е. она активна в дефосфорилированном виде. Удаление фосфата от ферментов осуществляют протеинфосфатазы , которые активируются при действии на клетку инсулина – в результате он повышает синтез гликогена.
Вместе с этим, инсулин и глюкокортикоиды ускоряют синтез гликогена, увеличивая количество молекул гликогенсинтазы.
Способы активации фосфорилазы гликогена
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами:
- ковалентная модификация,
- кальций-зависимая активация,
- аллостерическая активация с помощью АМФ.
Ковалентная модификация фосфорилазы
При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм, который является так называемым каскадным регулированием. Последовательность событий в данном механизме включает:
- Молекула гормона (адреналин, глюкагон) взаимодействует со своим рецептором;
- Активный гормон-рецепторный комплекс воздействует на мембранный G-белок;
- G-белок активирует фермент аденилатциклазу;
- Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер);
- цАМФ аллостерически активирует фермент протеинкиназу А;
- Протеинкиназа А фосфорилирует различные внутриклеточные белки:
- одним из этих белков является синтаза гликогена , ее активность угнетается,
- другим белком – киназа фосфорилазы , которая при фосфорилировании активируется;
- Киназа фосфорилазы фосфорилирует фосфорилазу «b» гликогена, последняя в результате превращается в активную фосфорилазу «а»;
- Активная фосфорилаза «а» гликогена расщепляет α-1,4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Аденилатциклазный способ активации фосфорилазы гликогена
Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные способы регуляции этого механизма. Например, после воздействия инсулина активируется фермент фосфодиэстераза, которая гидролизует цАМФ, прерывает каскад активации ферментов и, следовательно, снижает активность гликоген-фосфорилазы.
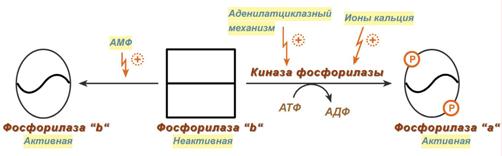
Кальций-зависимая активация
Некоторые гормоны влияют на углеводный обмен посредством кальций-фосфолипидного механизма. Активация ионами кальция заключается в активации киназы фосфорилазы не протеинкиназой, а ионами Ca 2+ и кальмодулином . Этот путь работает при инициации кальций-фосфолипидного механизма. Такой способ оправдывает себя, например, при мышечной нагрузке, если гормональные влияния через аденилатциклазу недостаточны, но в цитоплазму под влиянием нервных импульсов поступают ионы Ca 2+ .
Суммарная схема способов активации фосфорилазы
Аллостерическая (метаболическая) активация
Также существует активация гликогенолиза с помощью АМФ – такая аллостерическая активация происходит благодаря присоединению АМФ к молекуле фосфорилазы «b«.
Молекулы АМФ, стимулирующие гликогенолиз, образуются в реакции фермента аденилаткиназы, активируемой при снижении количества АТФ и накоплении АДФ. Особенно ярко значение такой регуляции проявляется при интенсивной мышечной работе:
Источник
6.4.2. Распад гликогена
Распад гликогена (мобилизация гликогена до глюкозы) активируется в постабсортивном периоде (при голодании, усиленной физической нагрузке). В печени функционируют два пути распада гликогена: амилолитический путь и фосфоролитический путь
Амилолитический путь заключается в гидролитическом распаде гликогена:
Этот путь катализируют α-амилаза, которая расщепляет внутренние 1,4 -α-гликозидные связи и γ — амилаза, которая отрывает концевые остатки глюкозы.
Основным способом распада гликогена является фосфоролитический путь при участии Н3РО4:
Г
В печени имеются фермент – глюкозо-6-фосфатаза, способный отщеплять остатки Н3РО4 от глюкозо-6-фосфата, переводя глюкозо-6-фосфат в свободную глюкозу.
Фосфорилаза расщепляет только 1,4 -α-гликозидные связи. В расщеплении 1,6 -α-гликозидных связей участвует дополнительный фермент – 1,6 -α-гликозидаза.
Ключевым ферментом распада гликогена является фосфорилаза. В распаде гликогена участвуют активная фосфорилированная форма фосфорилазы (фосфорилаза «А»). Она образуется из неактивной фосфорилазы «В» путём фосфорилирования и увеличения олигомерности. Фосфорилаза «В» является нефосфорилированным димером, а фосфорилаза «А» представляет собой фосфорилированный тетрамер.
С
У детей обмен гликогена имеет свои особенности. В последний месяц внутриутробного развития активируется синтез гликогена, и его содержание достигает до 10% массы печени. В процессе родов происходит усиленный распадгликогена на энергетические цели, и его содержание резко снижается. Синтез гликогена активируется в первые 2-3 месяца после рождения.
6.5. Обмен глюкозы в тканях
Основным метаболитом углеводного обмена является глюкоза. Её содержание в тканях, плазме крови поддерживается на определённом уровне благодаря сбалансированности процессов образования и распада. Фонд глюкозы в тканях пополняется за счёт поступления всосавшихся в кишечнике моносахаридов, при распаде гликогена в печени и путём глюконеогенеза (синтеза глюкозы из других веществ). Глюкоза в тканях расходуется на синтез гликогена, липидов, некоторых аминокислот, производных глюкозы, на образование энергии.
6.5.1. Окисление глюкозы в тканях
Основная функция глюкозы – энергетическая, т.е. при окислении глюкозы в тканях высвобождается энергия. При окислении глюкоза переходит в пировиноградную кислоту (ПВК), которая затем либо полностью окисляется в аэробных условиях, либо превращается в молочную кислоту (лактат) в анаэробных условиях. Процесс окисления глюкозы называется гликолизом.
Чаще под гликолизом понимают превращение глюкозы в молочную кислоту в анаэробных условиях. Распад глюкозы в анаэробных условиях – анаэробный гликолиз.
6.5.1.1. Анаэробное окисление глюкозы
Анаэробный гликолиз включает 2 этапа:
Активация глюкозы с затратой АТФ
Окислительный этап, идущий с образованием АТФ
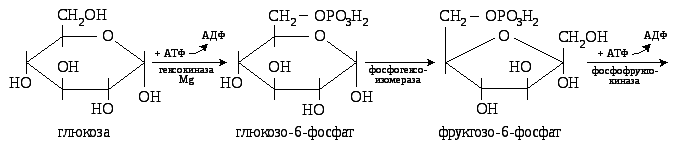
На первом этапе глюкоза расщепляется на 2 триозы:
Таким образом, на первом этапе гликолиза на активирование глюкозы затрачивается 2 молекулы АТФ и образуется 2 молекулы 3-фософоглицеринового альдегида.
На второй стадии окисляются 2 молекулы 3-фосфоглицеринового альдегида до двух молекул молочной кислоты.
Значение лактатдегидрогеназной реакции (ЛДГ) заключается в том, чтобы в безкислородных условиях окислить НАДН2в НАД и сделать возможным протекание глицеро-фосфатдегидрогеназной реакции.
Суммарное уравнение гликолиза:
глюкоза + 2АДФ + 2Н3РО4→ 2лактат + 2АТФ + 2Н2О
Гликолиз протекает в цитозоле. Его регуляцию осуществляют ключевые ферменты –фософофруктокиназа,пируваткиназа. Эти ферменты активируются АДФ и НАД, угнетаются АТФ и НАДН2.
Энергетическая эффективность анаэробного гликолиза сводится к разнице между числом израсходованных и образовавшихся молекул АТФ. Расходуется 2 молекулы АТФ на молекулу глюкозы в гексокиназной реакции и фосфофруктокиназной реакции. Образуется 2 молекулы АТФ на одну молекулу триозы (1/2 глюкозы) в глицерокиназной реакции и пируваткиназной реакции. На молекулу глюкозы (2 триозы) образуется соответственно 4 молекулы АТФ. Общий баланс: 4 АТФ – 2 АТФ = 2 АТФ. 2 молекулы АТФ аккумулируют в себе ≈ 20 ккал, что составляет около 3% от энергии полного окисления глюкозы (686 ккал).
Несмотря на сравнительно невысокую энергетическую эффективность анаэробного гликолиза, он имеет важное биологическое значение, состоящее в том, что это единственныйспособ образования энергии в безкислородных условиях. В условиях дефицита кислорода он обеспечивает выполнение интенсивной мышечной работы в начальный период физической нагрузки.
В тканях плодаанаэробный гликолиз очень активен в условиях дефицита кислорода. Он остаётся активным в периодноворожденности, постепенно сменяясь на аэробное окисление.
Дальнейшее превращение молочной кислоты
При интенсивном поступлении кислорода в аэробных условиях молочная кислота превращается в ПВК и через ацетил КоА включается в цикл Кребса, давая энергию.
Молочная кислота транспортируется из мышц в печень, где используется на синтез глюкозы – цикл Р. Кори.
При больших концентрациях молочной кислоты в тканях для предотвращения закисления (ацидоза) она может выделяться через почки и потовые железы.
Источник