- Способы регулирования активности ферментов.
- Значение существования проферментов:
- Структурно-функциональная организация ферментов.
- Мультиферменты.
- 19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- 20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
Способы регулирования активности ферментов.
1)Аллостерическая регуляция сопровождается изменением сродства фермента к субстрату без изменения максимальной скорости реакции. Это очень распространенная и чувствительная регуляция. Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра (allos — иной). Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться — это активация фермента, или уменьшиться — это ингибирование.
«Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей.
Широко представлены такие коферменты как АМФ, АДФ, АТФ, НАД, НАДН, НАДФ, НАДФН, лимонная кислота, ацетил-KoA и ряд других, которые одновременно являются субстратами, продуктами и регуляторами ферментативных реакций.
Регуляция активности ферментов происходит также ковалентной модификацией. Открытие этого пути – важнейшее достижение биохимии. Активирование и ингибирование активности ферментов фосфорилированием их киназами, участие циклической АТФ в процессах действия гормонов, наличие специфических рецепторов гормонов в мембранах клеток – все это является новым этапом в изучении регуляции обмена веществ.
Общая схема регуляции при этом заключаются в следующем: циклический АМФ (ц-АМФ) присоединяется к регуляторной субъединице, что ведет к освобождению его активной каталитической субъединицы, то есть концентрация ц-АМФ, его образование под влиянием циклазы и расщепление под влиянием фосфодиэстеразы лежат в основе регуляции целого ряда путей обмена веществ. Фосфорилирование также является распространенным механизмом регулирования активности ферментов обмена веществ.
Гормональная регуляция активности ферментов заключается в том, что имеется связь между влиянием гормонов на процессы транскрипции и модификацией негистоновых белков ядра. Гормоны могут выступать как эффекторы (сенсорные участки) ДНК и т.д.
Нервная регуляция активности ферментов изучается давно (обмен веществ). На животных с перерезкой нервов доказано, что при этом ряд ферментов мышечной ткани меняет свои свойства.
2) Регуляция на генетическом уровне— изменение скорости биосинтеза белка.
. С этой точки зрения ферменты можно подразделить на три группы:
Конституитивные – такие ферменты, которые образуются в клетке постоянно.
Индуцируемые (адаптивные) – синтез этих ферментов возрастает при наличии соответствующих стимулов (индукторов).
Репрессируемые – образование таких ферментов в клетке при необходимости подавляется.
Изменение скорости синтеза фермента обычно зависит от количества определенных гормонов или субстратов реакции, например:
исчезновение пищеварительных ферментов при длительном голодании и их появление в восстановительный период (в результате изменения секреции кишечных гормонов),
при беременности и после родов в молочной железе активно идет синтез фермента лактозосинтазы под воздействием лактотропного гормона,
гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови при длительном голоданиии и устойчивость ЦНС к стрессу,
токсические субстраты этанол и барбитураты стимулируют в печени синтез «своего» изофермента цитохрома Р450, который окисляет и обезвреживает эти вещества.
3) Филогенетически наиболее старый уровень – Автономная саморегуляция ферментов.
Автономная саморегуляция— это регуляция, которая происходит благодаря только самим участникам реакции, то есть за счет фермента, его субстрата (или субстратов) и/или продуктов деятельности данного фермента. Фермент не только работает, но еще и сам себя регулирует.
Ковалентная (химическая) модификация
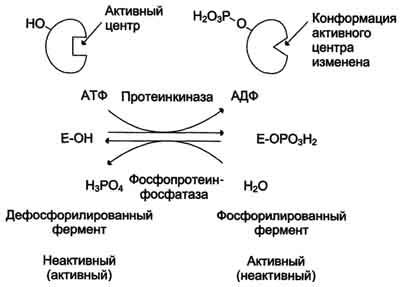
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, в мышцах ферменты гликогенфосфорилазаи гликогенсинтаза
при нагрузке фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна.
во время отдыха при синтезе гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной
Пример. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации. `
В этом случае фосфатная группа — ОРО3 2- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты — протеинкиназы и протеинфосфатазы.
Фосфорилирование — распространенный способ изменить свойства некоторых клеточных белков. Так, при фосфорилировании компонентов цитоскелета (комплекса структурных белков, обеспечивающих поддержание прочности и функционирования клетки) изменяются прочность его взаимодействия с мембраной и форма клеток. Фосфорилирование белков — регуляторов сокращения активирует сократительную реакцию мышцы.
Источник
Значение существования проферментов:
Защита клетки, в которой вырабатывается фермент от его разрушающего действия
Возможность накопления ферментов
Возможность быстрой активации в нужный момент
Структурно-функциональная организация ферментов.
Изоферменты. Ферменты, катализирующие одну и туже химическую реакцию, но отличающиеся по первичной структуре белка называют изоферментами или изоэнзимами. Другими словами, изоферменты это множественные формы одного фермента. Катализируя одну и ту же реакцию, изоферменты отличаются физико-химическими свойствами (молекулярной массой, электрофоретической подвижностью), кинетическими характеристиками (сродством к субстрату), особенностями активации.
Рассмотрим особенности функционирования изоферментов на примере лактатдегидрогеназы (ЛДГ). ЛДГ катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты), коферментом служит молекула НАД.

Н


ЛДГ – олигомерный белок (имеет четвертичную структуру), состоящий из 4-х субъединиц 2-х типов: М (от англ. muscle) и Н (от англ. heart). Комбинация этих субъединиц лежит в основе формирования 5 изоформ ЛДГ.
ЛДГ и ЛДГ наиболее активны в сердечной мышце, ЛДГ и ЛДГ в скелетных мышцах и печени.
В основе существования изоферментов лежат структурные различия кодирующих их генов. Появление в эволюции различных форм ЛДГ обусловлено особенностями окислительного метаболизма тканей. М-типы ЛДГ работают эффективно в анаэробных условиях, Н- типы – в аэробных, когда образующийся пируват далее быстро окисляется до углекислого газа и воды.
Тканевая специфичность изоформ ЛДГ позволяет использовать определение их активности в крови для диагностики ряда заболеваний. Общая активность ЛДГ крови повышается при острых поражениях сердца, печени, почек, мышц, что связано с разрушением клеток этих органов и тканей и выходом ферментов в кровь. Для уточнения диагноза необходимо определить какая из изоформ преобладает в крови. Это возможно определить методом электрофореза, так как Н-формы обладают большим отрицательным зарядом и соответсвенно большей подвижностью в электрическом поле. Увеличение в крови количества ЛДГ и ЛДГ свидетельствует об инфаркте миокарда.
Кроме ЛДГ несколькими изоферментными формами представлены такие ферменты как креатинкиназа, гексокиназа, пируваткиназа и др.
Мультиферменты.
Мультифермент или мультиэнзим это структурно-функциональный комплекс из нескольких ферментов, катализирующих последовательное превращение одного субстрата. Рассмотрим строение мультифермента на примере пируватдегидрогеназного комплекса. Эта мультиферментная система локализована в митохондриях клеток и катализирует необратимую реакцию окислительного декарбоксилирования пирувата. Суммарное уравнение реакции:
С
В объединенном процессе дегидрирования и декарбоксилирования пирувата участвуют 3 фермента:
Е-2 Дигидролипоил-ацетилтрансфераза (трансацилаза)
И 5 коферментов : ТДФ (сод. Вит В , липоевая кислота, HS-КоА (пантотеновая кислота), НАД (РР), ФАД (В ).
В центре комплекса находится «ядро» образованное 24 субъединицами трансацилазы, в каждой из которых в активном центре находятся два остатка липоевой кислоты, ковалентно присоединенные к остаткам лизина. Вокруг ядра располагаются крупные субъединицы пируватдегидрогеназы с прочно связанным коферментом ТДФ и дигидролипоилдегидрогеназы с коферментом ФАД. Липоевая кислота в составе центрального фермента выполняет функцию поворотного кронштейна, переносящего промежуточные продукты с фермента на фермент и функционально объединяющего их. В состав комплекса входят также молекулы диссоциирующих непрочно связанных коферментов НАД и HS-КоА, выполняющих функции акцепторов конечных продуктов реакции – отщепляемых атомов водорода и ацетила — остатка уксусной кислоты. Особенность функционирования мультифермента заключается в том, что промежуточные продукты реакции не попадают в окружающую фермент среду.
Объединение набора ферментов, катализирующих многоступенчатую последовательность реакций в макромолекулярный комплекс позволяет:
– четко координировать работу ферментов
– задавать направление потока промежуточных метаболитов
– ускорять метаболический процесс
– эффективно регулировать процесс за счет межферментных взаимодействий.
Регуляторным ферментом комплекса, катализирующим лимитирующую стадию процесса является Е-1 пируватдегидрогеназа. Активность этого фермента регулируется по двум механизмам.
Аллостерическая регуляция. Ингибиторами комплекса являются НАДН и ацетил-КоА – конечные продукты реакции.
Ковалентная модификация. В присутствии АТФ активность комплекса резко снижается. Это связано с тем, что АТФ активирует фермент киназу, который использует АТФ для фосфорилирования остатка серина в активном центре пируватдегидрогеназы, в результате чего образуется неактивная форма фермента. При снижении уровня АТФ активируется другой фермент – фосфатаза, который отщепляет от пируватдегидрогеназы фосфат и восстанавливает активность фермента. И киназа и фосфатаза также входят в состав мультиферментного комплекса, который представляет собой саморегулирующуюся систему.
Если упростить вопрос регуляции активности мультиферментного комплекса пируватдегидрогеназа, то можно сказать что его активность регулируется двумя соотношениями: АТФ/АДФ и НАДН/НАД. Увеличение этих соотношений приводит к подавлению активности комплекса, а уменьшение – к активации.
Источник
19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов — фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фос-форилирование осуществляется ферментами протеинкиназами, а дефосфорилирование — фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки.
Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала — жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов.
20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
Протеинкиназы — группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А.
Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3′,5′-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конфор-мации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы (рис. 2-32). Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина (рис. 2-34). Трип-синоген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы. Следует напомнить, что трипсин относят к семейству «сериновых» протеаз — активный центр фермента содержит функционально важный остаток Сер.
Частичный протеолиз — пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов.
Источник