Синтез и распад гликогена реципрокны
Метаболизм гликогена в печени, мышцах и других клетках регулируется несколькими гормонами, одни из которых активируют синтез гликогена, а другие – распад гликогена. При этом в одной клетке не могут идти одновременно синтез и распад гликогена – это противоположные процессы с совершенно с разными задачами. Синтез и распад исключают друг друга или, по-другому, они реципрокны .
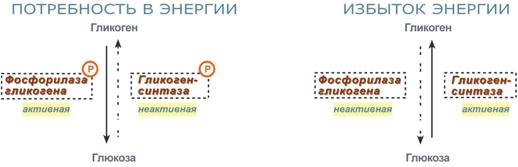
Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме.
Присоединение фосфатов к ферменту производят протеинкиназы , источником фосфата является АТФ:
- фосфорилаза гликогена активируется после присоединения фосфатной группы,
- синтаза гликогена после присоединения фосфата инактивируется.
Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз , активируя фосфорилазу гликогена.
- во время мышечной работы адреналин вызывает фосфорилирование ферментов обмена гликогена в мышцах и в печени. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце и печени происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения.
- при голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови.
Изменение активности ферментов обмена гликогена в зависимости от условий
Способы активации синтазы гликогена
Аллостерическая активация гликогенсинтазы осуществляется глюкозо-6-фосфатом.
Еще одним способом изменения ее активности является химическая (ковалентная) модификация. При присоединении фосфата гликогенсинтаза прекращает работу, т.е. она активна в дефосфорилированном виде. Удаление фосфата от ферментов осуществляют протеинфосфатазы , которые активируются при действии на клетку инсулина – в результате он повышает синтез гликогена.
Вместе с этим, инсулин и глюкокортикоиды ускоряют синтез гликогена, увеличивая количество молекул гликогенсинтазы.
Способы активации фосфорилазы гликогена
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами:
- ковалентная модификация,
- кальций-зависимая активация,
- аллостерическая активация с помощью АМФ.
Ковалентная модификация фосфорилазы
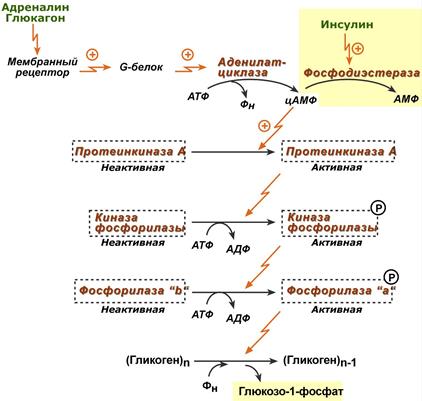
При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм, который является так называемым каскадным регулированием. Последовательность событий в данном механизме включает:
- Молекула гормона (адреналин, глюкагон) взаимодействует со своим рецептором;
- Активный гормон-рецепторный комплекс воздействует на мембранный G-белок;
- G-белок активирует фермент аденилатциклазу;
- Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер);
- цАМФ аллостерически активирует фермент протеинкиназу А;
- Протеинкиназа А фосфорилирует различные внутриклеточные белки:
- одним из этих белков является синтаза гликогена , ее активность угнетается,
- другим белком – киназа фосфорилазы , которая при фосфорилировании активируется;
- Киназа фосфорилазы фосфорилирует фосфорилазу «b» гликогена, последняя в результате превращается в активную фосфорилазу «а»;
- Активная фосфорилаза «а» гликогена расщепляет α-1,4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Аденилатциклазный способ активации фосфорилазы гликогена
Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные способы регуляции этого механизма. Например, после воздействия инсулина активируется фермент фосфодиэстераза, которая гидролизует цАМФ, прерывает каскад активации ферментов и, следовательно, снижает активность гликоген-фосфорилазы.
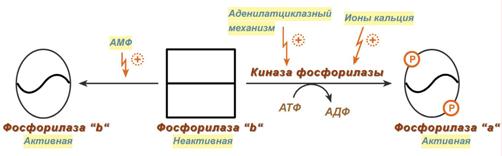
Кальций-зависимая активация
Некоторые гормоны влияют на углеводный обмен посредством кальций-фосфолипидного механизма. Активация ионами кальция заключается в активации киназы фосфорилазы не протеинкиназой, а ионами Ca 2+ и кальмодулином . Этот путь работает при инициации кальций-фосфолипидного механизма. Такой способ оправдывает себя, например, при мышечной нагрузке, если гормональные влияния через аденилатциклазу недостаточны, но в цитоплазму под влиянием нервных импульсов поступают ионы Ca 2+ .
Суммарная схема способов активации фосфорилазы
Аллостерическая (метаболическая) активация
Также существует активация гликогенолиза с помощью АМФ – такая аллостерическая активация происходит благодаря присоединению АМФ к молекуле фосфорилазы «b«.
Молекулы АМФ, стимулирующие гликогенолиз, образуются в реакции фермента аденилаткиназы, активируемой при снижении количества АТФ и накоплении АДФ. Особенно ярко значение такой регуляции проявляется при интенсивной мышечной работе:
Источник
Северин бх
Раздел 8. Обмен углеводов
CO 2 + H 2 O + ATФ
Рис. 8.4. Метаболизм глюкозы в клетках
8.4. Метаболизм гликогена
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген (рис. 8.5). Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для ее использования тканями по мере необходимости. Молекула гликогена малорастворима и, следовательно, не влияет на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза.
Гликоген хранится в цитозоле клетки в форме гранул диаметром 10–40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратами. Разветвленная структура гликогена обеспечивает появление большого количества концевых участков. Это способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как молекулы ферментов могут одновременно работать на нескольких ветвях полисахарида.
Гликоген депонируется главным образом в печени и скелетных мышцах. После приема пищи, богатой углеводами, запас гликогена в печени может составлять примерно 5% от ее массы. Мышцы могут запасать до 1% гликогена, но так как масса мышечной ткани значительно больше, чем в печени, то и
количество гликогена мышц больше. В организме может содержаться до 450 г. гликогена.
Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы, которая является источником энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки (рис. 8.5).
Рис. 8.5. Функции гликогена в печени
Раздел 8. Обмен углеводов
Синтез гликогена (гликогеногенез)
Гликоген синтезируется в период пищеварения (1–2 часа после приема углеводной пищи). Следует отметить, что синтез гликогена из глюкозы (рис. 8.6),


Рис. 8.6. Синтез гликогена:
А — синтез гликогена (общая схема); Б — полимеризация и ветвление молекулы гликогена; В — образование УДФ-глюкозы;
О, Ох — глюкозные остатки; О — глюкозные остатки в точке ветвления
как всякий анаболический процесс, является эндергоническим, т.е. требующим затрат энергии
Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в обратимой реакции превращается в глюкозо- 1-фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1- фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат↔ глюкозо- 1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридиндифосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФглюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образующийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на две молекулы фосфата.
Реакция образования УДФ-глюкозы обуславливает необратимость всей последовательности реакций, протекающих при синтезе гликогена. Этим же объясняется невозможность распада гликогена путем простого обращения процесса его синтеза.
УДФ-глюкоза далее используется как донор остатка глюкозы при формировании макромолекулы гликогена. Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называется синтазой, а не синтетазой.
Так как гликоген в клетке не расщепляется полностью, синтез гликогена осуществляется путем удлинения уже имеющейся молекулы полисахарида, называемой «затравкой», или праймером. К «затравке» последовательно присоединяются молекулы глюкозы. Строением молекулы «затравки» как бы предопределяется тип связи, который возникает в реакции трансгликозилирования. В состав «затравки» может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остается включенным в гранулу гликогена.
Разветвления в структуре гликогена образуется при участии амило-1,4 → 1,6- глюкозилтрансферазы, называемой ферментом «ветвления» — branching enzyme. Как только гликогенсинтаза синтезирует линейный участок, примерно до 11 глюкозных остатков (реакция 4), фермент ветвления переносит ее концевой блок, содержащий 6–7 остатков, на внутренний остаток глюкозы этой или другой цепи (реакция 5). В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С 6 -положении с образованием α-1,6-гликозидной связи. Новая точка ветвления может быть образо-
Раздел 8. Обмен углеводов
вана на расстоянии не менее 4 остатков от любой уже существующей. Таким образом, по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при ее синтезе и началом при ее распаде.
Распад гликогена (гликогенолиз)
Распад гликогена, или его мобилизация, происходит в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приемами пищи или этот процесс ускоряется в печени и мышцах во время физической работы.
Распад гликогена (рис. 8.7) происходит путем последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется
фосфоролизом, а фермент гликогенфосфорилазой.
Так же, как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахаридной цепи. При этом наличие разветвленной структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно.
Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остается четыре мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением ее активного центра.
Дальнейшее расщепление гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвления глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя ее и, таким образом, создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α -1,6-глюкозидазы в виде свободной глюкозы (реакция 3), после чего линейный участок гликогена может вновь атаковаться фосфорилазой.
Перенос трех остатков глюкозы и удаление мономера из точки ветвления (реакция 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями — трансферазной и гликозидазной. Его называют деветвящим (debranching enzyme) ферментом.
Продукт действия гликогенфосфорилазы глюкозо-1-фосфат затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой (реакция 4) . Далее глюкозо-6- фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент
Источник