Регуляция активности ферментов



Вещества, изменяющие активность ферментов, называют регуляторами. Они делятся на ингибиторы, снижающие ферментативную активность, и активаторы, повышающие ферментативную активность. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. Обратимые ингибиторы связываются с ферментами слабыми нековалентными связями и при определенных условиях легко отделяются от фермента, действуют кратковременно. Обратимые ингибиторы делятся на конкурентные и неконкурентные.
Конкурентные ингибиторы имеют структурное сходство с субстратом, в результате чего возникает конкуренция молекул субстрата и ингибитора за связывание с активным центром фермента. В этом случае с активным центром взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ЕS) или фермент-ингибитор (ЕI). При формировании ЕI комплекса продукт реакции не образуется. Активность фермента может быть восстановлена при повышении концентрации субстрата. Многие лекарственные препараты действуют как конкурентные ингибиторы. Например, сульфаниламиды, обладающие бактериостатическим действием, являются аналогами пара-аминобензойной кислоты, которую бактерии используют для синтеза фолиевой кислоты (необходимой для синтеза нуклеотидов и деления клеток).
Неконкурентные ингибиторы не похожи на субстрат, поэтому взаимодействуют с ферментом в участке, отличном от активного центра.
Необратимые ингибиторы образуют прочные ковалентные связи с ферментом, при этом чаще модификации подвергается активный центр фермента. В результате фермент не может выполнять свою каталитическую функцию. Например, фосфорорганические соединения ковалентно связывают ОН-группу серина, находящуюся в активном центре и играющую ключевую роль в процессе катализа. Такие ингибиторы, если используются как лекарства, действуют длительно (сутки, недели). Восстановление ферментативной активности может быть связано с синтезом новых молекул фермента.
Большинство ферментативных процессов в клетке протекают не в одну стадию, а представляют собой совокупность ферментативных реакций, объединенных в ферментативные цепи (метаболические пути), которые могут быть линейными (гликолиз), разветвленными, циклическими (цикл Кребса). Чтобы воздействовать на скорость метаболического пути, достаточно регулировать количество или активность ферментов. В метаболических путях нет надобности регулировать активность всех ферментов, обычно регулируется активность ключевых ферментов, которые определяют скорость метаболического процесса в целом.
Ключевыми ферментами являются:
· ферменты начала метаболического пути (первый фермент),
· ферменты, катализирующие скорость-лимитирующие (самые медленные) реакции,
· ферменты, находящиеся в месте разветвления метаболических путей.
Регуляция скорости ферментативных реакций может осуществляться путем:
· изменения количества молекул фермента,
· доступностью молекул субстрата и кофермента,
· регуляции каталитической активности молекул отдельных ферментов.
Регуляция количества молекул фермента в клетке может осуществляться путем изменения скорости его синтеза (индукция – увеличение скорости синтеза, репрессия – торможение) или путем изменения скорости его распада.
Важный параметр, контролирующий протекание метаболического пути, – наличие субстратов, главным образом – первого, чем больше его концентрация, тем выше скорость метаболического пути.
Регуляция каталитической активности отдельных ферментов. Основными способами регуляции являются: аллостерический и изостерический механизмы, регуляция с помощью белок-белковых взаимодействий, путем химической модификации, ограниченного (частичного) протеолиза.
Изостерическиймеханизм. В этом случае регулятор воздействует непосредственно на активный центр фермента. По такому механизму действуют конкурентные ингибиторы, некоторые металлы.
Аллостеричесий механизм. Многие ферменты помимо активного центра имеют еще и аллостерический центр, пространственно удаленный от активного центра. Аллостерические ферменты обычно являются олигомерными белками, состоящими из нескольких субъединиц. К аллостерическому центру нековалентно присоединяются эффекторы. В их роли могут выступать субстраты, конечные продукты метаболического пути, коферменты, макроэрги (причем АТФ и АДФ действуют как антагонисты: АТФ активирует процессы анаболизма и ингибирует катаболизм, АДФ – наоборот).

Аллостерических центров у фермента может быть несколько. Аллостерические ферменты обладают свойством положительной и отрицательной кооперативности. Взаимодействие эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению формы активного центра, что снижает или увеличивает сродство к субстрату, а значит, соответственно, уменьшает или увеличивает каталитическую активность фермента.
Внутримолекулярное взаимодействие белок – белок (только для олигомерных ферментов) с изменением олигомерности. ПротеинкиназаА – фермент, который фосфорилирует белки за счет АТФ, состоит из 4 субъединиц двух типов: двух субъединиц регуляторных и двух каталитических. Такой тетрамер не обладает каталитической активностью. При диссоциации тетрамерного комплекса освобождаются две каталитические субъединицы и фермент становится активным. Такой механизм регуляции обратим. Ассоциация регуляторных и каталитических субъединиц протенкиназы А вновь приводит к образованию неактивного комплекса.
Регуляция активности ферментов путем химической модификации. Это наиболее часто встречаемый механизм регуляции активности ферментов путем ковалентной модификации аминокислотных остатков. При этом модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами за счет АТФ. Присоединение остатка фосфорной кислоты приводит к изменению каталитической активности, при этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие – становятся менее активными. Изменение активности путем фосфорилирования обратимо. Отщепление остатка фосфорной кислоты осуществляется протенфосфатазами.
Регуляция активности ферментов путем ограниченного протеолиза. Некоторые ферменты синтезируются в виде неактивных предшественников – проферментов и активируются в результате гидролиза одной или нескольких определенных пептидных связей, что приводит к отщеплению части белковой молекулы профермента. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр и фермент становится активным. Отщепление пептида от белков-предшественников катализируют ферменты пептидазы.
При этом активность фермента изменяется необратимо. Ограниченный протеолиз лежит в основе активации протеолитических ферментов ЖКТ, белков свертывающей системы крови и системы фибринолиза, а также белково-пептидных гормонов. Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в кишечник, где на него действует фермент энтеропептидаза. В результате происходит ограниченный протеолиз с отщеплением гексапептида. При этом в оставшейся части молекулы формируется активный центр и образуется активный трипсин.
Источник
ТЕМА 2.8. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
1.Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути (последовательного превращения одних веществ в другие), достаточно регулировать количество молекул фермента или их активность. Обычно в метаболических путях имеются ключевые ферменты,за счет которых происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами.Регуляция скорости ферментативных реакций осуществляется на трех независимых уровнях: изменением количества молекул фермента, доступностью молекул субстрата и кофермента, изменением каталитической активности молекулы фермента (табл. 2.6).
Таблица 2.5. Способы регуляции скорости ферментативных реакций
| Способ регуляции | Характеристика |
| Изменение количества молекул фермента | Количество молекул фермента в клетке определяется соотношением двух процессов: синтеза и распада. Наиболее изучен механизм регуляции синтеза фермента на уровне транскрипции (синтеза мРНК), который регулируется определенными метаболитами, гормонами и рядом биологически активных молекул |
| Доступность молекул субстрата и кофермента | Важный параметр, контролирующий протекание ферментативной реакции, — наличие субстрата и кофермента. Чем больше концентрация исходного субстрата, тем выше скорость реакции |
| Изменение каталитической активности молекулы фермента | Основными способами регуляции активности ферментов являются: — аллостерическая регуляция; — регуляция с помощью белок-белковых взаимодействий; — регуляция путем фосфорилирования-дефосфорилирова- ния молекулы фермента; — регуляция частичным (ограниченным) протеолизом |
Рассмотрим способы регуляции скорости ферментативных реакций за счет изменения каталитической активности молекулы фермента.
2. Аллостерическая регуляция. Аллостерическими ферментаминазывают ферменты, активностькоторых может регулироватьсяс помощью веществэффекторов.Участвующие в аллостерической регуляции эффекторы — это клеточные метаболиты, которые часто являются участниками именно того пути, регуляцию которого они осуществляют.
Эффектор, который вызывает снижение (ингибирование)активности фермента, называется ингибитором.Эффектор, который вызываетповышение (активацию)активности ферментов, называют активатором.
Аллостерические ферменты имеют определенные особенности строения:
— обычно являются олигомерными белками,состоящими из нескольких протомеров;
— имеют аллостерический центр,пространственно удаленный от каталитического активного центра;
— эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах.
Аллостерические центры, так же как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие — к ингибиторам.
Протомер, на котором находится аллостерический центр, называется регуляторным протомеромв отличие от каталитического протомера,содержащего активный центр, в котором проходит химическая реакция.
Аллостерические ферменты обладают свойством кооперативности:взаимодействие аллостерического эффектора с аллостерическим центром вызывает кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или повышает каталитическую активность фермента. Если к аллостерическому центру присоединяется ингибитор, то в результате кооперативных конформационных изменений происходит изменение конформации активного центра, что вызывает снижение сродства фермента к субстрату и, соответственно, снижение скорости ферментативной реакции. И наоборот, если к аллостерическому центру присоединяется активатор, то сродство фермента к субстрату увеличивается, что вызывает повышение скорости реакции. Последовательность событий при действии аллостерических эффекторов представлена на рис. 2.26.
Регуляция аллостерических ферментов обратима:отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента.
Аллостерические ферменты катализируют ключевые реакцииданного метаболического пути.
Аллостерические ферменты играют важную роль в различных метаболических путях, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состава клетки. Скорость метаболических процессов зависит от концентрации веществ, как использующихся, так и образующихся в данной цепи реакций. Исходные вещества могут быть активаторами аллостерических ферментов метаболического пути. В то же время при накапливании конечного продукта какого-либо метаболического пути он может действовать как аллостерический ингибитор фермента. Такой способ регуляции распространен в организме и носит название «отрицательная обратная связь»:

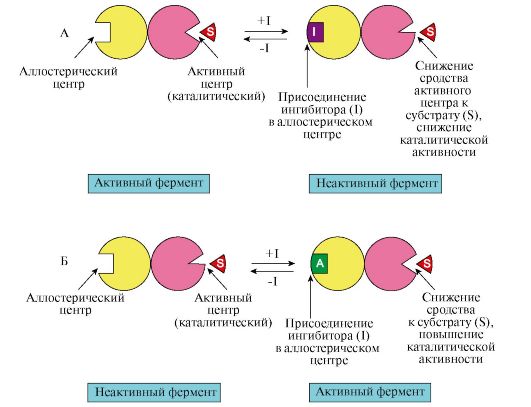
А — действие отрицательного эффектора (ингибитора). Ингибитор (I) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения в молекуле фермента, в том числе и в активном центре фермента. Сродство фермента к субстрату снижается, в результате снижается и скорость ферментативной реакции; Б — действие положительного эффектора (активатора). Активатор (А) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения. Сродство фермента к субстрату повышается, и скорость ферментативной реакции увеличивается. Продемонстрировано обратимое действие как ингибитора, так и активатора на активность фермента
Рассмотрим аллостерическую регуляцию процесса катаболизма глюкозы, который заканчивается образованием молекулы АТФ (рис. 2.27). В том случае, если молекулы АТФ в клетке не расходуются, она является ингибитором аллостерических ферментов данного метаболического пути: фосфофруктокиназы и пируваткиназы. В то же время промежуточный метаболит катаболизма глюкозы — фруктозо-1,6-бисфосфат является аллостерическим активатором фермента пируваткиназы. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяет

Молекула АТФ является аллостерическим ингибитором ферментов метаболического пути — фосфофруктокиназы и пируваткиназы. Молекула фруктозо-1,6-бисфосфата является аллостерическим активатором фермента пируваткиназы
осуществлять регуляцию скорости метаболического пути. Аллостерические ферменты катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте разветвления метаболического пути.
3. Регуляция с помощью белок-белковых взаимодействий.Некоторые ферменты изменяют свою активность в результате белок-белковых взаимодействий. Можно выделить по крайней мере два механизма изменения активности фермента таким способом: активация ферментов в результате присоединения белков-активаторов (активация фермента аденилатциклазы с помощью α-субъединицы G-белка, см. модуль 4) и изменение каталитической активности в результате ассоциации и диссоциации протомеров.
В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно рассмотреть регуляцию фермента протеинкиназы А.
Протеинкиназа А(цАМФ-зависимая) состоит из четырех субъединиц двух типов: двух регуляторных (R) и двух каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3′,5′-АМФ (цАМФ) (по два на каждую субъединицу). Присоединение четырех молекул цАМФ к двум регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса; при этом высвобождаются две активные каталитические субъединицы (рис. 2.28). Активная протеинкиназа А катализирует перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (т.е. вызывает фосфорилирование белков).
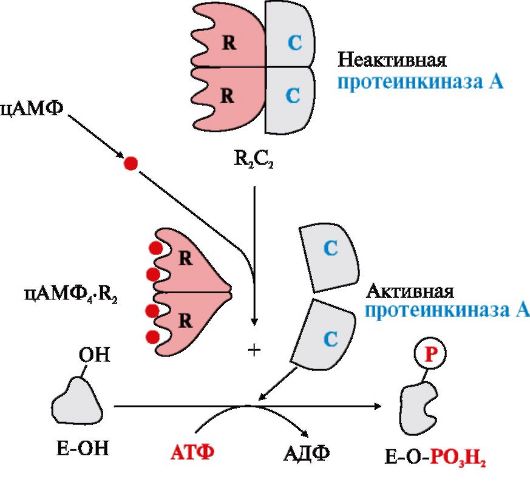
Активация ПКА осуществляется с помощью четырех молекул цАМФ, которые присоединяются к двум регуляторным субъединицам, что приводит к изменению конформации регуляторных протомеров и диссоциации тетрамерного комплекса. При этом высвобождаются две активные каталитические субъединицы, способные вызывать фосфорилирование белков
Отщепление молекул цАМФ от регуляторных субъединиц приводит к ассоциации регуляторных и каталитических субъединиц протенкиназы А с образованием неактивного комплекса.
4. Регуляция каталитической активности ферментов путем фосфорилирова- ния-дефосфорилирования.В биологических системах часто встречается механизм регуляции активности ферментов с помощью их ковалентной модификации. Быстрым и широко распространенным способом химической модификации ферментов является их фосфорилирование-дефосфорилирование.
Фосфорилирова-нию подвергаются ОН-группы фермента, которое осуществляется ферментами протеинкиназами(фосфорилирование) ифосфопротеинфосфатазами(дефосфорилирование). Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными (рис. 2.29). Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро варьировать активность ключевых ферментов метаболических путей в зависимости от условий внешней среды.

Фосфорилирование ферментов происходит с помощью фермента протеинкиназы. Донором остатка фосфорной кислоты является молекула АТФ. Фосфорилирование фермента изменяет его конформацию и конформацию активного центра, что изменяет сродство фермента к субстрату. При этом некоторые ферменты при фосфорилировании активируются, другие — ингибируются. Обратный процесс — дефосфорилирование — вызывают ферменты фосфопротеинфосфатазы, отщепляющие остаток фосфорной кислоты от фермента и возвращающие фермент в исходное состояние
5. Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом.Некоторые ферменты, которые функционируют вне клеток (в желудочно-кишечном тракте или плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определенных пептидных связей, который приводит к отщеплению части молекулы. В оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента (рис. 2.30). Частичный протеолиз представляет собой пример регуляции, когда активность фермента изменяется

В результате гидролиза одной или нескольких пептидных связей пепсиногена (неактивной молекулы) отщепляется часть молекулы и формируется активный центр фермента пепсина
необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации пищеварительных протеолитических ферментов (пепсин, трипсин, химотрипсин, эластаза), пептидных гормонов (инсулин), белков свертывающей системы крови и ряда других белков.
Источник







