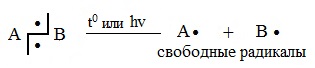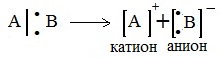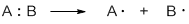- Способ разрыва ковалентной связи зависит от длины связи
- Способ разрыва ковалентной связи зависит от длины связи
- Типы разрыва ковалентной связи
- Характеристики ковалентной связи
- 1. Длина ковалентной связи
- 2. Энергия ковалентной связи
- 3. Полярность ковалентной связи
- 4. Поляризуемость ковалентной связи
- 5. Насыщаемость ковалентной связи
- 6. Направленность ковалентной связи
- 7. Кратность ковалентной связи
- Способ разрыва ковалентной связи зависит от длины связи
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Электронная природа химических связей в органических соединениях. Способы разрыва ковалентной связи
Способ разрыва ковалентной связи зависит от длины связи
По способу разрыва ковалентных связей органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
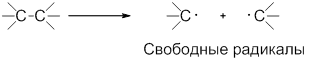
1. Свободнорадикальный (гомолитический) разрыв связей
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
Такому разрыву подвергаются неполярные и малополярные ковалентные связи под действием света или высокой температуры. Образующиеся частицы содержат неспаренные электроны и называются свободными радикалами. Эти частицы обладают большой энергией и очень активны.
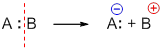
2. Ионный (гетеролитический) разрыв связей
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом.
Устойчивы более разветвлённые катионы.
Такому разрыву подвергаются полярные ковалентные связи.
Образующиеся органические ионные частицы отличаются от неорганических тем, что они возникают в момент реакции.
Источник
Способ разрыва ковалентной связи зависит от длины связи
- Главная
- Обучение
- Предварительный просмотр
- Мероприятия / ВИШР
- Обучение
- Тренажер ЕГЭ
- Учебные пособия
- Игры
- 120 лет ТПУ. Викторина онлайн
- Университетские субботы
- Высшая инженерная школа России
Химия
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Типы разрыва ковалентной связи
Разрыв ковалентной связи может происходить по гомолитическому или гетеролитическому механизмам.
Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону:
Гомолиз от греческого homos – одинаковый, lysis – разрыв.
В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например:
Радикал – атом или группа атомов, имеющие неспаренный электрон.
Гетеролитические реакции – реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов:
Гетеролиз – это несимметричный разрыв ковалентной связи, в результате которого образуются разные по природе частицы: катион и анион.
Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например:
Электронная пара остается у более электроотрицательного атома.
Источник
Характеристики ковалентной связи
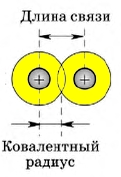
1. Длина ковалентной связи
Длиной ковалентной связи называют расстояние между ядрами атомов, которые образуют связь. Длина связи напрямую связана с радиусом атома — чем он больше, тем длиннее связь.
Значения ковалентных радиусов некоторых атомов (пм; 10 -12 м):
В симметричных молекулах (H2, F2, Cl2. ) половину длины связи называют ковалентным радиусом. Зная ковалентный радиус, очень легко вычислять длину ковалентной связи в молекуле. Например, длина ковалентной связи молекулы HF = 30 + 58 = 88 пм.
2. Энергия ковалентной связи
Под энергией ковалентной связи (выражают в ккал/моль или кДж/моль) обычно понимают энергию, которая необходима для разрыва связи (при образовании ковалентной связи энергия выделяется, при разрыве — поглощается). Чем выше энергия связи, тем прочнее связь.
Энергия связи зависит от ее длины — чем длиннее связь в молекуле, тем проще ее разорвать (затратить меньше энергии).
Энергии связи некоторых молекул (кДж/моль):
3. Полярность ковалентной связи
Данная характеристика отображает расположение электронной пары двух атомов, образующих связь. Степень полярности связи зависит от величины электроотрицательности атомов, образующих связь (чем она больше, тем больше полярность связи). У более полярной ковалентной связи общая пара электронов больше смещена к более электроотрицательному атому (см. понятие электроотрицательности).
Электроотрицателность является табличной величиной, определяемой по шкале Поллинга. Гораздо более важно знать не саму электроотрицательность атома как таковую, но разницу этих значений в молекуле — какой из атомов более электроотрицателен, а какой менее.
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой. Совсем другая картина наблюдается в сложных молекулах, в которых дипольный момент молекулы складывается из суммы векторов дипольных моментов отдельных связей.
4. Поляризуемость ковалентной связи
Поляризуемость отображает степень способности электронов смещаться под воздействием внешнего электрического поля, формируемого ионами или другими полярными молекулами.
Поляризуемость ковалентной связи прямо пропорциональна ее длине, что, в общем-то, логично — чем дальше от ядра атома находится электрон, тем он слабее им притягивается, поэтому, легче смещается при внешнем воздействии на него. Таким образом, с увеличением длины связи происходит увеличение ее поляризуемости, что, в свою очередь, приводит к возрастанию силы кислот (например, йодистоводородная кислота сильнее фтороводородной).
Поляризуемость и полярность связи являются обратнозависимыми величинами: менее полярная связь больше поляризуется, и наоборот.
5. Насыщаемость ковалентной связи
Насыщаемостью называют способность атома образовывать определенное кол-во ковалентных связей — в образовании связи стремятся принять участие все «неспаренные» электроны атома. Например, атом водорода имеет только один неспаренный электрон, а атом азота — три. По этой причине наиболее устойчивым химическим соединением будет NH3, но не NH или NH2.
6. Направленность ковалентной связи
Направленность характеризует пространственную ориентацию ковалентной связи относительно других связей молекулы. В молекулах электроны ковалентных связей и свободные пары электронов постоянно испытывают взаимное отталкивание в результате чего ковалентные связи располагаются так, что валентный угол между ними отвечает принципу наименьшего отталкивания между электронами (например, в молекуле воды валентный угол составляет 104,5°).
7. Кратность ковалентной связи
В некоторых случаях между атомами могут возникать не одна, а две (двойная связь) или три (тройная связь) общих электронных пар (так называемые кратные связи).
Двойная ковалентная связь образуется у атомов, имеющих по два неспаренных электрона; тройная — у атомов, имеющих по три неспаренных электрона (см. Множественные связи).
Как видно из таблицы, приведенной ниже, молекула азота примерно в 7 раз «крепче» молекулы фтора.
Таблица зависимости длины и прочности ковалентной связи от ее кратности:
| Молекула | F2 | O2 | N2 |
|---|---|---|---|
| Кратность связи | одинарная | двойная | тройная |
| Прочность связи (энергия), кДж/моль | 139 | 494 | 942 |
| Длина связи, пм | 141 | 121 | 109 |
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Способ разрыва ковалентной связи зависит от длины связи
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Электронная природа химических связей в органических соединениях. Способы разрыва ковалентной связи
Данный урок поможет вам получить представление о теме «Ковалентная связь в органических соединениях». Вы вспомните природу химических связей. Узнаете о том, за счет чего образуется ковалентная связь, что является основой этой связи. На этом уроке также рассматривается принцип построения формул Льюиса, рассказывается о характеристиках ковалентной связи (полярности, длине и прочности), объясняется теория А. Бутлерова
I. Электронная природа химических связей в органических соединениях
1. Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит в возбуждённое состояние:
2. Органическим соединениям свойственны ковалентные связи. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.
а) Из курса химии 8 класса вы знаете, что ковалентная связь образуется за счёт перекрывания электронных облаков, при этом выделяется энергия, чем больше перекрывание, тем больше выделяется энергии и тем прочнее связь.
Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании:
σ(s – s)
б) Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10 -9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше:
в) Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
г) Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов.
Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона:
1 электрон на s – орбитали сферической формы
3 электрона на трёх p – орбиталях, орбитали имеют форму гантели и расположены под углом 90˚.
Таким образом можно предположить, что в молекуле метана CH4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на s – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
II. Гибридизация атомных орбиталей
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp 3 , sp 2 , sp.
1) sp 3 – гибридизация
Происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Рис. Строение молекулы метана СН4 (тетраэдрическое)
2) sp 2 – гибридизация:
Происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи.
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании П — связи.
Рис. Строение молекулы этилена С2Н4 (плоское тригональное)
3) sp – гибридизация
Происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи.
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П — связи.
Рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
III. Степень окисления атома углерода
Для атома углерода в органических соединениях характерны степени окисления от -4 до +4.
Укажите степени окисления всех элементов в CH3CH2OH
Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы (СН3 –) . Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность углерода превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН2ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3C -1 H +1 2O -2 H +1 .
IV. Простая и кратная ковалентные связи
Способность атома углерода иметь разные степени окисления и лёгкость гибридизации позволяет атому углерода образовывать одинарные, и кратные (двойные и тройные связи) не только с другими атомами углерода, но и с атомами других элементов-органогенов:
СН3 – СН3 (1 σ – сигма связь С-С)
CH2=CH2 (1 σ – сигма связь С-С и 1 П – пи связь С-С)
CH ≡ CH (1 σ – сигма связь С-С и 2 П – пи связи С-С)
V. Способы разрыва связей в молекулах органических веществ и механизмы органических реакций
Разрыв ковалентной связи может происходить двумя способами.
1. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию.
Гомолитический разрыв сопровождает процессы, осуществляемые при высоких температурах; на свету; при радиоактивном облучении в отсутствие растворителя (в газовой фазе) или неполярных растворителях. Гомолитическому разрыву подвергаются малополярные или неполярные связи C—C, C—H, Cl—Cl и др.
2. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
А + — электрофильная частица,
:В — — нуклеофильная частица
В результате образуются разноименно заряженные ионы — катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом.
Устойчивы более разветвлённые катионы!
Ионный тип разрыва связи характерен для П- связей и полярных σ – связей; при наличии полярного растворителя или катализатора.
Источник