- Медицинские интернет-конференции
- Языки
- Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
- Резюме
- Ключевые слова
- Статья
- Литература
- Аппаратные методы коррекции фигуры: как гибнут жировые клетки
- Виды клеточной гибели.
- Ультразвуковой липолиз
- Пример аппарата
- Что происходит на микроуровне?
- Что происходит на макроуровне?
- Побочные эффекты
- Лазерный липолиз
- Пример аппарата
- Что происходит на микроуровне?
- Что происходит на макроуровне?
- Побочные эффекты
- Криолиполиз
- Пример аппарата
- Что происходит на микроуровне?
- Что происходит на макроуровне?
- Побочные эффекты
- Радиочастотный (RF) липолиз
- Пример аппарата
- Что происходит на микроуровне?
- Что происходит на макроуровне?
- Побочные эффекты
- «Усиленный» RF-липолиз
- Пример аппарата
- Что происходит на микроуровне?
- Что происходит на макроуровне?
- Побочные эффекты
- Заключение
- Литература
- Абстракт
Медицинские интернет-конференции
Языки
Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
Булудова М.В., Полутов В.Э.
Резюме
В работе представлены современные данные литературы, относительно механизмов развития апоптоза, его принципиальных отличий от некроза, значение в поддержании клеточного гомеостаза в лимфоидной и других пролиферирующих тканях.
Ключевые слова
Статья
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. (Попков В.М., Чеснокова Н.П., Барсуков В.Ю., 2011).
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития, имеет место при различных морфогенетических процессах, обеспечивает поддержание клеточного гомеостаза как в лимофоидной ткани, так и в других пролиферирующих тканях. Нарушение апоптоза в эмбриогенезе может приводить к внутриутробной гибели плода, врожденным уродствам или различным заболеваниям, в том числе и злокачественным новообразованиям.
Различают два типа гибели клетки: апоптоз и некроз. Принципиальные различия заключаются в следующем: некроз является результатом незапланированного события и происходит спонтанно, апоптоз формируется как четко — регулируемый, генетически-детерминируемый процесс элиминации клетки. Отличительной морфологической чертой апоптоза является коллапс ядра. Хроматин становится суперконденсированным в форме полумесяца по периферии ядра, в этот момент начинается фрагментация ДНК. Характерными признаками апоптоза, позволяющими отличить его от некроза, являются:
а) переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой; выход цитохрома С из межмембранного пространства митохондрий в цитоплазму
б) активация цистеиновых протеиназ (каспаз)
в) образование активных форм кислорода
г) сморщивание (blebbing) цитоплазматической мембраны
д) последующий распад ядра на части
е) фрагментация клеток на везикулы с внутриклеточным содержимым — апоптотические тельца
ж) апоптотические тела захватываются фагоцитирующими клетками микроокружения, как в случае некроза. При развитии апоптоза выброса клеточного содержимого не происходит, воспаление не возникает. Некроз распространяется обычно на группы клеток, в то время как апоптоз носит селективный характер в отношении отдельных клеток (Дмитриева Л.А., Максимовский Ю.М., 2009).
Стадии апоптоза
Стадия инициации. На этой стадии патогенный агент либо сам является информационным сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. Трансмембранные сигналы подразделяют на отрицательные и положительные. Отрицательные сигналы обусловливают отсутствие или прекращение воздействия на клетку различных факторов роста, регулирующих деление и созревание клетки. Положительные сигналы генерируют запуск программы апоптоза. Так, связывание TNFα (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной функции, либо блокируют потенциально летальный сигнал. Выделяют два варианта реализации стадий программирования: 1) путём прямой активации эффекторных каспаз и эндонуклеаз (минуя геном клетки) и 2) опосредованной через геном передачи сигнала на эффекторные каспазы и эндонуклеазы. Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С. Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза, и активацию генов, кодирующих промоторы апоптоза.
Стадия реализации программы состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов.
Непосредственными исполнителями процесса «умертвления» клетки являются Ca2+,Mg2+ -зависимые эндонуклеазы и эффекторные каспазы. В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции, когда в ней формируются и отпочковываются фрагменты клетки, содержащие остатки органелл, цитоплазмы, хроматина и цитолеммы, то есть апоптозные тельца.
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство. (Лихтенштейн А.В., Шапот В.С., 1998).
Одно из апоптотических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза, связанной с проявлением активности различных эндонуклеаз, последние обусловливают либо появление крупных фрагментов ДНК, или развитие межнуклеосомальной деградации ДНК. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Исследования последних лет привели к формированию принципиально новых представлений о механизме гибели клеток, имеющих повреждения ДНК, как о процессе, осуществляемом в соответствии с определенной генетической программой. В индукции этой программы при наличии повреждений в ДНК клетки важная роль принадлежит белку р53. Этот белок с молекулярной массой 53 кД, локализован в ядре клетки и является одним из транскрипционных факторов. Повышенная экспрессия этого белка приводит к репрессии ряда генов, регулирующих транскрипцию и причастных к задержке клеток в фазе клеточного цикла G1. Если же активность репарационных систем недостаточна и повреждения ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная гибель, или апоптоз, что приводит к защите организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Таким образом, при действии генотоксических агентов р53 не только увеличивает время репарации ДНК. но также защищает организм от клеток с опасными мутациями. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Механизмы индукции апоптоза
Регуляция апоптоза обеспечивается гормонами, цитокинами и в значительной мере особенностями генома. Ослабление или устранение гормональных влияний на клетки- мишени приводит, как правило, к индукции апоптоза.
Цитокины — это обширная группа белков, регулирующих пролиферацию и дифференцировку клеток при связывании со специфическими рецепторами на клетках мишенях. Цитокины подразделяются на 3 большие группы: ростовые, семейство Фактора некроза опухоли и спиральные цитокины. Эффект цитокинов на клетки неоднозначен в связи с гетерогенностью их структуры и функции: для одних клеток ряд цитокинов выступают в роли индукторов апоптоза, а для других — в роли ингибиторов апоптоза. Это зависит от типа клетки, от стадии ее дифференцировки, от функционального состояния клетки. (Goodwin P.J., Ennis M., Pritchard K.I., 2002).
Наиболее хорошо изучена последовательность событий, приводящих клетку к апоптозу в результате взаимодействия белков из семейства TNFα со специфическими рецепторами. Ярким представителем этой группы белков является система Fas/Fas-L. Следует отметить, что для этой системы не известны другие функции, кроме как индукции апоптоза клетки. Взаимодействие Fas с Fas-L (лиганд) или с моноклональными антителами приводит к апоптозу клетки. При связывании лиганда с рецептором происходит олигомеризация цитоплазматических белков: (1) DD (домен смерти), относящийся к рецептору, (2) адапторного белка — FADD (Fas-ассоциированный домен смерти), содержащий DED — эффекторный домен смерти и (3) прокаспазы-8. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Важная роль в регуляции апоптоза клеток иммунной системы принадлежит другим цитокинам -интерлейкинам, интерферонам. Было обнаружено, что интерлейкины являются индукторами апоптоза как в здоровых, так и в малигнизированных клетках и клеточных линиях. Однако не только роль индукторов апоптоза свойственна интерлейкинам, не менее выраженный эффект цитокинов наблюдается в предотвращении апоптоза. При этом один и тот же IL может быть как индуктором апоптоза, так и его ингибитором. Так, например, IL 1 является индуктором апоптоза для клеток мышиной тимомы в случаях ингибирования размножения клеток и ингибитором апоптоза для этих же клеток в случаях их интенсивного размножения. Неоднозначна и роль интерферонов по влиянию на клетки. В одних случаях IFN вызывает апоптоз (клетки костного мозга), в других — является ингибитором апоптогенного сигнала (периферические моноциты человека).
Таким образом, апоптоз является тем механизмом, который обуславливает элиминацию клеток с определенной специфичностью рецепторов. (Миронова С.П., Котельников Г.П., 2013).
В настоящее время складывается впечатление о центральной роли протеаз в запуске и развитии процесса апоптоза. Причем, по-видимому, при апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции протеолиза, катализируемые специфическими протеазами, относящихся к классу цистеиновых протеаз.
Роль наследственных факторов в регуляции апоптоза
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. К настоящему времени известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Bax, Bcl-Xs, Bik, Bid, Bak), либо к ингибиторам (Bcl-2, Bcl-XL). Белки семейства Bcl-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяют реостат жизни и смерти клетки. (Попков В.М., Чеснокова Н.П., Захарова Н.Б., 2016).
Таким образом, апоптоз является общебиологическим механизмом, ответственным за поддержание постоянства численности клеточных популяций, а также формообразование и выбраковку дефектных клеток. Нарушение регуляции апоптоза приводит к возникновению различных заболеваний, связанных с усилением или, наоборот, ингибированием апоптоза. Следовательно, изучение механизмов регуляции различных этапов данного процесса позволит определенным образом воздействовать на его отдельные этапы с целью их регуляции или коррекции. В настоящее время общепринято: если клетка погибает от апоптоза — подразумевается возможность терапевтического вмешательства, если вследствие некроза — нет. На основе знаний о программированной гибели клетки используется широкий ряд препаратов с целью регуляции этого процесса в различных типах клеток.
Многообещающими являются также подходы, связанные с регуляцией апоптоз- специфических генов и реализующиеся, в частности, в генной терапии — одной из самых перспективных областей современной медицины — при лечении заболеваний, вызванных нарушением функционирования отдельных генов. (Макаренко Н.И., Поддубная И.В., Подрегульский К.Э., 2006).
Литература
1. Дмитриева Л.А., Максимовский Ю.М. — М. : ГЭОТАР-Медиа, 2009. — 912 с. — (Серия «Национальные руководства»)
2. Кочан Е.А. Молекулярно-генетические основы канцерогенеза // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2002. — №3. — С. 32-36.
3. Лихтенштейн А.В., Шапот В.С. Опухолевый рост: ткани, клетки, молекулы // Патологическая физиология. — 1998. — №3. — С. 25-44.
4.Макаренко Н.И., Поддубная И.В., Подрегульский К.Э. Новые возможности лекарственной терапии злокачественных опухолей // — М., 2006. – С.27.
5. Миронова С.П., Котельников Г.П., / Национальное руководство / — 2-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2013. — 944 с.
6. Паукова В.С., Пальцева М.А., Улумбекова Э.Г. Опухолевый рост // 2-е изд., испр. и доп. — М.: ГЭОТАР-Медиа, 2015. — 2500 с.
7. Попков В.М., Чеснокова Н.П., Барсуков В.Ю., / Канцерогенез : патофизиологические и клинические аспекты/ — Саратов : Изд-во: СГМУ, 2011, 600 с.
8. Попков В.М., Чеснокова Н.П., Захарова Н.Б., под общ. ред. В.М. Попкова, Н.П. Чесноковой./ Цитокины: биологическая роль в развитии реакций адаптации и повреждения в условиях нормы и патологии различного генеза/ — Саратов: Изд-во Сарат. гос. мед. ун-та, 2016.-448 с.
Источник
Аппаратные методы коррекции фигуры: как гибнут жировые клетки
Раханская Екатерина Михайловна
врач-невролог, медицинский журналист (Минск, Беларусь)
Бороться с локальными жировыми отложениями можно с помощью различных методов аппаратной косметологии — ультразвукового, лазерного, крио- и радиочастотного. Результатом всех этих процедур на макроуровне является уменьшение подкожной жировой прослойки. А что происходит на микроуровне?
Термин «безоперационная липосакция» является по большей части маркетинговым, он прижился в эстетической медицине как преемник аналогичной хирургической процедуры. При классической (вакуумной) липосакции происходит механическое разрушение жировой ткани с последующей ее элиминацией с помощью аспиратора. Аппаратные же методы коррекции фигуры обеспечивают уничтожение жировых клеток без хирургических манипуляций. Попробуем разобраться, как гибнут адипоциты.
Виды клеточной гибели.
Долгое время считалось, что клетки человеческого организма могут погибать только двумя способами: либо путем некроза (непосредственный результат несовместимого с жизнью повреждения), либо путем апоптоза (в результате активации генетической программы самоуничтожения) (рис. 1, табл. 1).
| Признак | Апоптоз | Некроз |
|---|---|---|
| Индукция | Активируется физиологическими или патологическими стимулами | Различная (в зависимости от повреждающего фактора) |
| Распространенность | Одиночная клетка | Группа клеток |
| Биохимические изменения | Энергозависимая фрагментация ДНК эндогенными эндонуклеазами (лизосомы интактные) | Нарушение или прекращение ионного обмена (из лизосом высвобождаются ферменты) |
| Распад ДНК | Внутриядерная конденсация с расщеплением на фрагменты | Диффузная локализация в некротизированной клетке |
| Целостность клеточной мембраны | Сохранена | Нарушена |
| Морфология | Сморщивание клеток и фрагментация с формированием апоптотических телец с уплотненным хроматином | Набухание и лизис клеток |
| Воспалительный ответ | Нет | Обычно есть |
| Удаление погибших клеток | Поглощение (фагоцитоз) соседними клетками либо макрофагами | Поглощение (фагоцитоз) нейтрофилами и макрофагами |
Таблица 1. Отличительные признаки некроза и апоптоза [27, 29]
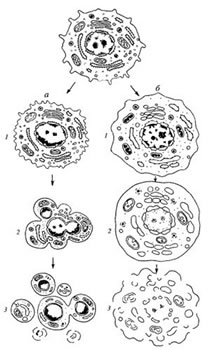 | Рис. 1. Два классических пути клеточной гибели [24]: 1) апоптоз (а): 1 — уплотнение цитоплазмы и содержимого ядра (кариопикноз); 2 — фрагментация ядра; 3 — фрагментация клетки на апоптические тельца (плазморексис); 2) некроз (б): 1 — набухание цитоплазмы и матрикса органелл, конденсация хроматина; 2 — дальнейший прогрессирующий отек, распад ядра на части (кариорексис); 3 — растворение ядра (кариолизис), разрыв мембранных компонентов клетки — лизис клетки |
Однако исследования последних 10–15 лет доказали, что клеточная смерть не сводятся к простой дилемме «апоптоз — некроз» [30]. Способов погибнуть у клетки больше двух, и они отличаются друг от друга биохимически и морфологически. Более того, ранние представления о том, что апоптоз является вариантом программируемой клеточной смерти, а некроз представляет собой ее неспецифический вариант, оказались ошибочными (некроз тоже может быть программируемым) [12]. На основании последних научных открытий в 2012 г. Международный Номенклатурный Комитет по клеточной смерти (Nomenclature Committee on Cell Death, NCCD) предложил классификацию, которая включила в себя 12 типов программируемой клеточной смерти [26] (табл. 2).
| Типы клеточной смерти | Основные биохимические особенности |
|---|---|
| 1. Аноикис (вариант апоптоза в ответ на нарушение адгезии клеток, пример: уменьшение объема молочной железы у женщины при отказе от кормления ребенка грудью) |
|
| 2. Аутофагическая клеточная смерть (внутренние структуры клетки доставляются в лизосомы и там разрушаются) |
|
| 3. Внутренний (митохондриальный) апоптоз, каспазозависимый и каспазонезависимый пути |
|
| 4. Корнификация (кератинизация, процесс ороговения ткани) |
|
| 5. Энтоз (одна клетка проникает в другую и переваривается ею) |
|
| 6. Онкоз (пассивная форма клеточной гибели, альтернатива апоптозу, он же — некроз клетки) |
|
| 7. Внешний апоптоз (рецепторно опосредованный) | 1) опосредованный через рецепторы клеточной смерти |
- запуск сигнального пути, обусловленного инициацией соответствующих рецепторов;
- активация каспазы-8 и -10;
- расщепление BID в активный tBID, который способствует пермеабилизации внешней мембраны митохондрий (клетки II типа);
- активация каспазы-3, -6 и -7
2) опосредованный через «зависимые» рецепторы:
- запуск сигнального пути, обусловленного инициацией «зависимых» рецепторов;
- активация PP2A; активация DAPK1;
- активация каспазы-9;
- активация каспазы-3 (-6, -7)
8. Митотическая катастрофа (гибель клетки в результате грубых нарушений митоза под действием радиации или стресса)Митотическая катастрофа может протекать либо в виде апоптоза, либо в виде некроза, в зависимости от того, какие белки экспрессируются в той или иной ткани:
- активация каспазы-2 (в некоторых случаях);
- активация гена, кодирующего белок р53 или р73 (в некоторых случаях);
- митотический блок
9. Некроптоз (программируемая гибель клетки путем некроза)
- запуск сигнального пути, обусловленного инициацией рецепторов смерти;
- ингибирование каспаз;
- активация рецепторов протеинкиназы 1 и 3
10. Нетоз (гибель нейтрофилов с образованием сети из ДНК и белков, в которой «запутываются» патогенные микроорганизмы)
- ингибирование каспаз;
- активация НАДФН-оксидазы;
- продукция NET — нейтрофильной внеклеточной «ловушки» (в некоторых случаях) [28]
11. Партанатоз (гибель клеток в результате сверхактивации ферментов PARP — поли-(АДФ-рибоза) полимераз)
- PARP1-опосредованное накопление поли-(АДФ-рибозы) (PAR);
- необратимое снижение митохондриального мембранного потенциала;
- истощение АТФ и НАДН;
- сродство апоптоз-индуцирующего фактора к PAR
12. Пироптоз (так гибнут макрофаги в борьбе с инфекционными агентами, пироптоз по своим характеристикам занимает среднее положение между некрозом и апоптозом)
- активация каспазы-1 и -7;
- секреция ИЛ-1β и ИЛ-18
Таблица 2. Функциональная классификация программируемой клеточной смерти [12, 26]
Впрочем, при всем богатстве выбора клеточных смертей в процессе аппаратной коррекции фигуры адипоциты гибнут «по старинке» — в результате некроза либо апоптоза. Исключение составляет комбинированное RF-воздействие на аппарате BodyFX\TiteFX, при котором жировые клетки погибают в результате пироптоза (табл. 3).
| Технология | Механизм действия | Интенсивность болевого воздействия | Побочные эффекты | Необходимое количество процедур | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ультразвуковой липолиз | Некроз | Высокая | Кратковременные болевые ощущения и долгосрочная отечность после ВИФУ | |||||||||||
| Лазерный липолиз (НИЛИ) | Точный механизм неизвестен | Нет | Нет | |||||||||||
| Криолиполиз | Апоптоз | Низкая | Болевые ощущения, отечность, снижение чувствительности | |||||||||||
| Радиочастотный (RF) липолиз | Апоптоз | Средняя | Покраснение, повышенная чувствительность кожи в течение 1–3 сут | |||||||||||
| Комбинированное RF-воздействие аппаратом BodyFX | Пироптоз | Низкая | Покраснение и сухость кожи в течение нескольких часов | Таблица 3. Методы аппаратного липолиза Ультразвуковой липолизУльтразвуковой липолиз бывает двух видов: низкоинтенсивное воздействие и ВИФУ (высокоинтенсивный фокусированный ультразвук). Пример аппарата
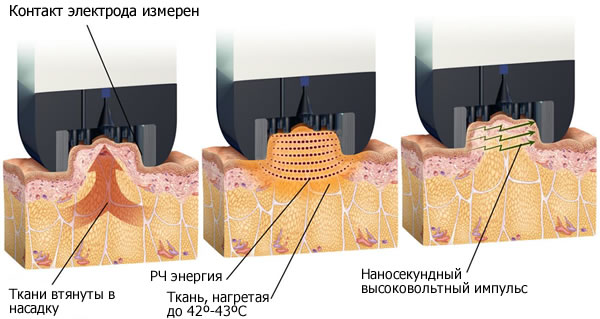
На аппарате UltraShape обычно проводят 3 процедуры (с периодичностью 2 нед), каждая занимает от 45 мин до 1,5 ч. На аппарате Liposonix обычно достаточно 1 процедуры продолжительностью от 1,5 до 2 ч. Что происходит на микроуровне?Под воздействием ультразвука происходит некроз адипоцитов. В первом случае его вызывает механический фактор — кавитация. Ультразвук создает в жидкости микропузырьки, которые быстро увеличиваются в размерах, а затем схлопываются, порождая ударную волну. В результате происходит кавитационное разрушение жировых капель в цитоплазме и «нетепловой взрыв» адипоцита. Что происходит на макроуровне?После ультразвукового липолиза клинический ответ, как правило, начинает проявляться в течение 2 нед после процедуры, а окончательно устанавливается в течение 3 мес. Ретроспективные исследования подтверждают среднее снижение окружности талии после однократной процедуры ВИФУ на 4,2–4,7 см через 12 нед. [8, 9]. Побочные эффектыПроцедуры с использованием низкоинтенсивного ультразвука обычно переносятся хорошо. Однако при использовании ВИФУ термический некроз адипоцитов может вызвать сильные болевые ощущения сразу после процедуры и отечность тканей в течение нескольких месяцев [8]. Лазерный липолизДля неинвазивного лазерного липолиза («холодный липолазер») используется низкоинтенсивное лазерное излучение (НИЛИ), находящееся в красной и инфракрасной части спектра. Пример аппаратаZerona (Erchonia Medical Inc.) — диодный лазер с длиной волны 635 нм. Что происходит на микроуровне?Механизм гибели жировых клеток при воздействии низкоинтенсивного лазерного излучения до сих пор не известен. Изначально выдвигалась гипотеза, что воздействие НИЛИ приводит к образованию микропор в мембранах адипоцитов, через которые происходит высвобождение внутриклеточных липидов [18]. Другой возможный механизм липолиза под действием НИЛИ — активация каскада комплемента, который может запустить апоптоз адипоцитов и последующее высвобождение липидов [1]. Также выдвигалось предположение, что НИЛИ стимулирует митохондрии в адипоцитах, что, в свою очередь, приводит к увеличению синтеза АТФ с последующим усилением активности цАМФ, стимуляцией протеинкиназы и цитоплазматической липазы, превращающей триглицериды в жирные кислоты и глицерин. Последние могут проходить через поры в клеточной мембране, вызывая уменьшение объема адипоцитов [13]. Однако ни одна из этих гипотез пока не нашла подтверждений. Что происходит на макроуровне?В 2013 г. американские ученые провели исследование, в котором приняло участие 86 пациентов. Курс лазерного липолиза на область талии и бедер (по 20 мин на заднюю и переднюю поверхность бедра) длился 2 недели, сеансы НИЛИ проводились через день. Через неделю после окончания курса было отмечено статистически значимое уменьшение окружности обрабатываемых зон: талия — на 2,84 см, бедра — 1,96 см [15]. Побочные эффектыПроцедура является безболезненной, побочных эффектов не выявлено. КриолиполизМетод криолиполиза основан на повышенной чувствительности жировой ткани к низким температурам. В то же время клетки эпидермиса, дермы, а также нервы и сосуды остаются устойчивы к данному воздействию. С помощью специальных манипул производится локальное охлаждении участков с избыточным количеством жировой ткани до температуры –7 oC. Пример аппаратаCoolSculpting (Zeltiq Aesthetics, Pleasanton, CA) Что происходит на микроуровне?Исследователи предполагают, что при охлаждении происходит холодовая кристаллизация жировой ткани, сопровождающаяся ишемическим повреждением, что в итоге индуцирует апоптоз адипоцитов [20]. Данные из трансплантологии позволяют предположить, что здесь имеется связь с активацией каспазы-3 [19], что подтверждает апоптотический механизм гибели клеток. Спустя 1–2 дня после процедуры в зоне воздействия начинает увеличиваться количество нейтрофилов, лимфоцитов и моноцитов. Происходит постепенное разрушение адипоцитов и фагоцитоз продуктов их распада. Этот процесс к концу первого месяца значительно активизируется, а через 90 дней — затухает [23]. Что происходит на макроуровне?Первоначальный эффект можно увидеть только спустя 3–4 нед, а окончательный результат — через 3–4 мес. Согласно крупномасштабному анализу, после одного сеанса криолиполиза наблюдается уменьшение толщины жирового слоя в среднем на 19,55% по сравнению с контролем [4]. Побочные эффектыСразу после процедуры в зоне воздействия может отмечаться некоторая болезненность, отек и покраснение. Также некоторое время может сохраняться пониженная кожная чувствительность, однако это обратимо. Кроме того, существуют данные о развитии парадоксальной гиперплазии жировой ткани в области обработки: если по первоначальным данным частота встречаемости данного осложнения составляет 0,0051% или 1 на 20 000 случаев [14], то совсем недавно в статье, опубликованной в журнале Lasers in Surgery and Medicine, исследователи говорят о 2 случаях на 422 процедуры в собственной практике [21]. А это уже 0,47%. Радиочастотный (RF) липолизПринцип действия метода основан на нагревании подкожно-жировой клетчатки переменным электрическим током радиочастотного диапазона до температуры 43–45 °С. Жировая ткань электрически неоднородна: адипоциты, почти полностью состоящие из липидов, не проводят электрический ток, однако соединительнотканные перегородки, окружающие жировые дольки, содержат воду, ассоциированную с белковыми молекулами, и обладают хорошей электрической проводимостью. Именно эти соединительнотканные перегородки и нагреваются под действием переменного электрического тока, а от них нагрев распространяется вглубь жировых долек, вызывая повышение температуры в адипоцитах. Пример аппаратаСуществует множество аппаратов для RF-липолиза (монополярные и биполярные) с разными характеристиками от различных производителей. Что происходит на микроуровне?RF-воздействие запускает апоптоз адипоцитов. Повышение температуры является сигналом для активации липолитических ферментов, которые расщепляют нейтральные жиры (триглицериды) до глицерина и жирных кислот. Образующиеся свободные жирные кислоты выходят из адипоцитов, поступают в лимфатические сосуды, а затем медленно разносятся по организму. Часть этих продуктов метаболизируется в печени, другая же поступает в мышцы и используется в качестве энергетического субстрата. Также при нагревании соединительнотканных структур происходит перестройка коллагена в септах и ремоделирование дермы [25]. Что происходит на макроуровне?Особенности RF-воздействия обусловливают не только уменьшение толщины жирового слоя, но также подтяжку тканей и уменьшение выраженности целлюлита (до 50–60%). Однако последнее видно только спустя 3–6 мес (после завершения процессов ремоделирования). Одно из последних исследований, посвященных RF-липолизу, показало уменьшение окружности талии в среднем на 4,93 см спустя 4 процедуры, проводившиеся с интервалом 1 нед [7]. Побочные эффектыНаиболее часто встречающимися нежелательными эффектами RF-липолиза является покраснение, боль и повышенная чувствительность кожи в области проведения процедуры. Все эти проявления обратимы. «Усиленный» RF-липолизЭто новая технология, основанная на комбинации RF-липолиза и электропорации жировой ткани. Последняя обеспечивает создание микроотверстий в мембранах клеток под воздействием внешнего электрического поля (высоковольтных сверхкоротких RF-импульсов), что необратимо меняет проницаемость клетки. Пример аппаратаАппарат BodyFX/TiteFX (Invasix, Йокнеам, Израиль) сочетает (рис. 2):
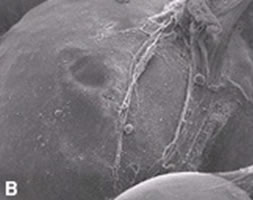
Процедуры проводятся курсом — 5–7 сеансов с интервалом 7–10 дней. Время обработки отдельной зоны зависит от ее размеров и может длиться до 30 мин. Длительность полной процедуры будет зависеть от количества областей, требующих коррекции. Что происходит на микроуровне?Пластический хирург Диана Дункан (Diane I. Duncan) исследовала механизм клеточной гибели под действием высоковольтных сверхкоротких RF-импульсов. В исследовании приняло участие 12 пациентов, которые прошли 8 процедур липолиза на аппарате BodyFX с интервалом между процедурами 1 неделю. Сканирующая электронная микроскопия адипоцитов в области воздействия выявила, что гибель клеток происходила не по механизмам апоптоза или некроза, а по механизму пироптоза (рис. 4), имеющего характеристики обоих этих процессов и отличающегося наличием воспалительного компонента [5].
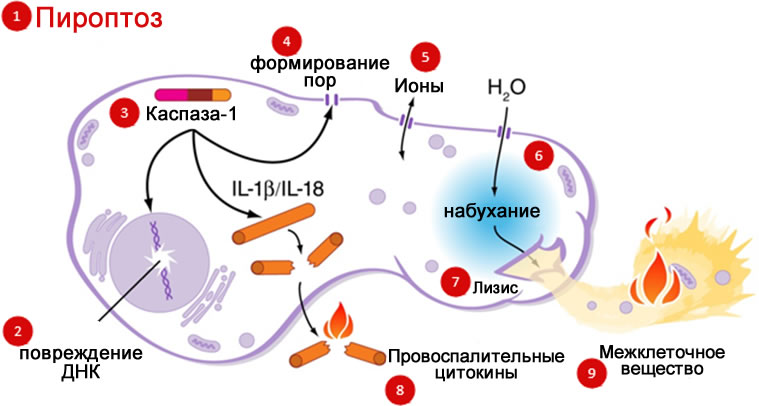
Рис. 4 (a–e). Гибель адипоцитов при коррекции фигуры на аппарате BodyFX [6] Термин «пироптоз» впервые ввел в 2001 г. американский ученый из Вашингтонского университета Брэд Куксон (Cookson) и его коллега Молли Брэннан (Brennan) для описания особого типа клеточной смерти, запускаемого в макрофагах, инфицированных бактерией Salmonella typhimurium [3]. Позднее было установлено, что этот тип гибели клеток характерен не только для макрофагов и не только при инфицировании бактериями. Он находится между противоположными процессами — некрозом и апоптозом, обладая характеристиками обоих процессов. В ходе пироптоза происходит активация каспазы-1, которая за счет ограниченного протеолиза способствует активации и выходу пирогенных ИЛ-1β и ИЛ-18 (рис. 5). Это обусловливает наличие воспалительной реакции разной степени выраженности при данном варианте программируемой клеточной смерти. Однако она будет существенно меньше, чем при некрозе, поскольку весь процесс пироптоза растянут во времени [2]. Морфологически при пироптозе в клеточной мембране образуются поры диаметром 1,1–2,4 нм, что нарушает клеточный ионный градиент. В результате увеличение осмотического давления вызывает приток воды с последующим набуханием клетки и ее разрывом. В то же время внутреннее содержимое постепенно выходит наружу через эти же поры [11]. Отличительным признаком пироптозной реакции является полная потеря объема клеткой после первичного отека. Рис. 5. Схема пироптоза [10] При технологии BodyFX\TiteFX RF-воздействие активирует липолитические ферменты и запускает процесс разрушения жиров, а сверхкороткие (наносекундные) высоковольтные импульсы приводят к появлению эффекта необратимой электропорации в мембране жировой клетки. Необратимая электропорация характеризуется образованием многочисленных мельчайших пор в поврежденной клеточной стенке, что очень похоже на ответную реакцию, наблюдаемую при пироптозе. Внеклеточный кальций проникает в эти дефекты, тем самым нивелируя эффективность системы ионной откачки. Затем происходит лизосомальный экзоцитоз. Предварительный нагрев ткани с помощью переменного тока радиочастотного диапазона, вероятно, снижает порог электропорации и делает адипоциты более восприимчивыми [6]. Что происходит на макроуровне?Первоначальный эффект можно увидеть сразу по окончании процедуры, однако окончательный результат формируется по завершении процессов ремоделирования дермы спустя 3–6 мес. У пациентов, прошедших курс из 6 процедур BodyFX \ TiteFX, спустя 3 мес окружность бедер и талии уменьшается в среднем на 3,58 см (от 1,5 до 4,4 см). Что касается целлюлита — среднее уменьшение глубины ямки или «показатель гладкости» составляют 2,9 мм или 60% (от 1,1 мм до 6,3 мм) [17]. Побочные эффектыСразу после процедуры «усиленного» RF-липолиза возможны такие побочные эффекты, как сухость кожи и ее покраснение, однако эти проявления исчезают через несколько часов. ЗаключениеНеинвазивная коррекция контуров тела является одним из самых быстрорастущих сегментов рынка эстетической медицины. Некоторые из этих процедур, как, например, RF-липолиз, не только снижают количество жировой ткани, но и оказывают выраженный эффект подтяжки кожи и коррекции целлюлита. Комбинированное использование RF-липолиза и высоковольтных сверхкоротких RF-импульсов в технологии BodyFX \ TiteFX позволило объединить ремоделирование коллагена с активной гибелью адипоцитов, которая, как было показано в последних исследованиях, протекает по механизму пироптоза. Литература
АбстрактНаиболее популярными на сегодняшний день аппаратными методами коррекции контуров тела являются: разрушение жировых клеток под действием ультразвука; лазера; холода (криолиполиз) и переменного электрического тока радиочастотного диапазона (RF-воздействие). Эти процедуры отличаются не только разными типами физиотерапевтического воздействия, но разными вариантами гибели адипоцитов. Согласно последней классификации, принято различать типы клеточной смерти не только на основании морфологических изменений, но и согласно биохимическим процессам, протекающим при них. В обзоре рассмотрены основные механизмы реализации эффектов аппаратных методов коррекции контуров тела, а также приведены новейшие данные о биологических аспектах действия «усиленного» RF-липолиза — технологии BodyFX. Источник |